
Ensayo de Verificación del Método de Inhibición Inmunoturbidimétrico para la determinación cuantitativa de Hemoglobina Glicosilada (HbA1c)
Diaz C (1), Perez S (1), Errecart MJ (1), Galetti A (1), Petrazzini R (2), Mora Dengra F (2), Collino C (1),(3)
(1) Hospital G. Rawson, Provincia de Córdoba (Bajada Pucará 2025)
(2) LABICO Bioquímica para Bioquímicos (Av. Colón 4782/56 PA)
(3) Centro de Investigaciones en Bioquímica Clínica e Inmunología (CIBICI-CONICET), Departamento de Bioquímica Clínica. Facultad de Ciencias Químicas, Universidad Nacional de Córdoba.
Correspondencia: chechusimonian@hotmail.com
Introducción
La hemoglobina (Hb) puede ser modificada por la incorporación de distintas moléculas, generalmente glúcidos mediante una reacción no enzimática. La molécula de glucosa se une a los grupos amino terminal libres de la cadena beta de la globina y se forma la HbA1c, y cuando se une la glucosa fosforilada a la cadena de globina constituyen la HbA1a y HbA1b, todas estas especies constituyen la hemoglobina glicosilada. La determinación de este analito es de gran importancia en el seguimiento de pacientes diabéticos, pues es el reflejo sensible del equilibrio del metabolismo glucídico.
La determinación de la HbA1c, representa un parámetro integral para el monitoreo de los niveles de glucemia que posee un individuo, representativo de las ultimas 6-8 semanas. El método de inhibición inmunoturbidimétrica para un control glicémico retrospectivo, presenta ventajas sobre los métodos convencionales en lo referente a la confiabilidad analítica de los valores encontrados. El objetivo de este trabajo fue aplicar el protocolo de verificación de métodos definido por el Clinical Laboratory and Standard Institute (CLSI) en la guía EP15-A2 para la determinación de la HbA1c por el método antes mencionado, con el propósito de obtener la performance de esta metodología en términos de imprecisión y veracidad
Materiales y Métodos
Se utilizaron 121 muestras de sangre periférica entera anticoagulada con EDTA-K3, proveniente de pacientes diabéticos derivados del Consultorio de Diabetes del Hospital G. Rawson de la Pcia. de Córdoba. Equipos: Autoanalizador Químico BT3000 Plus (Wiener) con principio turbidimétrico de reacción; y Variant II (Biorad) principio HPLC (Cromatografia Liquida de Alta Presión). El diseño experimental fue el descripto en la guía EP15-A2 CLSI; y para el análisis estadístico de los datos se utilizó el software StatisPro-CLSI.
Resultados
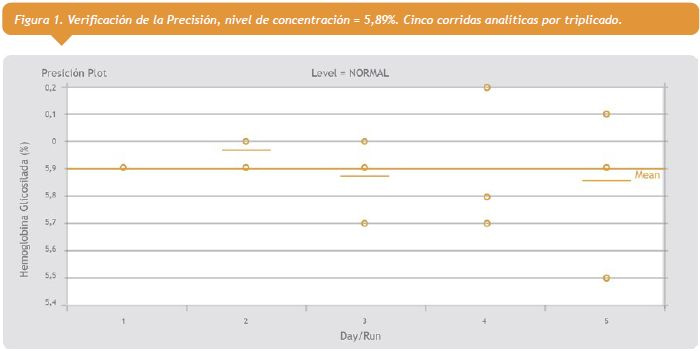
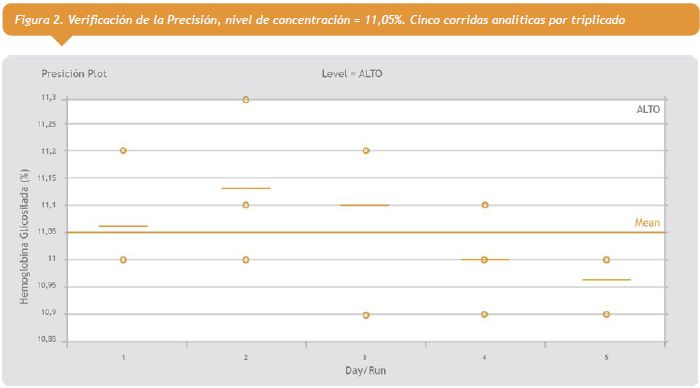
1- Precisión: Se verificó este parámetro a dos niveles de concentración: 5,89 (%), y 11,05 (%), según protocolo EP15-A2. Los valores de CV (%) obtenidos, fueron: 3,3%; y 1,1%, respectivamente; los cuales no difirieron estadísticamente del requerimiento de calidad estipulado I (%)=1,7, en condiciones “deseables” de variabilidad biológica.
Ver figura 1 a la derecha.
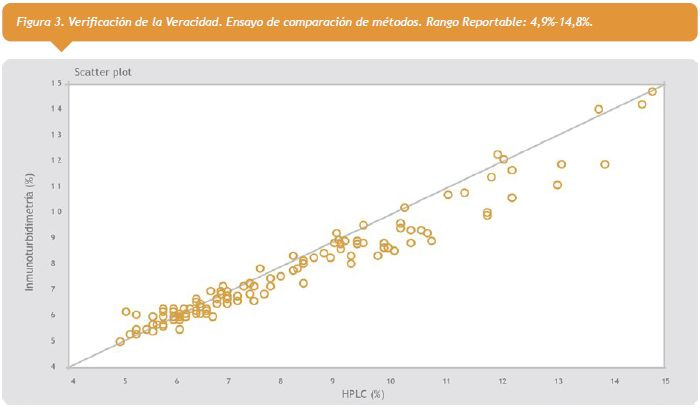
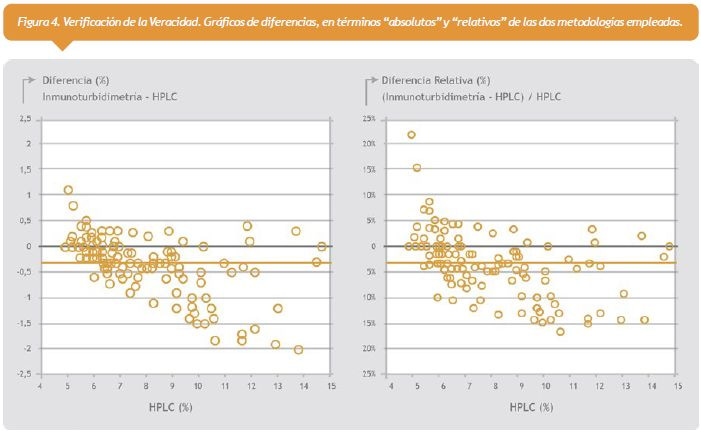
2- Veracidad: Se verificó este parámetro por comparación de métodos, según protocolo EP15-A2, en el rango reportable = 4,9%-14,8%. Se obtuvo un valor de bias aceptable relativo de -3,42%; el cual no difirió estadísticamente del requerimiento de calidad estipulado.
Ver figura 3 a la derecha.
Ver figura 4 a la derecha.
Conclusión
Los parámetros precisión y veracidad fueron verificados aplicando el diseño experimental de la guía EP15-A2 del CLSI, contrastando los valores encontrados contra los requerimientos de calidad basados en condiciones deseables de variabilidad biológica. La evaluación de la performance de esta metodología, contribuyó al diseño de una estrategia de Control de Calidad Interno partiendo de gráficas de especificaciones operativas.








