Determinación de Intervalo de Referencia: Fracción de Plaquetas Inmaduras en SYSMEX XN-3000
Trabajo Final de Investigación Artículo Original Valdivieso, Cecilia1
1Servicio de Hematología clínica – Hospital El Carmen – Mendoza – Argentina.
Año: 2018
Universidad Nacional de Córdoba
Facultad de Ciencias Químicas
Escuela de Posgrado
Carrera de Especialización en Hematología
Correspondencia: Cecilia Valdivieso. Servicio de Hematología clínica, Hospital El Carmen. Joaquín V. González 245 – Godoy Cruz. Mendoza. Cel: 02614165825 ceci.valdivieso.cv@gmail.com
Resumen
Objetivo. Establecer un intervalo de referencia para la fracción de plaquetas inmaduras en una población de pacientes sanos y evaluar si existen diferencias de acuerdo al sexo y grupo etario. Determinar si hay diferencia significativa en el % de fracción de plaquetas inmaduras (% de IPF) a lo largo del tiempo y a diferentes temperaturas.
Métodos. Se determinó el % de IPF en 132 pacientes (86 mujeres y 46 hombres) utilizando el contador hematológico Sysmex XN – 3000. Se obtuvo el % de IPF en 5 muestras a distintos tiempos conservadas a temperatura ambiente y en 5 muestras mantenidas a 4°C.
Resultados. Se verificó que existe diferencia estadísticamente significativa entre hombres y mujeres cuyos intervalos de referencia son 0,2 – 5,7% y 0,4 – 4,2% respectivamente. El intervalo de referencia para los distintos grupos etarios no varía, lo que hace innecesario su discriminación. Se comprobó que no hay variaciones en el % de IPF a lo largo del tiempo tanto en muestras mantenidas a temperatura ambiente como a 4°C.
Conclusión. El presente estudio proporciona el intervalo de referencia para el % de IPF en pacientes sanos que concurren al servicio de hematología del Hospital El Carmen, cuyos resultados quedan disponibles para su uso tanto en el ámbito médico como bioquímico teniendo en cuenta los cambios de dichos intervalos respecto al sexo. Finalmente, es importante destacar que variables como el tiempo de extracción de la muestra y su temperatura de conservación no inducen modificaciones en sus valores.
Palabras clave: trombocitopenia, plaquetas reticuladas, fracción de plaquetas inmaduras, intervalo de referencia, Sysmex XN-3000.
Summary
Objetive. To establish a reference interval for the fraction of immature platelets in a population of healthy patients and to evaluate if there are differences according to sex and age group. Determine if there is a significant difference in% fraction of immature platelets (% of IPF) over time and at different temperatures.
Methods. The% of IPF was determined in 132 patients (86 women and 46 men) using the Sysmex XN – 3000 hematological counter. The% of IPF was obtained in 5 samples at different times stored at room temperature and in 5 samples maintained at 4 ° C.
Results. It was verified that there is a statistically significant difference between men and women whose reference intervals are 0.2 – 5.7% and 0.4 – 4.2% respectively. The reference interval for the different age groups does not vary, which makes their discrimination unnecessary. It was verified that there are no variations in the% of IPF over time both in samples maintained at room temperature and at 4 ° C.
Conclusion. The present study provides the reference interval for the% of IPF in healthy patients attending the hematology service of the El Carmen Hospital, whose results are available for use both in the medical and biochemical fields, taking into account the changes of said intervals with respect to sex. Finally, it is important to emphasize that variables such as the time of extraction of the sample and its storage temperature do not induce changes in their values.
Key words: thrombocytopenia, reticulated platelets, immature platelet fraction, reference interval, Sysmex XN-3000.
Introducción
La trombocitopenia puede asociarse a sangrado severo y es una alteración hematológica muy común. El diagnóstico diferencial de trombocitopenia se ve dificultado por la cantidad de causas que la producen, entre ellas: aumento en la destrucción de plaquetas en sangre periférica como es el caso de la púrpura trombocitopénica idiopática, púrpura trombocitopénica trombótica; o por disminución de la producción de plaquetas en médula ósea como anemia aplásica, trombocitopenia pos-quimioterapia o trasplante.1–4 Un recuento de plaquetas en sangre periférica puede dar información limitada sobre la probabilidad de sangrado en el paciente trombocitopénico mientras que si pudiéramos hacer una evaluación rápida y sencilla de la producción de plaquetas nos permitiría distinguir entre trombocitopenia debido a fallo medular, en el cual es más probable que ocurra sangrado y trombocitopenia por aumento en la destrucción plaquetaria periférica, donde el sangrado es menos común.2–6
Esta evaluación rápida y sencilla se puede hacer utilizando las plaquetas reticuladas como parámetro de medición. En el momento en que las plaquetas pasan a sangre periférica liberándose del citoplasma de los megacariocitos, contienen una pequeña cantidad de ARN el cual las hace diferenciarse del resto considerándolas más inmaduras, estas son las llamadas plaquetas reticuladas (PR).5–8
Su concentración en medula ósea se correlaciona con la de los megacariocitos y es de 2 a 3 veces mayor que en sangre periférica. La vida media de las plaquetas en circulación es de 7 a 10 días mientras que las PR duran menos de un día, el número de PR en circulación aumenta cuando aumenta la trombopoyesis y por el contrario disminuye al disminuir la misma. Esto permite que sirvan como un marcador de la actividad megacariopoyética evitando de esta manera exámenes invasivos de médula ósea, como así también transfusiones de plaquetas.4,8–11
En 1969 comenzó la observación de PR al estudiar un modelo canino con hemorragia aguda, se utilizó tinción supra vital con azul de metileno y se observó un retículo punteado grueso en plaquetas, también se usó en sangre humana pero no se aplicaba de rutina en ese momento.7,8,12–14
Tiempo después se logró un gran avance cuando se comienza a usar citometría de flujo para el análisis de PR, basado en la tinción de ARN con naranja de tiazol.2,4,5,7,8 Luego de varias investigaciones se llegó a la conclusión de que las PR en sangre representan un marcador no invasivo de la actividad megacariopoyética en médula ósea. Sin embargo, el ensayo de citometría de flujo resulta carente de estandarización por lo que no se pueden lograr resultados comparables entre los distintos laboratorios. Las razones son debidas a la gran variación metodológica existente, entre ellos el tipo y la concentración de colorante fluorescente, el tiempo y la temperatura de incubación, la fijación, el tratamiento con ARNasa, el análisis de datos, etc.2,4,5,7–9 Muchos intentos de normalización fueron llevados adelante, pero no tuvieron éxito y aun si se lograra un método de estandarización tendría la desventaja de que se requiere de una gran experiencia y de un equipo especializado por lo que no podría aplicarse de rutina en cualquier laboratorio.4,5,7,8
Las PR se pueden medir de rutina y de forma confiable en el autoanalizador hematológico XN-3000 (Sysmex, Kobe, Japón) como fracción de plaquetas inmaduras (IPF). La técnica deriva del método estándar de recuento de reticulocitos y sus fracciones. Distintos estudios demuestran que el recuento de plaquetas mediante este equipo se correlaciona con el recuento por citometría de flujo lo que hace más fácil su práctica en el laboratorio de rutina sin la necesidad de contar con equipos especializados.4,5,7,8
Teniendo en cuenta que la información brindada por el proveedor técnico del instrumento antes mencionado respecto al valor de referencia del % de IPF es escasa desde el punto de vista de cómo se seleccionaron los individuos de referencia, el origen étnico, los métodos estadísticos utilizados, etc. Es que se ve necesario establecerlos para una población en particular.15,16
El objetivo de este trabajo fue determinar el valor de referencia para el % de IPF en una población sana que concurre al laboratorio de hematología del hospital El Carmen en la ciudad de Mendoza utilizando Sysmex XN – 3000 para poder incluirla en el informe del hemograma con el propósito de conseguir un mejor diagnóstico y seguimiento en pacientes con trombocitopenias y ajustando dichos valores a las características de nuestra población, considerando sexo, edad y ciertas variables pre analíticas.
Materiales y Métodos
Población en estudio:
Para establecer la población de estudio se siguió el protocolo estipulado en el documento CLSI C28-A3 ( Clinical and Laboratory Standards Institute). 17
Se realizó un estudio prospectivo en el que se obtuvieron 132 muestras de sangre de 86 mujeres y 46 hombres que concurrieron al Hospital El Carmen entre mayo y junio del 2017 para control de rutina. Estos sujetos fueron considerados sanos luego del estudio de su historia clínica y de verificar que sus recuentos sanguíneos se encontraran dentro de los parámetros normales, incluyendo plaquetas y reticulocitos. La edad media fue de 50 años (17 – 95 años): 49 años en mujeres (17 – 95 años) y 51 años en hombres (23 – 88 años).
A fin de analizar algunas variables pre-analíticas, se tomaron 5 muestras de pacientes sanos fuera de la población anterior para detectar posibles cambios referidos a tiempo de ejecución del ensayo y temperatura de conservación.
Análisis de % de IPF:
Las muestras de sangre periférica se recogieron en tubos Vacutainer K2EDTA de 3 mL (Becton Drive, Franklin Lakes, NJ, USA) por venipuntura en una extracción no traumática, en caso de tener dificultades en la obtención de la muestra se procedió a una nueva búsqueda venosa.
Todas las muestras se analizaron dentro de las 8 horas luego de su extracción y se mantuvieron a temperatura ambiente hasta su análisis. Según estudios previos, el % de IPF permanece estable hasta 24 horas a temperatura ambiente y es menos estable a 4°C.8 Esto se debe a que luego de este tiempo el ARNm se degrada y desaparece al envejecer la plaqueta.9 Los recuentos celulares y el % de IPF se obtuvieron al mismo tiempo. A fin de corroborar estos datos, 5 muestras fueron analizadas a diferentes tiempos desde el momento de la extracción de sangre y hasta 24 horas con intervalos de 2 horas hasta las 8 horas y luego a las 24 horas siguientes todo a temperatura ambiente. También se realizó el mismo procedimiento, pero manteniendo la temperatura de la sangre a 4 grados.
El contador hematológico automatizado Sysmex XN – 3000 utiliza impedancia para la mayoría de los conteos de plaquetas. Cuando la exactitud en el conteo de plaquetas no puede garantizarse por medio de la impedancia, el resultado es marcado como una alarma. Este instrumento realiza automáticamente un análisis reflexivo en un nuevo canal usando un reactivo fluorescente mediante el método de citometría de flujo con láser semiconductor. Este nuevo canal se denomina canal de plaquetas fluorescentes (PLT – F) y utiliza un colorante fluorescente de oxazina el cual se une a ácidos nucleicos contenidos dentro de organelas plaquetarias como es el ADN mitocondrial y el ARN ribosomal. De esta forma logra una mejor identificación plaquetaria diferenciándolas de partículas interferentes y sirve para calcular con precisión las plaquetas, en especial, los recuentos bajos.18
Se elabora un diagrama de dispersión bidimensional, cuyo eje X representa la intensidad de la luz fluorescente lateral (SFL) y el eje Y representa la intensidad de la luz dispersa frontal (FSC). Este diagrama de dispersión presenta grupos de plaquetas, parte de los eritrocitos, parte de los leucocitos y detritos celulares. (Figura 1)
Figura 1. Histograma de distribución celular del Sysmex XN – 3000.
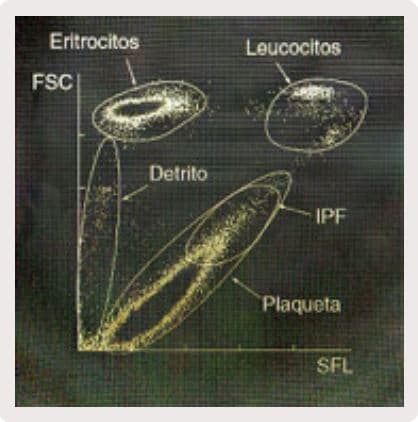
Así como analizamos reticulocitos y otras células inmaduras los analizadores de la serie XN tienen capacidad similar en el análisis de plaquetas. El IPF se obtiene como una proporción entre el recuento de plaquetas en el área con fuerte intensidad de luz fluorescente en el diagrama PLT-F (zona IPF) y el recuento total de plaquetas.
El equipo utilizado consta de un control de calidad interno llamado XN-Check a tres niveles (bajo, normal y alto), el cual se realiza diariamente y un control inter-laboratorios en donde los datos recopilados en el control de calidad interno diario se cargan a una página de Sysmex y se comparan a nivel latinoamericano (Insight).
Análisis estadístico:
El análisis estadístico se llevó a cabo utilizando el software estadístico Infostat (versión 2016). Se detectaron y eliminaron valores anómalos. Para el estudio de normalidad se aplicó el test Shapiro – Wilks modificado, en los casos en que los datos no ajustaron a una distribución normal se les aplicó transformación logarítmica para que ajusten a dicha distribución. Luego de dicha transformación todos los datos lograron una distribución normal por lo que se aplicó Prueba t para muestras independientes, esto permitió determinar si era necesario particionar por sexo. Para evaluar si era necesario particionar según grupo etario se aplicó análisis de varianza. Las variables simétricas fueron expresadas como media y desviación estándar (media +/- 2SD). Los valores de p<0,05 se consideraron estadísticamente significativos. Se determinaron los valores de referencia para un intervalo de confianza del 95%.
Resultados
Se comenzó con el estudio de nuestra población analizando los valores según sexo, luego de detectar y eliminar valores anómalos se prosiguió por aplicar la prueba de normalidad con la cual se verificó que el recuento de plaquetas tenía una distribución normal (p=0,0986 y p=0,3478 tanto en femenino como masculino respectivamente) motivo por el cual se utilizó Prueba T para muestras independientes (método paramétrico) para corroborar si era necesario particionar (p=0,0056), de acuerdo a esto se calcularon valores de referencia para la población masculina y femenina (Tabla1).
Tabla 1. Valores de referencia para plaquetas y % de IPF en hombres y mujeres.

En el caso del % de IPF detectamos que siguió una distribución asimétrica (p=0,0049 para femenino y p=0,0169 para masculino). Se realizó transformación logarítmica y se aplicó Prueba T para muestras independientes (p=0,0044) lo que determinó que es necesario particionar según sexo. Los valores de referencia para dicho analito se expresan en la Tabla 1.
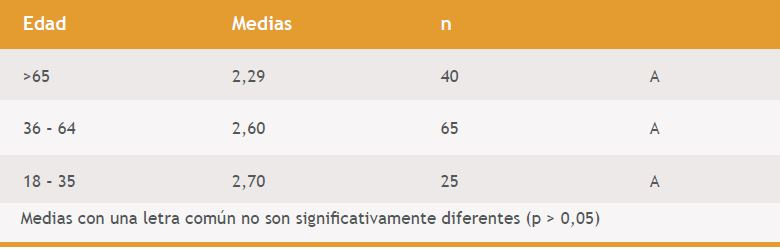
Luego se aplicó análisis de varianza para separar el intervalo de referencia según grupo etario (adultos jóvenes: 18 – 35 años; adultos: 36 – 64 años, ancianos: mayores de 65 años). Dicho análisis indicó que no hay diferencia significativa entre los distintos grupos etarios (p=0,2382). (Tabla 2)
Tabla 2. Comparación de medias del % de IPF de los tres grupos etarios. (Análisis de varianza)
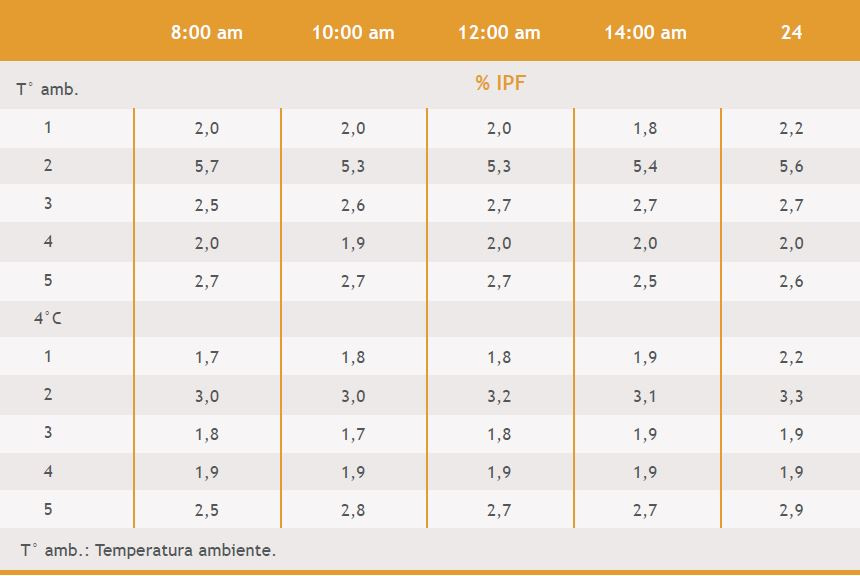
Con respecto a las muestras sometidas a distintos tiempos y temperaturas se observó que no existe variación en el % de IPF si se posterga su análisis hasta un máximo de 24hs, ya sea que se conserven a temperatura ambiente o a 4°C. Todas las muestras mostraron valores de % de IPF prácticamente iguales luego de someterlos a dichos cambios. (Tabla 3)
Tabla 3. Porcentaje de IPF obtenido a diferentes tiempos en 5 muestras conservadas temperatura ambiente y 4°C
Discusión
La utilidad clínica del IPF ha sido investigada para el diagnóstico y seguimiento de trombocitopenia, de esta manera, frente a un recuento bajo de plaquetas se puede deducir rápidamente la causa subyacente y determinar si es debido a un fallo medular o a un aumento en la destrucción periférica, así como también se ha investigado la relación que hay entre la recuperación en el número de plaquetas y el aumento de IPF luego de un trasplante de medula ósea o pos-quimioterapia, verificando que este último da información más precoz evitando así transfusiones innecesarias.3–7,10,11,19
El IPF se informa como porcentaje de IPF (% de IPF). Un % de IPF alto indica aumento en la destrucción periférica de plaquetas con una trombopoyesis aumentada en medula ósea, mientras que un % de IPF bajo indica disminución de la trombopoyesis y fallo en médula ósea.3–5,20
Determinar el intervalo de referencia del % de IPF en pacientes sanos es de gran utilidad para poder usarlo como parámetro en el diagnóstico y seguimiento de trombocitopenias evitando análisis invasivo de medula ósea, así como también al momento de definir la necesidad de administrar concentrados de plaquetas en pacientes trombocitopenicos.2,5,6,8,11,15,16 Contando con un intervalo de referencia confiable se hace más accesible y menos engorroso el momento en el que se debe investigar para poder aplicar correctamente dicho parámetro.21
Es importante manejar valores de referencia teniendo en cuenta el caso clínico y el estado del paciente para una adecuada interpretación de los resultados provistos por las nuevas tecnologías, así como también es importante la actualización por parte de profesionales médicos de los nuevos parámetros para un mejor aprovechamiento de estos recursos.21
En nuestro estudio, se pudo determinar el siguiente rango de referencia: hombres 0,2 – 5,7; mujeres 0,4 – 4,2. Dicho rango es más bajo que el establecido por el fabricante del equipo utilizado (rango entre 1,8-7,9 para n = 43; rango entre 1-7 para n = 80; rango entre 0,9-11,2 para n = 104)18 y este último, a su vez, no discrimina según sexo.
Por otro lado, al compararlo con los elaborados por otros autores encontramos similitudes con Morkis y col. (rango: 0,8-5,6%; 0,8-4,7% para femenino y 0,7-6,1% para masculino)21; Ko y col. (rango: 0,5-3,3%), aunque este tampoco hace diferencia entre géneros; con respecto a Jung y col. (rango: 0,5-3,2% para género masculino; 0,4-3% para género femenino)4 se evidencia un rango un poco más estrecho sobre todo en el género masculino. Ninguno de los anteriores discrimina según grupo etario.
Las diferencias que se encuentran en otros reportes, respecto del nuestro, pueden deberse a variaciones étnicas, metodológicas, instrumentales, tamaño de muestra, análisis estadístico. Esto indica claramente que al momento de utilizar valores de referencia cada laboratorio debería establecer sus propios rangos de referencias y separarlos, además, por sexo.
Otro dato interesante que se demostró en este estudio es que no existen diferencias en los valores de referencia cuando se agrupa a los sujetos estudiados por rango etario. En efecto, tal cual se muestra en la tabla 2, no se encontraron diferencias estadísticamente significativas cuando las muestras se clasificaron de esta manera.
Con respecto al tiempo y temperatura en el cual se procesan las muestras es importante tener en cuenta que si bien otros autores expresan los cambios según estas variables pre analíticas8,9 en el presente estudio no se demostraron variantes dependientes del tiempo y la temperatura lo cual es bueno tener en cuenta a la hora de utilizar el % de IPF.
En conclusión, se determinó el valor de referencia del % de IPF para poder incluirlo en el informe de hemograma contribuyendo, de esta manera, con la aplicación clínica de dicho índice al dejarlo al alcance de otros profesionales. La no interferencia de variables analíticas aquí estudiadas (tiempo y temperatura) disminuye el margen de error a la hora de informar este parámetro. Se demostró también, que existen diferencias en los rangos de referencia entre hombres y mujeres y no se observó esta disimilitud en los diferentes grupos etarios analizados.
AGRADECIMIENTOS:
Asesores científicos: Guglielmone, Hugo; Mosconi, Sergio.
Jefe de Sección de Hematología: Aberastain, Ana.
Recolección de datos: Manrique, Romina; Kordys, Eugenia.
Referencias bibliográficas
1. Cesari F, Marcucci R, Gori AM, et al. Reticulated platelets predict cardiovascular death in acute coronary syndrome patients: Insights from the AMI-florence 2 study. Thromb Haemost. 2013;109(5):846-853.
2. Briggs C, Kunka S, Hart D, Oguni S, Machin SJ. Assessment of an immature platelet fraction (IPF) in peripheral thrombocytopenia. Br J Haematol. 2004;126(1):93-99. .
3. Ko YJ, Kim H, Hur M, et al. Establishment of reference interval for immature platelet fraction. Int J Lab Hematol. 2013;35(5):528-533.
4. Jung H, Jeon HK, Kim HJ, Kim SH. Immature platelet fraction: Establishment of a reference interval and diagnostic measure for thrombocytopenia. Korean J Lab Med. 2010;30(5):451-459.
5. Yamaoka G, Kubota Y, Nomura T, et al. The immature platelet fraction is a useful marker for predicting the timing of platelet recovery in patients with cancer after chemotherapy and hematopoietic stem cell transplantation. 2010:208-216.
6. van der Linden N, Klinkenberg LJJ, Meex SJR, Beckers E a M, de Wit NCJ, Prinzen L. Immature platelet fraction measured on the Sysmex XN hemocytometer predicts thrombopoietic recovery after autologous stem cell transplantation. Eur J Haematol. 2014;93(2):150-156.
7. Pons I, Monteagudo M, Lucchetti G, et al. Correlation between immature platelet fraction and reticulated platelets. Usefulness in the etiology diagnosis of thrombocytopenia. Eur J Haematol. 2010;85(2):158-163.
8. Hoffmann JJML. Reticulated platelets: analytical aspects and clinical utility. Clin Chem Lab Med. 2014;52(8):1107-1117.
9. Arellano-Rodrigo E. Papel de las plaquetas reticuladas en la evaluación clínica de la trombocitopoyesis. Med Clin (Barc). 2009;133(3):95-97.
10. Meintker L, Fritsch JD, Ringwald J, Krause SW. Immature platelets do not reliably predict platelet recovery in patients with intensive chemotherapy or stem cell transplantation. Vox Sang. 2017;112(2):132-139.
11. Bat T, Leitman SF, Calvo KR, Chauvet D, Dunbar CE. Measurement of the absolute immature platelet number reflects marrow production and is not impacted by platelet transfusion. Transfusion. 2013;53(6):1201-1204.
12. Oellers DE, Bauer N, Ginder M, Johannes S, Pernecker I, Moritz A. Optimized gating and reference ranges of reticulated platelets in dogs for the Sysmex XT-2000iV. BMC Vet Res. 2016;12(1).
13. Armstrong PC, Hoefer T, Knowles RB, et al. Newly formed reticulated platelets undermine pharmacokinetically short-lived antiplatelet therapies. Arterioscler Thromb Vasc Biol. 2017;37(5):949-956.
14. Schmoeller D, Picarelli MM, Paz Munhoz T, Poli de Figueiredo CE, Staub HL. Mean Platelet Volume and Immature Platelet Fraction in Autoimmune Disorders. Front Med. 2017;4(September):1-5.
15. Siest G, Henny J, Gräsbeck R, et al. The theory of reference values: An unfinished symphony. Clin Chem Lab Med. 2013;51(1):47-64.
16. Solberg HE. The IFCC recommendation on estimation of reference intervals. The RefVal program. Clin Chem Lab Med. 2004;42(7):710-714.
17. Clsi. Defining , Establishing , and Verifying Reference Intervals in the Clinical Laboratory; Approved Guideline. Vol 20. 2008.
18. Analyzer AH. XN series. 2012;(December):0-13.
19. Takami a, Shibayama M, Orito M, et al. Immature platelet fraction for prediction of platelet engraftment after allogeneic stem cell transplantation. Bone Marrow Transplant. 2007;39(8):501-507.
20. Gonçalo AP, Barbosa IL, Campilho F, Campos A, Mendes C. Predictive Value of Immature Reticulocyte and Platelet Fractions in Hematopoietic Recovery of Allograft Patients. TPS. 2011;43(1):241-243.
21. Morkis IVC, Farias MG, Scotti L. Determination of reference ranges for immature platelet and reticulocyte fractions and reticulocyte hemoglobin equivalent. Rev Bras Hematol Hemoter. 2016;38(4):310-313.







