Utilización de los factores de riesgo y modelos clínicos predictivos para el diagnóstico de la enfermedad tromboembólica venosa
Dr. C. Danilo Nápoles Méndez y MsC. Dayana Couto Núñez
Hospital General Docente “Dr. Juan Bruno Zayas Alfonso”, Santiago de Cuba, Cuba
MEDISAN 2015; 19(1):88
Danilo Nápoles Méndez. Hospital General Docente “Dr. Juan Bruno Zayas Alfonso”, avenida Cebreco, km 1½, reparto Pastorita,
Santiago de Cuba, Cuba. Correo electrónico: danilon@medired.scu.sld.cu
Resumen
La enfermedad tromboembólica constituye un problema de salud que pone en riesgo la vida de miles de pacientes y en ella se encuentran relacionadas la trombosis venosa profunda y el tromboembolismo pulmonar. Su diagnóstico resulta difícil teniendo en cuenta que las manifestaciones clínicas y la mayoría de los medios para ello presentan limitaciones, de ahí la importancia de considerar de gran utilidad tanto los factores de riesgo como los test de probabilidad clínica para lograr un mejor enfoque; sin embargo, los cambios fisiológicos durante el embarazo favorecen la enfermedad y hacen más difícil el diagnóstico. Esta revisión tiene como objetivo ofrecer una información actualizada con vistas a orientar a la comunidad médica en el uso adecuado de estas herramientas y despertar en los obstetras la necesidad de trabajar con un modelo clínico predictivo, propio para el embarazo y puerperio.
Palabras clave: embarazo, puerperio, enfermedad tromboembólica venosa, factor de riesgo, modelo clínico.
Abstract
Thromboembolic disease constitutes a health problem risking the life of thousands of patients, and there are in it the deep venous thrombosis and lung thromboembolism. Its diagnosis is difficult keeping in mind that the clinical manifestations and most of the diagnostic tools for them have limitations, so, it is important to consider the usefulness of risk factors as well as the test of clinical probability to achieve a better approach; however, the physiologic changes during pregnancy favour the disease and make the diagnosis more difficult. This review has as objective to offer an updated information with the aim of guiding the medical community in the appropriate use of these tools and of rising in the obstetricians the necessity to work with a clinical and predictive model, adequate for pregnancy and puerperium.
Key words: pregnancy, puerperium, venous thromboembolic disease, risk factor, clinical model.
Introducción
La enfermedad tromboembólica venosa (ETV) es un problema importante de salud a escala mundial y afecta tanto a la población de países desarrollados como en vías de desarrollo, a la vez que constituye la tercera afección por causas vasculares después del infarto del miocardio y el ictus, con una incidencia 100 veces mayor en individuos hospitalizados; asimismo, ocasiona de 10-15% de la mortalidad intrahospitalaria. Esta afección es muy letal en todo el orbe y alcanza cifras de mortalidad que llegan a 30% en algunas regiones de Europa, donde se considera como evento predisponente principal la incidencia de trombofilias (50%).1,2
En los EE.UU. ocasiona 1 millón de trombosis venosa profunda (TVP) por año y 100000 muertes por embolia pulmonar. Al respecto, en la Unión Europea se notifican 160 TVP por cada 100000 habitantes por año y en España 90000 TVP cada año. Por esta razón, 5,2 millones de individuos son susceptibles de profilaxis anualmente y se calculan costos de 1500 y 420,7 millones de dólares anualmente en EE UU y Europa respectivamente.2-5
Durante el embarazo y el puerperio se le considera una de las primeras causas de morbilidad y mortalidad maternas de origen no obstétrico en países desarrollados y en vías de desarrollo. En este período la ETV es 5 veces más frecuente que en no gestantes de igual edad. Alrededor 80% de estos eventos tromboembólicos son venosos y 20% arteriales; de los primeros, 75% son en forma de TVP y 25% de tromboembolismo pulmonar (TEP).
Al respecto, en estudios efectuados en la provincia de Santiago de Cuba durante 15 años, la TVP predominó durante el embarazo y el TEP durante el período puerperal.1,6
Resulta interesante recordar que el diagnóstico de la ETV durante el período grávido puerperal se torna más difícil teniendo en cuenta que las gestantes presentan con frecuencia molestias y aumento de volumen en los miembros inferiores, propio de los cambios durante el embarazo. Por otro lado, la frecuencia cardíaca y respiratoria también se modifican en un gran número de embarazadas, así como la tolerancia del decúbito supino, por lo que el diagnóstico de esta entidad clínica se torna más difícil.1,3,7 Han sido empleados numerosos modelos predictivos para el diagnóstico de esta afección, como los de Well,8,9 que son los de mayor aceptación en la comunidad médica, de manera que este se considera de valor para el diagnóstico y la estratificación del paciente para la toma de decisiones; sin embargo, su utilidad en obstetricia puede encontrar limitaciones, por lo cual resulta importante establecer un modelo propio para la atención de gestantes y puérperas.
Factores de riesgo de ETV
Un factor de riesgo, es un elemento predisponente a la aparición de una enfermedad que se presenta con un aumento de la incidencia en comparación con la media de la población normal y que va in crescendo. La evidencia científica en múltiples estudios plantea que la aparición de un evento tromboembólico generalmente se produce por la sinergia de más de un factor de riesgo, aunque se plantea también la presencia de enfermedad tromboembólica sin factores de riesgo.10,11
Sexo
Se presenta con más frecuencia en las mujeres en vida reproductiva y en los hombres durante la ancianidad, pero estudios en Suecia y Noruega señalan escasa diferencia entre ambos.10
Edad e inmovilización
La frecuencia es baja en menores de los 40 años y después de esta edad se duplica cada 10 años. Se presenta, además en 1 de 1000,000 individuos de 15 años o menos, comparado con 1 en 100 por encima de los 80 años. Por otro lado, la inmovilización es capaz de aumentar el riesgo después de 3 días de reposo a partir de los 45 años, también se relaciona la presencia de ETV en 15- 20% de los que fallecen en la primera semana de reposo y en 77-94% de las que fallecen pasado este tiempo.10,11
Enfermedad tromboembólica venosa previa
Es 3 veces más frecuente cuando no hay otros factores de riesgo y 6 veces más cuando existen factores de riesgo asociados. Los pacientes con trombosis superficial desarrollan ETV en 4,5% a 7,7 veces en los 3 meses subsiguientes.10,11
Cirugía
Los pacientes expuestos a cirugía mayor (cirugía de cadera y rodilla), tienen 50% de predisposición, con mayor frecuencia en el posoperatorio inmediato; también se plantea que la cirugía mayor 12 semanas previas se encuentra presente en más de 20% de la ETV y tiene un riesgo de 4 a 22 veces superior.10,11
Traumatismo, tabaquismo y obesidad
Aproximadamente 20% de los politraumatizados pueden presentar tromboembolismo masivo. Se ha demostrado una frecuencia de TEP en pacientes con fractura de pelvis, tibia, fémur y columna; el tabaquismo y la obesidad son factores independientes.10-12
Neoplasias
Los aparatos que más se relacionan con trombosis son: sistema digestivo, genitourinario, pulmón, próstata y páncreas, determinando un riesgo de 1,7 a 6,7%.10,11
Diabetes y enfermedad cardíaca
Se señala que en pacientes con diabetes es 1,4-2,3 veces mayor la presencia de TEP y puede relacionarse con el grado del daño vascular que acompaña esta entidad clínica. Por su parte, la enfermedad cardíaca se considera un factor de riesgo independiente para TEP y se presenta mayoritariamente en los de clases III y IV.10,11
Anticonceptivos orales
La evidencia estadística es muy sugestiva en el sentido de que dichos anticonceptivos incrementan el riesgo de trombosis venosa y arterial y causan muertes por esta complicación. Antes de 1995, se admitía que el componente progestágeno de los contraceptivos orales no contribuía al riesgo de trombosis; sin embargo, los datos más recientes muestran un mayor riesgo con las progestinas de tercera generación (desogestrel y gestodene) que con las de segunda; mientras que los efectos benéficos de las progestinas de tercera generación sobre los niveles de colesterol HDL han sugerido que podrían disminuir el riesgo de trombosis arterial. Los anticonceptivos orales de primera generación predisponen de 4 – 8 veces; los de segunda, de 3-4 veces; los de tercera, de 3 – 9 veces y los de cuarta de 6,3 – 6,8 veces.10,11
En otros comentarios, los glucocorticoides aumentan el riesgo de ETV de 2-4,7 veces y los antipsicóticos de 2-28,7 veces.10-13
Otro grupo de enfermedades también están relacionadas con el riesgo de ETV, entre ellas se encuentran: infecciones, enfermedad inflamatoria intestinal, artritis, enfermedad obstructiva pulmonar crónica, hiperlipemia, síndrome nefrótico, lupus eritematoso, hipertensión, trasplante renal, Cushing, estados de deshidratación, enfermedad drepanocítica, insuficiencia cardíaca congestiva; asimismo, se plantean que los grupos sanguíneos no O son predisponentes, el síndrome de Klippel Trenaunay, alteraciones de la vena cava como agenesia, duplicación, atresia o transposiciones. Entre otras causas se incluyen el daño espinal, el uso prolongado de torniquete neumático y la cirugía beriática.11
Trombofilias
Estas ocasionan determinados estados de hipercoagulabilidad y pueden ser congénitas o adquiridas. Entre las primeras se encuentran el déficit de antitrombina III, de proteínas C y S, así como la mutación del factor V de Leiden en sus variedades homocigóticas y heterocigóticas. En la primera variedad es 90 veces más común la aparición de fenómenos trombóticos en la población europea, principalmente en individuos blancos de ojos azules, con un riesgo de recurrencia (RR) de 34,4 (9,86–120,05) durante la gestación.1,13-15
Otra trombofilia congénita está dada por la mutación del gen de la protrombina, codificado en el nucleótido G202010A. En 1996 se describió una mutación en la región 3´no trasladada del gen de la protrombina, lo cual elevó los niveles plasmáticos de esta y se encontraba presente en cerca de 2% de la población sana, con diferencias regionales.1,10,
La trombofilia adquirida tiene representación en el síndrome antifosfolipídico, con características especiales en el embarazo. Las formas secundarias de dicho síndrome se presentan en el lupus eritematoso, alcoholismo, vasculitis y escleroderma, artritis reumatoidea e infecciones; las formas primarias, acompañan la gestación. Entre 60-70% de los fenómenos trombóticos tienen lugar en los miembros inferiores, pero pueden aparecer en otras localizaciones venosas: venas renal, suprarrenal, cava inferior, porta, mesentérica y suprahepática (síndrome de Budd-Chiari). Las formas arteriales que se presentan en menor proporción aparecen básicamente a nivel central y manifestadas como infarto cerebral o formas atípicas localizadas en retina, subclavia y braquial.1,16
En el curso del embarazo 15% de las pacientes con este síndrome pueden presentar TVP y 50% TEP, con un RR de 15,8 (10,9 – 22,8).1,16
Otro evento que constituye un factor de riesgo son los estados de hiperhomocisteinemia. La homocisteína es considerada un marcador de daño vascular cerebral, coronario y periférico, por alteración de los procesos enzimáticos que acompañan la transulfuración de la homocisteína o la remetilación a metionina, de lo cual se derivan las causas congénitas; las adquiridas, están relacionadas con déficit de vitaminas B6, B12 y ácido fólico, tan frecuente en el embarazo, lo cual hace que las gestantes estén altamente predispuestas a la aparición de este marcador, también considerado dentro del daño vascular en mujeres con preeclampsia. Por último, es válido destacar que entre los medicamentos que propician la elevación de la homocisteína en sangre se encuentran los anticonceptivos hormonales; factor a tener en cuenta en las mujeres en edad reproductiva, para quienes estos fármacos tienen una gran demanda. 1
Viajes prolongados
La mayor evidencia en relación con la predisposición a la trombosis como consecuencia de los viajes, es que se presenta como embolismo pulmonar inmediatamente después del aterrizaje. Estudios realizados demuestran que el riesgo de embolismo precoz aumenta en forma exponencial cuando el tiempo de vuelo es superior a las 6 horas y puede alcanzar a 1 de 200000 pasajeros que viajan de forma ininterrumpida por más de 12 horas. La explicación más probable es que la disminución del flujo venoso en las piernas durante la inmovilización y flexión prolongada favorece el desarrollo de la trombosis. Los casos registrados sugieren que en la mayoría de ellos, la trombosis afectó a individuos que tenían otros factores de riesgo.10
Pacientes en la unidad de cuidados intensivos
Entre los factores de riesgo derivados de la atención a pacientes críticos figuran la ventilación mecánica, la inmovilización, el uso de catéteres, los sedantes y el empleo de medicamentos polarizantes. Por otro lado, las trombosis en miembros superiores están relacionadas con el número de punciones y catéteres, con la duración y el tipo de catéter, así como también con los cambios y las características de los fluidos utilizados. 10,17
Accidentes cerebrovasculares
Se aproximan a 42% la frecuencia de TVP en pacientes con ictus y se localizan la mayoría de las veces en el miembro paralizado. En una revisión de 1538 pacientes con esta afección, la embolia pulmonar fue la causa de muerte en 13,6% del total de estos, entre las 3 semanas del episodio agudo.1,10,13
Terapia hormonal de remplazo
Un meta-análisis basado en 12 estudios arrojó que el empleo corriente de estrógenos en la posmenopausia se asocia con un aumento al doble del riesgo de tromboembolismo venoso; sin embargo, otros estudios señalan riesgo incrementado con esta terapia mayor de de 1,4-4 veces.1,10,11
Para un riesgo basal de ETV de 1,3 por 10000 mujeres/ año, la administración de estrógenos se asocia con un riesgo adicional de 1,5 eventos más. Cuando se considera la duración del uso, el riesgo incremental absoluto es de 3,2 eventos adicionales para los primeros 12 meses y 1,2 eventos adicionales luego de los 12 meses, lo cual se corroboró en varios estudios observacionales. Se ha demostrado, además, que las mujeres que utilizan terapia hormonal combinada con estrógenos – progestágenos, aumentan de 2-5 veces el riesgo desarrollar enfermedad tromboembólica. Determina das trombofilias congénitas también aumentan dicho riesgo cuando se asocia este tratamiento.10
Embarazo y puerperio
Básicamente, el embarazo es considerado como un evento trombofílico per se y la mujer no se recupera hasta 8 semanas después del parto. Las principales modificaciones están relacionadas con el aumento de los factores de la coagulación, particularmente el fibrinógeno, los factores VII,VIII, IX, entre otros, donde el factor VIII llega a elevarse a 310% comparado con mujeres no gestantes. Por otro lado, el aumento selectivo del factor VII se asocia a eventos de tipo trombóticos, mientras el fibrinógeno y el factor VIII se consideran reactantes de fase aguda y se elevan tanto procesos fisiológicos como patológicos.1,14,18
En los sistemas anticoagulantes fisiológicos, la antitrombina III no se modifica, la proteína S decrece y solo se acrecienta en 88% la proteína C, como repuesta al gran incremento de los factores V y el VIII en comparación con no gestantes.1
Los cambios en las plaquetas se relacionan con el aumento de la agregación plaquetaria, aun cuando asciende la producción de prostaciclina por el trofoblasto; sin embargo, se observa falta de sensibilidad de las plaquetas a la sustancia vasodilatadora y disminución del adenosín monofosfato cíclico (AMPc), de modo que se conoce la relación inversa de este con la agregación plaquetaria, lo cual predispone al final de la gestación a la formación de microtrombos.1,14,15,18
El sistema fibrinolítico se encuentra debilitado en relación con el aumento del inhibidor del activador del plasminógeno (PAI-1 y PAI-2). El primero de síntesis en células endoteliales y el segundo en placenta, los cuales se elevan 2 y media veces y 30 veces, respectivamente. 1,18-21
Mediante ecografía Doppler se observa la disminución de la velocidad de flujo y, por tanto, cambios circulatorios en los miembros inferiores. Por otra parte, aumenta la estasis venosa en las extremidades inferiores y durante el tercer trimestre el flujo venoso desciende en 50%, como consecuencia de la acción mecánica que tiene el útero grávido sobre el retorno venoso y de la acción de la progesterona sobre la musculatura vascular, la cual incrementa la distensibilidad y disminuye el tono venoso.1,11
Por último, también existe cierto grado de activación endotelial durante el embarazo y lesión vascular durante el parto, estas se relaciona básicamente con el estado de estrés trombogénico, dado por los estados de deshidratación, hemorragias, trabajo de parto disfuncional y traumático, cirugía trombogénica (cesárea) e infecciones. Aparte de estos cambios fisiológicos puede existir una serie de factores de riesgo, ya sean preexistentes o de nueva aparición durante el embarazo, que incrementan de forma significativa el riesgo.1,16,19,22-27
En un estudio de seguimiento de ETV en el embarazo y puerperio durante 15 años los elementos de relevancia se presentaron de la manera siguiente: El riesgo de ETV fue alto, con una frecuencia de 1,41 por 1000 nacimientos (1,02 TVP y 0,39 TEP).7 Por otra parte, 79,6% de las integrantes de la serie presentaron TVP en el período anteparto, con predominio en el III trimestre (39,6%). Como factores de riesgo para TVP primaron las várices (33,3%), el reposo prolongado (31,8%) y los anticonceptivos orales (29,3%); como síntomas fundamentales, el dolor, el edema, la taquicardia, así como el signo de Ollow (84%). Por otra parte, el miembro inferior izquierdo se vio afectado en 69,6% debido a la comprensión que ocasiona la arteria ilíaca derecha sobre la vena ilíaca izquierda en el sitio donde se cruzan. Afortunadamente, es la que menos emboliza a pesar de ser la más frecuente.7
Asimismo, el TEP prevaleció en el puerperio (71,8%), lo cual evidencia que es el momento esencial en la embolización del trombo. Este se asoció con la cesárea en 65,4% de las pacientes y a la infección posparto en 38,5%, donde también se destacaron la falta de aire, la taquicardia y la ansiedad como elementos clínicos básicos.7 La cesárea es una cirugía que incrementa las pérdidas sanguíneas y ocasiona daño endotelial. Al respecto se afirma que es 9 veces más frecuente la aparición de TEP cuando se realiza esta cirugía, teniendo en cuenta que los fenómenos de embolización pueden ser 20 a 80 veces más comunes después del parto que en el período antenatal.7
Recientemente se produjo una defunción materna por TEP en la cual al emplear el test de probabilidad de Well 9 y basado en esta escala, la paciente alcanzaba solo el puntaje para mediano riesgo, esto desconcertó al equipo de asistencia que trabajaba en la unidad de cuidados intensivos, pues esta escala no tenía otros elementos relevantes de riesgo y que se incluyen en el comportamiento de los datos ofrecidos durante 15 años de trabajo, lo que evidencia la necesidad de un test de probabilidad propio para la evaluación de gestantes y puérperas que permita una mejor evaluación de las pacientes. Los autores de esta revisión trabajan en este sentido.7
Modelos Clínicos
Un modelo clínico predictivo de probabilidad o pretest es considerado como un instrumento matemático diseñado para la orientación profesional en áreas de incertidumbre para facilitar la toma de decisiones. Se considera, además, una herramienta en la que se incluyen 3 o más variables tomadas de la historia clínica, examen físico y técnicas de diagnóstico simple que proporcionarán la probabilidad de un determinado resultado o sugieren un diagnóstico o una acción terapéutica. Un valor de relevancia se relaciona con la posibilidad de poder estratificar los pacientes, lo cual conduce a una mejor identificación y permite adoptar posiciones diagnósticas o terapéuticas en función del riesgo estimado.11
Históricamente, los resultados de los estudios anátomopatológicos han demostrado lo inconsistente de un número de medios de diagnóstico para la TVP y el TEP; sin embargo, los de mayor exactitud pueden ser un poco más invasivos y limitar en muchos casos su realización, en especial durante el embarazo. Por otro lado, los métodos basados solo en las manifestaciones clínicas y el examen físico también carecen de precisión para un diagnóstico positivo o negativo.1,11,28-31
En 1981 Vine32 correlacionó un grupo de variables que fueron evaluadas y extraídas de la historia clínica, relacionadas o no a la flebografía. De ellas 9 se asociaron a riesgo mayor y 4 a riesgo menor y de este modo surgió una de las primeras pruebas clínicas de probabilidad para riesgo de ETV. En 1990 Landefeld 33 logró la estratificación de variables a 3 grupos de riesgo: alto, mediano y bajo, pero esto era específico para diagnosticar TVP en los miembros inferiores.
Más tarde Nypaver 34 relacionó variables clínicas con la ecografía de los miembros inferiores para el diagnóstico de TVP, pero fue en 1995 cuando surgió el primer modelo de probabilidad descrito por Well et al,8 con gran éxito en la comunidad médica. En este se tuvo en cuenta el análisis de 12 variables clínicas predictivas que clasificaron la probabilidad de TVP en alta, mediana y baja. En 1997 Wells et al,9 mantuvieron esta clasificación, pero redujeron las variables a 9.
Los modelos anteriores de estos autores 8,9 habían mantenido el antecedente de trombosis venosa profunda entre los criterios de exclusión. En 2003 se incluyó esta variable en su test, de manera que la estratificación ahora sería en probable o improbable, pero con el mismo número de dichas variables. La repercusión internacional de estos modelos trajo consigo que otros autores 35-39 realizaran test de probabilidad y trataran de modificar el modelo original del autor, pero no lograron abrirse paso en su aceptación.
Muchos de los modelos comentados no permiten por sí solo diagnosticar una trombosis venosa, es por eso que algunos de ellos no excluyen la utilidad de asociarlo a otras pruebas.
El test de Well 8,9 tiene 2 escalas de probabilidad: una para TVP y otra para TEP, pero tiene el inconveniente de que está influenciada por la capacidad del médico para determinar otras alternativas diagnósticas; mientras que la Geneva requiere de la medición de gases en sangre (PCO2 y PO2), así como de radiografía del tórax. Estas son las de mayor aceptación para predecir la probabilidad de TEP.40
Ver ambas tablas a la derecha.


El diagnóstico actual de TVP tiene una fuerte base en la utilización del test de probabilidad clínica de Well, 27 si bien ninguno de los síntomas o signos de esta enfermedad posibilita confirmarla, por sí solo, de manera aislada. Mundialmente ha sido considerado como eficaz un modelo predictivo donde se conjugan diferentes signos y factores de riesgo, de manera que permite categorizar a los pacientes con alta o baja probabilidad de padecer la afección y cuya validez ha sido reconocida por numerosos autores. Existe también el índice de sensibilidad para embolia pulmonar (PEPSI)41 y la escala PEPSI modificada, considerada de gran utilidad y de mayor simplicidad, las cuales unifican elementos clínicos con la saturación de oxígeno del paciente.
También se definió una escala para el diagnóstico de TEP como primer escalón para pacientes termodinámicamente estables, con el puntaje siguiente:
• Baja probabilidad: 0- 3
• Mediana probabilidad: 4-11
• Alta probabilidad: más de 11
En sentido general, los modelos clínicos de Well 8,9 han permitido la estratificación de pacientes y resultan de utilidad para TVP y TEP:
Permiten plantear la anticoagulación del paciente con la sospecha clínica de alta probabilidad cuando se demora la técnica de imagen, de modo que es posible indicar tratamiento con heparina de manera expedita. Por otro lado, puede retrasarse ante un test de probabilidad baja.11
En sentido opuesto, puede existir demora en la realización de la técnica de imagen cuando el test revela probabilidad baja. De esta forma pasa de un proceder urgente a uno electivo en las próximas 72 horas y permite realizar de forma secuencial múltiples exámenes diagnósticos.11
En el caso de las TVP, un número de pacientes con baja probabilidad presentan diagnóstico para esta entidad clínica en el rango de 3-12%, por tanto, las cifras evidencian que no puede excluirse la realización de estudios imagenológicos.11,42-45
El dímero D como prueba de diagnóstico confirmó el interés en estos test clínicos y teniendo en cuenta el alto valor predictivo negativo en pacientes categorizados como de baja probabilidad, define de forma prioritaria la no anticoagulación y realización de pruebas de imagen, por lo cual se han desarrollado modelos clínicos que incorporan el resultado cualitativo o cuantitativo de esta prueba para la predicción diagnóstica de ETV.46
Esta es una prueba que determina la presencia de fibrina polimerizada o entrecruzada y actualmente se recomienda conocer su nivel de sensibilidad.1,46
• Un dímero D de alta sensibilidad negativo excluye TEP en pacientes con probabilidad clínica baja o intermedia.
• Cuando el dímero D tiene sensibilidad moderada o baja excluye TEP en pacientes con probabilidad clínica baja.
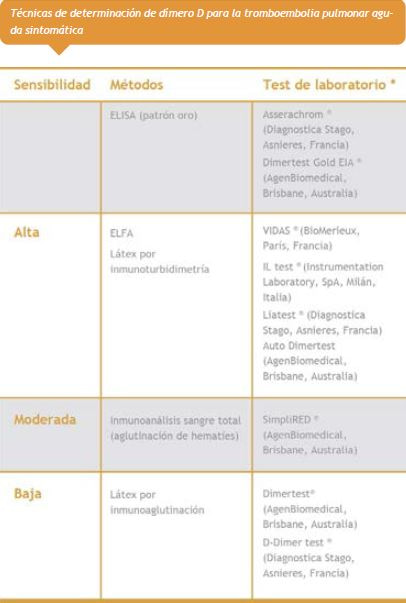
Se recomienda no realizar dímero D en pacientes con alta probabilidad clínica para TEP.1,46
Existen 2 modelos que incorporaron a los elementos clínicos la utilidad del dímero D cualitativo evaluado como positivo o negativo. El modelo de Johanning 48 reveló que el porcentaje de pacientes con TVP de miembros inferiores en el grupo de baja probabilidad fue de 0% y en el de Oudega 49 de 0,7%. El seguimiento prospectivo de pacientes en quienes se negó la presencia de TVP de miembros inferiores, sin realizar exámenes imagenológicos, sino mediante modelos clínicos y dímero D negativo para TVP de miembros inferiores está en el rango de 0-1,4%.
Conclusiones
La ETV constituye un evento que se presenta con una alta morbilidad y mortalidad a escala mundial, tanto en pacientes hospitalizados como ambulatorios, con un diagnóstico difícil en la mayoría de los casos. Por otro lado, en gestantes y puérperas, el diagnóstico se torna más difícil por los cambios propios del embarazo, razón por la cual debe tenerse en cuenta la importancia de los factores de riesgo y de un modelo para una escala de probabilidad clínica, propia para gestantes y puérperas, que permita hacer una estratificación conveniente y una mejor toma de decisiones.
Referencia Bibliográficas
1. Nápoles Méndez D, Couto Núñez D. Enfermedad tromboembólica en el embarazo y puerperio (Parte 1). Enfoque de riesgo y diagnóstico. MEDISAN. 2011 [citado 1 Dic 2014];15(10). Disponible en: http://bvs.sld.cu/revistas/san/vol_15_10_11/san121011.htm
2. Puentes Madera IC, Barnés Domínguez JA. Epidemiología de la enfermedad tromboembólica venosa. Rev Cubana Angiol Cir Vasc. 2013;14(sup):22.
3. Nápoles Méndez D. Controversias en la profilaxis de la enfermedad tromboembólica venosa durante el embarazo. MEDISAN. 2013 [citado 3 Dic 2014];17(6). Disponible en: http://scielo.sld.cu/scielo.php?pid=S1029-30192013000600018&script=sci_arttext
4. Santos Domínguez Y. Profilaxis de la enfermedad tromboembólica venosa. Rev Cubana Angiol Cir Card.2013 [citado 2 Dic 2014];14(sup). Disponible en: http://bvs.sld.cu/revistas/ang/vol14_sup_13/ang0313sup.htm
5. Venous thromboembolism: reducing the risk. Nice Clin Guideline. 2010 [citado 2 Dic 2014]. Disponible en: http://www.nice.org.uk/CG092
6. Nápoles Méndez D, Couto Núñez D. Enfermedad tromboembólica en el embarazo y puerperio (Parte 2). Prevención y tratamiento. MEDISAN. 2011 [citado 1 Dic 2014]; 15(11). Disponible en: http://bvs.sld.cu/revistas/san/vol_15_11_11/san101111.htm
7. Nápoles Méndez D, Couto Núñez. Experiencia de 11 años en enfermedad tromboembólica venosa en el periodo grávido puerperal. Rev Cubana Obstetr Ginecol. 2011 [citado 1 Dic 2014];37(3). Disponible en: http://bvs.sld.cu/revistas/gin/vol37_3_11/gin02311.htm
8. Wells PS, Anderson DR, Bormanis J. Value of assessment of pretest probability of deepvein thrombosis in clinical management. Lancet. 1997;350:1795-8.
9. Wells PS, Ginsberg JS, Anderson DR. Use of a clinical model for safe management of patients with suspected pulmonary embolism. Ann Intern Med. 1998;129:997-1005.
10. Lovesio C. Tromboembolismo pulmonar. En: Terapia intensiva. Buenos Aires: El Ateneo; 2006.
11. Rosa Jiménez FP. Modelo clínico para descartar trombosis venosa profunda de miembros inferiores sin estudio de imagen. Repositorio de tesis. Universidad de Granada. Tesis doctoral. 2010 [citado 1 Dic 2014]. Disponible en:
12.Hansson PO, Eriksson H, Welin L, Svardsudd K, Wilhelmsen L. Smoking and abdominal obesity: risk factors for venous thromboembolism among middle-aged men: “the study of men born in 1913”. Arch Intern Med. 1999;159(16):1886-90.
13. Roshani S, Lijfering WM, Coppens M, Hamulyák K, Prins MH, Büller HR, Middeldorp S. Risk factors and arterial and venous thrombosis. Neth J Med. 2011;69(1):27-30.
14. Sánchez Sánchez V, Velázquez Martín MT, Tello de Meneses R, Escribano Subías P, Lázaro Salvador M, Delgado Jiménez JF, et al. Riesgo de embolismo pulmonar. Cardiovascular Risk Factors. 2001;10(6):342–6.
15.Horton A, Momirova V, Townson D, Wenstrom K, Wendel G, Samuels P, et al. Family history of venous thromboemboly and identifiying Factor V Leiden carrions during pregnancy. Obstet Gynecol. 2010;115(3):521-5.
16.Nápoles Méndez D. Categoría gestacional del síndrome antifosfolipídico. MEDISAN. 2013 [citado 1 Dic 2014];17(3).
Disponible en: http://bvs.sld.cu/revistas/san/vol_17_2_13/san14213.htm
17. Pérez Leonard D. Diagnóstico clínico de la trombosis venosa profunda. Rev Cubana Angiol Cir Vasc. 2013 [citado 1 Dic 2014];14(sup). Disponible en: http://bvs.sld.cu/revistas/ang/vol14_sup_13/ang0413sup.htm
18.Nápoles Méndez D, Nápoles García D. Hemostasia normal y la coagulación intravascular diseminada en obstetricia. MEDISAN. 2012 [citado 1 Dic 2014];16(3).
Disponible en: http:// scielo.sld.cu/scielo.php?pid=S1029-30192012000300013&script= sci_arttext
19. James AH. Venous thromboembolism in pregnacy. Arterioscler Thromb Vasc Biol. 2009 [citado 3 Dic 2014];29:326-31. Disponible en:
http://www.ncbi.nlm.nih.gov/pubmed/19228606
20. The American College of Obstetricians and Gynecologists. Thromboembolism in pregnancy. Pract Bull. 2011;118(3):718-29.
21. Leung AN, Bull TM, Jaeschke R, Lockwood CJ, Boiselle PM, Hurwitz LM. American Thoracic Society documents: an official American Thoracic Society/Society of Thoracic Radiology Clinical Practice Guideline. Evaluation of Suspected Pulmonary Embolism in Pregnancy. Radiology. 2012;262(2):635-46.
22. Gader A, Elrahium A, Adam I. Epidemiology of deep venous thrombosis during pregnancy and puerperium in sudanese women. Vasc Health Risk Manag. 2009;5:85-7.
23. Cuenca C, Gómez C, García M, Carbona I, González E, Herrera JA. Enfermedad tromboembólica y gestación. Diagnóstico y manejo clínico. Revisión de conjunto. Toko Gin Pract. 2009;68(1):6-12.
24.Malek G, Drygaliska A, Kober J, Wawrzyuska L, Debsky R, Dabrowski M. Chest ultrasound in the diagnosis of pulmonary embolism in a pregnant/a case report. Pneumonol Alergol Pol. 2009;77:560-4.
25. Rodger M. Evidence base for the management of venous thromboembolism in pregnancy. Hematology Am Soc Hematol Educ Program. 2010;2010(1):173-80.
26. Reitter S, Laezkovies C, Waldhoer T, Mayerhofer M, Vutric Ch, Pabinger I. Long-term survival after venous thromboembolism: a retrospective selected cohort study among young woman. Haematologica. 2010;9(8):1425-8.
27. Abarca Brenes MR. Trombosis venosa profunda durante el embarazo. Revista de Costa Rica y Centroamérica. 2010;67(592):199-206.
28.Guyatt GH, Akl EA, CrowtherM,Gutterman DD, Schünemann HJ. Antithrombotic therapy and prevention of thrombosis. 9 th. Chest. 2012;141(Suppl 2):747.
29. Barreras González I, Pila Pérez R, Pila Peláez R, Guerra Rodríguez C, Paulino Basalto M. Incidencia del tromboembolismo pulmonar en el hospital “Manuel Ascunce Doménech”. Archivo Médico de Camagüey. 2002 [citado 1 Dic 2014];6(Supl 3). Disponible en: http://www.amc.sld.cu/amc/2002/v6supl3/549.htm
30. Girard P, Olivier Sánchez P, Leroyer C, Musset D, Meyer G, Stern JB, et al. Deep venous thrombosis in patients with acute pulmonary embolism. Prevalence, risk factors, and clinical significance. Chest. 2005;128:1593–600.
31.Holbrook A1, Schulman S, Witt DM, Vandvik PO, Fish J, Kovacs MJ et al. Evidence-based management of anticoagulant therapy: antithrombotic therapy and prevention of thrombosis. Chest. 2012;141(Suppl 2):152S-84S.
32. Vine HS, Hillman B, Hessel ST. Deep venous thrombosis: predictive value of signs and aymptoms. Am J Roentgenol. 1981;136:167-71.
33. Landefeld CS, McGuire E, Choen AM. Clinical findings associated with acute proximal deep thrombosis: a bais ford quantiying clinical judgement. Am J Med. 1990;88:382-8.
34.Nypaver TJ, Shepard AD, Kiell CS, McPharlin, Fenn N, Ernest CB. Outpatient dúplex scaning ford deep vein thrombosis: parameters predictive of a negative study result. J Vasc Sur. 1993;18:821-6.
35. Ruiz Giménez N, Friera A, Sánchez Mulini P, Caballero P, Rodríguez Salváres F, Suárez C. Trombosis venosa profunda en miembros inferiores en un servicio de urgencias. Utilidad de un modelo clínico estratificado de riesgo. Med Clin. 2002;118:529-33.
36. Janes S, Ashford N. Use of a simplifiel clinical scoring system and D – dimer testing can reduce the requirement ford radiology in the exclusion of deep vein thrombosis by over 20%. Br Haematol. 2001;112:1079-82.
37. Lennux AF, Delis KT, Serunkuman S, Karka ZA, Doscaulopoulou SE, Nicolaides AN, Combination of a clinical risk assessment score and rapid whole blood D-dimer testing in the diagnosis of deep vein thrombosis in symptomatic patients. J Vasc Sur.1999;30:794- 804.
38.Constans J, BoulinetC,salmi R, Saby JC, Baudouin P et al. Comparison of for clinical prediction scores for the diagnosis of lower limb deep venous thrombosis in outpatients. Am J Med. 2003;115:436-40.
39.Khan SR, Joseph L, Abenhaim, Leclerc JR. Clinical prediction of deep vein thrombosis in patients with leg symptoms. Thromb Haemost.1999;81:353-57.
40.Martínez Pérez R, González Vega F. Embolismo pulmonar. Rev Ciencias Médicas de La Habana. 2008;14(1):16.
41. Uresandi F, Monreal M, García Bragado F, Domenech P, Leamumberri R, EscobanoP. Y Cols. Consenso nacional sobre el diagnóstico y tratamiento de los pacientes con tromboembolismo pulmonar. Arch Bronconeumol. 2013;49:334-47.
42. Iles S, Hodges AM, Darley JR, Frampton C, Epton M, Beckert L ,etal. Clinical experience and pre-test probability scores in the diagnosis of pulmonary embolism. Q J Med. 2003; 96:211–5.
43. Jiménez D, Aujesky D, Yusen RD. Risk stratification of normotensive patients with acute pulmonary embolism. Br J Haematol. 2010; 151:415-24.
44. Becattini C, Agnelli G, Vedovati MC, Pruszczyk P, Casazza F, Grifoni S et-al. Multidetector computed tomography for acute pulmonary embolism: Diagnosis and risk stratification in a single test. Eur Heart J. 2011; 32:1657-63.
45.Ameneiro Pérez S. Diagnóstico no invasivo de la trombosis venos profunda. Rev Cubana Angiol Cir Vasc. 2013;14(sup):34-6.
46. Bates S, Kearon C, Crowther M. Dímero D cuantitativo para descartar trombosis venosa profunda. Ann Intern Med. 2003;138:787-94.
47.Carrier M, Righini M, Djurabi RK, Huisman MV, Perrier A, Wells PS, et al. VIDAS D-dimer in combination with clinical pretest probability to rule out pulmonary embolism. A systematic review of management outcome studies. Thromb Haemost. 2009;101:886-92.
48.Oudega R, Moons KG, Hoes AW. Ruling out deep venous thrombosis. deep vein thrombosis in primary care. A simple diagnostic algorithm incluiding D-dimer testing. Thromb Haemost. 2005;94:200-5.
49. Johanning JM, Frankling DP, Thomas DD, Elmore JR. D-dimer and calf circumference in the evaluation of outpatient deep venous thrombosis. J Vas Sur. 2002;36:877-80.










