
Técnica de crossmatch por citometría de flujo utilizando human Fc block como agente bloqueante
ARTICULO ORIGINAL
Nombre completo de los autores: Nicolás Martín JUAREZ; Mariano Ezequiel VERA; Sandra María ROMANO; Paula SOSA VENTURI; Cesia SALAFIA; María Julieta THOME.
Unidades o instituciones donde se desempeñan: Laboratorio de Histocompatibilidad dependiente del Instituto Coordinador de Ablaciones e Implantes de Mendoza (InCAIMen)
Salta y Alem– Mendoza – Argentina
CP: 5500
E-mail: labhlamza@gmail.com
Los autores deberán consignar si existe o no conflicto de intereses: No existe conflicto de intereses.
Resumen
El ensayo de crossmatch por citometría de flujo (XMCF) proporciona un medio altamente sensible para detectar la presencia de anticuerpos contra el donante de órganos sólidos.
El principal inconveniente que se presenta en la técnica de XMCF es la unión de las inmunoglobulinas de manera inespecífica a los receptores Fc en la superficie de los linfocitos B. Para evitar esto se realiza un tratamiento con pronasa.
El tratamiento con pronasa puede afectar a otras moléculas de la superficie celular, alterando la expresión de los epítopes anómalos e influyendo en la especificidad del ensayo.
En el presente trabajo se plantea el uso de Fragmentos Fc recombinantes para bloquear los receptores Fc, inhibiendo la unión inespecífica de anticuerpos humanos.
Se utilizó la técnica de XMCF protocolo Halifax.
Se estudió una población de 20 pacientes.
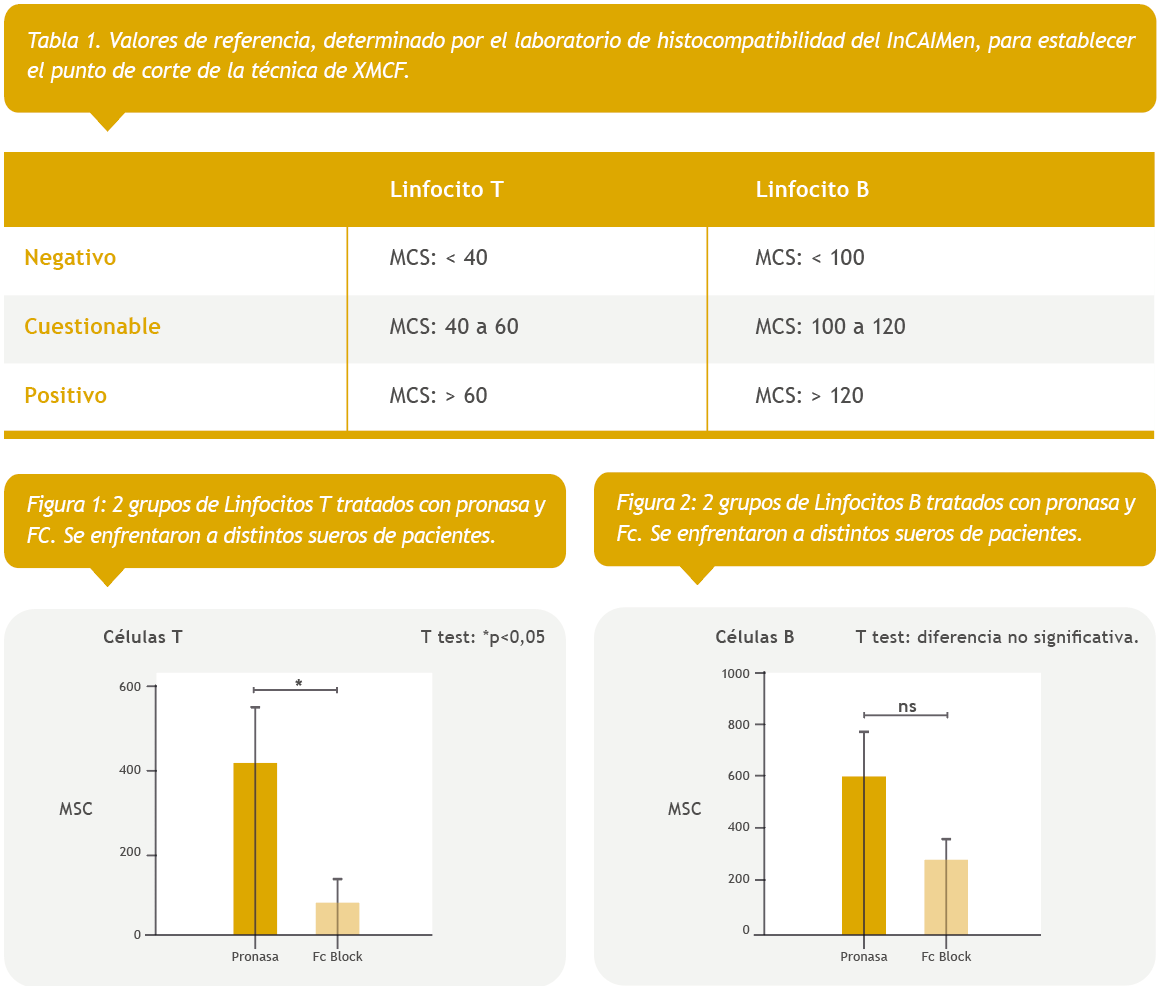
Hemos observado que hay una diferencia respecto de los linfocitos T (*p < 0,05). La diferencia es no significativa en los linfocitos B, pero si es notable la diferencia en los linfocitos T (*p < 0,05) ya que los valores obtenidos en el tratamiento con pronasa, en todos los casos, son muy superiores a los obtenidos por el uso de Fc Block. Esto podría sugerir que el tratamiento con pronasa es propenso a dar reacciones falsas positivas en las pruebas de XMCF con linfocitos T.
También podemos plantear el tratamiento con Fc Block como una buena alternativa para evitar el daño celular ocasionado con la pronasa en la técnica de XMCF.
Palabras claves: Crossmatch, citometría de Flujo, Fc Block, Pronasa
Introducción
El ensayo de crossmatch por citometría de flujo (XMCF) es utilizado por todos los laboratorios de Argentina que realizan pruebas de histocompatibilidad de órganos sólidos y proporciona un medio altamente sensible para detectar anticuerpos reactivos contra el donante al evaluar candidatos para trasplante.[1]
Los ensayos de crossmatch proporcionan una evaluación directa de la reactividad de los anticuerpos de un paciente con células de un posible donante. Estas pruebas requieren células de donantes viables para su correcta evaluación. Un ensayo de crossmatch positivo, con linfocitos del donante, sugieren la presencia de anticuerpos donantes específicos (DSA) en el suero del receptor. [1-2]
La presencia de anticuerpos específicos contra el donante es un importante factor de riesgo para complicaciones clínicas después del trasplante. Dependiendo del nivel de los anticuerpos específicos contra el donante, el impacto clínico puede variar desde eventos menores, controlados con inmunosupresión estándar, hasta complicaciones graves como el rechazo hiperagudo del injerto que conducen a perderlo. [2]
Los pacientes trasplantados con pruebas de crossmatch que son negativas por citotoxicidad dependiente del complemento, pero XMCF positivo tienen una mayor incidencia de rechazo agudo de injertos y un mayor riesgo de pérdida temprana del injerto. [1]
El principal inconveniente que se presenta en la técnica de XMCF es la unión de las inmunoglobulinas de manera inespecífica a los receptores Fc en la superficie de los linfocitos B. Para salvar esta inespecificidad y aumentar tanto la sensibilidad como la especificidad de la técnica, es que a los linfocitos se les realiza un tratamiento con la enzima pronasa, es una mezcla de proteasas aisladas del líquido extracelular de Streptomyces griseus. La actividad se extiende tanto a las proteínas desnaturalizadas como a las nativas, lo que conduce a una digestión completa o casi completa en aminoácidos individuales. En estrictas condiciones de incubación, elimina los receptores Fc de la superficie celular. Actualmente se considera la técnica “gold standard” en Argentina.
El tratamiento con pronasa puede afectar a otras moléculas de la superficie celular, alterando la expresión de epítopes anómalos, afectando la reactividad de la prueba de crossmatch.
Los Receptores Fc, CD20, y HLA son todos miembros de la superfamilia de inmunoglobulinas con homología estructural compartida, por lo tanto, es razonable esperar que la pronasa pueda afectar la expresión y/o antigenicidad de los HLAs.[3]
Basados en los artículos de Hajeer A.H. et al [4] y Brown N. K. et al [5], en el trabajo se planteó el uso de Fragmentos Fc recombinantes para bloquear los receptores Fc, evitando así dañar los HLAs e inhibiendo la unión inespecífica de anticuerpos humanos. Además, Szewczyk K. et al. [6] indican que los pacientes infectados por el VIH tienen autoanticuerpos no perjudiciales para el rechazo de órganos que reconocen los epítopos crípticos expuestos por la pronasa en las células T.
El objetivo de este estudio es plantear una alternativa a la técnica de XMCF con el uso de Human Fc Block como agente bloqueante de los receptores Fc de los linfocitos B en la prueba de XMCF, debido al problema que puede ocasionar el uso de pronasa en los linfocitos T en la expresión de epítopos crípticos.
Materiales y métodos
- Sujetos de estudios
Se estudiaron 20 pacientes que poseen los siguientes criterios de inclusión y exclusión:
Criterios de Inclusión de Pacientes:
- Población de pacientes con insuficiencia renal crónica.
- Candidatos a trasplante renal.
- De ambos sexos.
- Edad: 18 a 70 años.
Criterio de Exclusión de Pacientes:
- Pacientes no incluidos en la lista de espera a trasplante renal. (ley 24.193 y 26.066)
- Pacientes sin antecedentes de estudio por panel reactive antibodies (PRA).
- Pacientes con tratamientos de desensibilización con rituximab.
Se solicito a los pacientes consentimientos informados para poder utilizar sus muestras. Todas las muestras son anónimas y solo fueron clasificadas en:
Pacientes con PRA > 70 (9 pacientes)
Pacientes con PRA = 0 (11 pacientes)
El donante de células para el estudio de los sueros fue de un paciente: hombre, sin antecedentes de transfusiones ni de trasplantes previos.
- Método
Se utilizo la técnica de XMCF protocolo Halifax.[7]
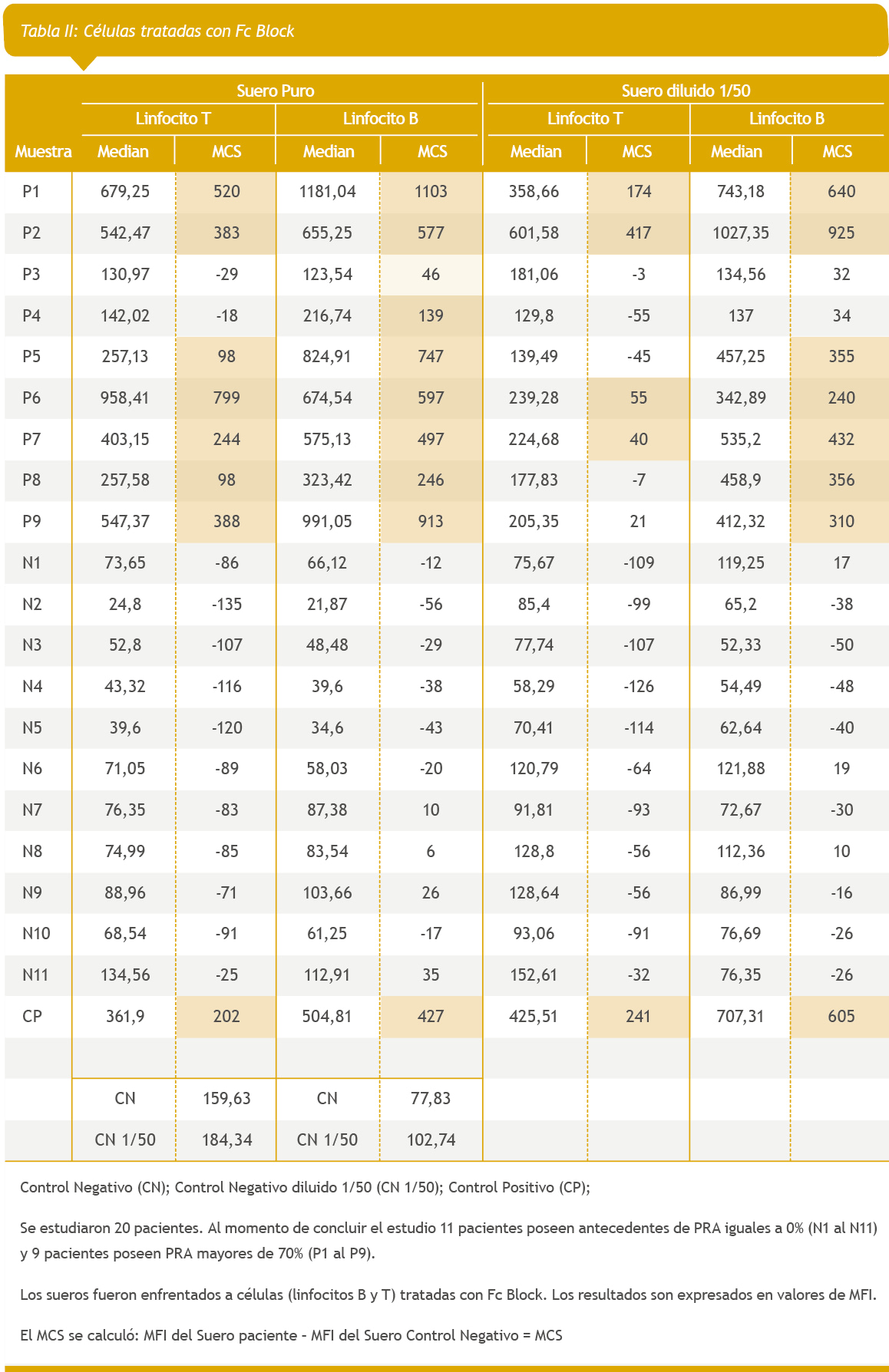
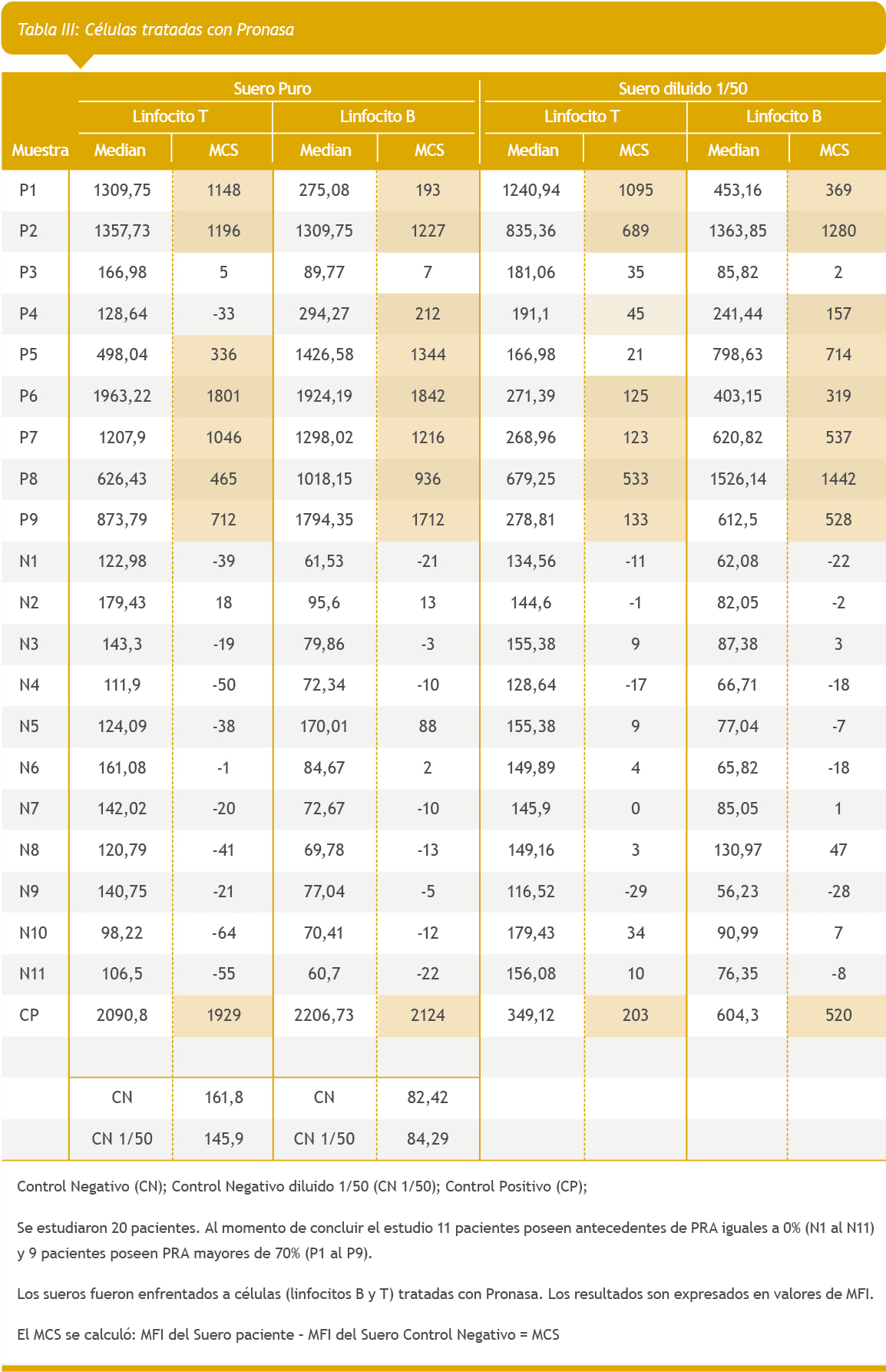
Se analizaron en paralelo las mismas muestras tratadas con Pronasa y con Human BD Fc Block.
Se estudiaron los linfocitos T y B del donante de células. Estas se enfrentaron contra el suero de los pacientes del estudio (suero puro y diluido 1/50)
- Materiales
El Citómetro de flujo utilizado es: Becton Dickinson FACScalibur Flow Cytometer – 3 Colores.
Los reactivos utilizados:
- Buffer salino fosfato (PBS)
- BD FACSFlow™ Sheath Fluid
- Ficoll-Hypaque
- Human BD Fc Block.
- Marca: Becton Dickinson
- Clone: Fc1
- Catalogo: 564219
- Pronasa: Proteasa, Streptomyces griseus
- Marca: Sigma-Aldrich
- Suero Control Negativo (hombre, sin antecedentes de transfusiones ni de trasplantes previos).
- Suero Control Positivo (Pool de sueros de Pacientes con antecedentes de PRA >90%).
- Anti-humano IgG conjugado con Isotiocianato de fluoresceína (FITC)
- Marca: Becton Dickinson
- Clone: G18-145
- Catalogo: 555786
- Anti-CD3 conjugado con Phycoerythrin-Cyanin 5 (PC5)
- Marca: Beckman Coulter
- Clone: UCHT1
- Catalogo: IM2635U
- Anti-CD19 conjugado con Peridinin Chlorophyll Protein (PerCP).
- Marca: Becton Dickinson
- Clone: 4G7
- Catalogo: 347544
- Reactivos de bloqueo del receptor Fc
Se usó el siguiente reactivo para bloquear los receptores Fc:
Human BD Fc Block (1 mg/ml; BD Biosciences), una proteína recombinante derivada de inmunoglobulina. Se añadieron 5 μl de agente bloqueante a las suspensiones celulares (2,5 × 105/tubo) y se incubaron durante 10 min a temperatura ambiente en un agitador de placas. Luego las células fueron lavadas con PBS para eliminar el excedente de Fc Block.
- Análisis estadístico.
Se estableció el valor de diferencia media de canales (median channel shift, MCS), a partir de la diferencia entre la intensidad de fluorescencia media (median fluorescence intensity, MFI) del suero control negativo respecto del suero del paciente. Los datos fueron posteriormente analizados en el software GraphPad Prism 9, mediante la prueba de T test de una o dos colas con un nivel de confianza del 95% y una significancia de p<0,05.
En la estadística se analizaron los linfocitos T y B por separado.
- Valores de referencia. (Tabla I)
Resultados
Del total de pacientes estudiados (n=20) al momento de concluir el estudio
- el 55% (11 pacientes) poseen antecedentes de PRA iguales a 0%,
- el 45% (9 pacientes) poseen PRA mayores de 70%.
Los resultados son expresados en valores de MFI.
Se calculó el MCS de la siguiente manera:
- MFI del Suero paciente – MFI del Suero Control Negativo = MCS
De los 2 valores obtenidos por paciente se tomó en consideración el valor más alto entre los 2 estudios realizados (suero puro y diluido 1/50). (Tabla II y III)
El análisis estadístico dio como resultado:
- Linfocitos T: Diferencia significativa entre las técnicas de Pronasa y Fc Block (*p < 0,05) (Figura I)
- Linfocitos B: Diferencia no significativa entre las técnicas de Pronasa y Fc Block (Figura II)
Discusión
En el estudio realizado por Park H. et al [3] se menciona el riesgo de tratar con pronasa a los linfocitos T y B en un mismo tubo, ya que la pronasa no solo afecta a las células B, para eliminar los receptores Fc, sino que también reciben un tratamiento proteolítico las células T, las cuales sufren daño exponiendo antígenos que pueden ser reconocidos por anticuerpos no HLA o HLA no donante especifico. El estudio de Szewczyk K. et al [6] refuerza la hipótesis del daño que causa el uso de pronasa sobre las células T, pudiendo exponer antígenos crípticos, los cuales pueden afectar el resultado del XMCF.
Dado lo planteado anteriormente y por los resultados obtenidos en el estudio, en donde no se observan diferencias significativas en los linfocitos B pero, por el contrario, es considerable la diferencia de MCS en los linfocitos T (tratados con Fc block y pronasa) ya que los valores de MFI obtenidos en el tratamiento con pronasa, son superiores a los obtenidos por el uso de Human Fc Block.
Algunos autores han estudiado los efectos del tratamiento con pronasa en la expresión de HLA o los resultados de XMCF. Hetrick SJ et al [8] investigaron el impacto de 2 concentraciones (1 mg/mL y 2 mg/mL) de pronasa en los resultados de XMCF. El tratamiento con 1 mg/mL de pronasa aumentó significativamente la reactividad en el 87 % de las pruebas de células T, lo que sugiere que el tratamiento con pronasa puede generar resultados erróneos de XMCF.
En otro estudio realizado por Brown N. K. et al [5] se sugiere que el uso de pronasa, no solo es un tratamiento agresivo para las células, sino que el receptor Fc no es el primer objetivo de los anticuerpos, ya que por el contrario se requiere de un tiempo prolongado para que estos se unan a los mismos. Este problema fue resuelto debido a la aplicación de la técnica de Halifax [7], la cual reduce el tiempo de incubación a 20 minutos (la técnica tradicional de XMCF lleva una incubación de 30 minutos entre las células y el suero). Esto reduciría el riesgo de falsos positivos por parte de los linfocitos B.
Conclusión.
Podemos concluir, a partir de los resultados de nuestro estudio y teniendo en cuenta el sustento bibliográfico, que el tratamiento con pronasa puede inducir reacciones falsas positivas en las pruebas de XMCF con linfocitos T, debido al daño producido por la reacción enzimática que expone epítopes crípticos ocasionando reacciones inespecíficas, dando como resultado un falso positivo en la técnica.
Sería recomendable tener en cuenta realizar la técnica procesando células T y B por separado para evitar posibles reacciones cruzadas inespecíficas que podrían ocasionar resultados falsos positivos.
También podemos plantear al tratamiento con Fc Block como una buena alternativa para evitar el daño celular ocasionado con la pronasa, en la técnica de XMCF; pero debido al bajo número de muestra realizadas en este estudio es muy pronto para establecer una validación de la técnica.
Referencias Bibliográficas
- Montgomery R.?A., Tatapudi V.?S., Leffell M.?S., Zachary A.?A. HLA in transplantation. Nature Reviews Nephrology. 14, 558–570, 2018.
- Arrunátegui AM, Ramon DS, Viola LM, Olsen LG, Jaramillo A. Aspectos técnicos y clínicos de la prueba cruzada de histocompatibilidad en el trasplante de órganos sólidos. Biomédica. 42:391-413. 2022.
- Park H., Lim Y.M., Han B.Y., Hyun J., Song E.Y., Park M.H. Frequent false-positive reactions in pronase-treated T-cell flow cytometric cross-match tests. Transplantation Proceedings; 44, 87–90. 2012.
- Hajeer A.H., Saleh S., Sutton P., Shubaili A., Anazi H. Pronase-free B-cell Flow-cytometry Crossmatch. Saudi Journal of Kidney Diseases and Transplantation. 20(4):662-665. 2009.
- Brown N. K., Meade J. R., Wang J., Marino S. R. Reanalysis of the role of pronase treatment of B cells in the ?ow cytometric crossmatch assay: Fc receptor is not the primary target. Human Immunology. 2017.
- Szewczyk K. et al. Flow cytometry crossmatch reactivity with pronase-treated T cells induced by non-HLA autoantibodies in human immunodeficiency virus-infected patients. Human Immunology. 77(6): 449-55. 2016.
- Liwskia R. S., Greenshieldsa A. L., Conrad D. M. et al. Rapid optimized ?ow cytometric crossmatch (FCXM) assays: The Halifax and Halifaster protocols. Human Immunology. 2017
- Hetrick S. J., Schillinger K. P., Zachary A. A., Jackson A. M. Impact of pronase on ?ow cytometric crossmatch outcome. Human Immunology. 72, 330–336. 2011.
- Agradecimientos
- Personal del Laboratorio de Histocompatibilidad del InCAIMen.
- Laboratorio especializado de inmunología del Hospital de Niños de la Santísima Trinidad.
- Facultad de Ciencias Químicas de la Universidad Nacional de Córdoba.
- Laboratorio del Programa Provincial de Prevención y Asistencia al enfermo con el virus del VIH-Sida (PAPSI).
- Servicio de Nefrología y Programa del Trasplante Renal del Hospital Central.











