Prevalencia y Causas de Pseudotrombocitopenia en un Hospital de Mendoza
Artículo Original Bioq. María José Crimi, Dr. Pablo Iribarne Hospital Luis C. Lagomaggiore. Timoteo Gordillo s/n, Capital, Mendoza. Argentina majo_crimi@hotmail.com
Resumen
Objetivos: Determinar la prevalencia de pseudotrombocitopenia, las causas que la producen y su relación con las variables de la población.
Metodología: Realizamos un estudio de cohorte prospectivo que incluyó 7403 muestras a las que se les realizó recuento de plaquetas por el Método Automatizado y por el Método Manual visualizando el frotis de sangre. Un protocolo diagnóstico que diseñamos permitió determinar la causa.
Resultados: 46 muestras (0,621%) presentaron pseudotrombocitopenia. Las causas fueron presencia de macroplaquetas 27 (59%), causas preanalíticas 15 (33%) y fenómenos inducidos por los Anticoagulantes 4 (9%). El recuento medio de pseudotrombocitopenia fue de 102 x109/L. La población estaba compuesta por 24 (52%) adultos del sexo femenino, 15 (33%) del sexo masculino y 7 (15%) recién nacidos. 28 (61%) de los pacientes se encontraban internados. Se identificaron 22 diagnósticos diferentes. 38 (83%) muestras se recolectaron en tubos comerciales de 3 mL, y 8 (17%) en tubos de 0,5 mL. 31 (68%) tuvieron pseudotrombocitopenia de grado discreto, 6 (13%) moderado y 9 (19%) marcado.
Se encontró influencia entre la causa de pseudotrombocitopenia y los 3 grupos de pacientes, también con el volumen del tubo y el grado pseudotrombocitopenia.
No hubo relación entre la causa de pseudotrombocitopenia y la condición de internación, ni con los diagnósticos.
Conclusiones: La observación microscópica del frotis de sangre es fundamental para determinar la pseudotrombocitopenia y sus causas. Informar al médico y al paciente un valor real de plaquetas puede evitar diagnósticos incorrectos y procedimientos terapéuticos innecesarios.
Palabras claves: prevalencia, pseudotrombocitopenia, agregación plaquetaria, satelitismo plaquetario, EDTA, macroplaquetas, frotis de sangre, muestra coagulada.
Abstract
Objetives: To determine the prevalence of pseudotrombocitopenia, the causes that produce it and its relation with the variables of the population.
Methodology: We conducted a prospective cohort study that included 7403 samples that were counted for platelet count by the Automated Method and by the Manual Method visualizing the blood smear. A diagnostic protocol that we designed allowed us to determine the cause.
Results: 46 samples (0.621%) presented pseudotrombocitopenia. The causes were presence of macroplates (59%), preanalytic causes (33%) and phenomena induced by anticoagulants (9%). The mean pseudothrombocytopenia count was 102 x 109/ L. The population was composed of 24 (52%) female adults, 15 (33%) male and 7 (15%) newborns. 28 (61%) of the patients were hospitalized. We identified 22 different diagnoses. 38 (83%) samples were collected in 3 mL commercial tubes, and 8 (17%) in 0.5 mL tubes. 31 (68%) had pseudotrombocitopenia of discrete degree, 6 (13%) moderate and 9 (19%) marked. Influence was found between the cause of pseudotrombocitopenia and the 3 groups of patients, also with the volume of the tube and the degree pseudotrombocitopenia. There was no relation between the cause of pseudotrombocitopenia and the condition of hospitalization, nor with the diagnoses.
Conclusions: The microscopic observation of the blood smear is fundamental to determine pseudotrombocitopenia and its causes. To inform the doctor and the patient of an actual value of platelets can avoid incorrect diagnoses and unnecessary therapeutic procedures.
Key words: prevalence, pseudotrombocitopenia, platelet aggregation, platelet satelitism, EDTA, macroplates, blood smear, coagulated sample.
Introducción
La pseudotrombocitopenia (PTCP) es una alteración in vitro que se define como un recuento falso de plaquetas (PLT) por debajo de 150 X 109/L. Se observa cuando el hemograma es realizado por contadores hematológicos, sin corroboración mediante visualización microscópica del frotis de sangre. No representa ningún problema para el paciente. Su importancia radica en la certeza del diagnóstico temprano y oportuno, ya que, de no ser abordadas correctamente pueden llevar a diagnósticos incorrectos(1)(2)(3).
Los recuentos automatizados no siempre representan las cifras de PLT reales, ya que no puede reconocer las PTCP, por lo que el recuento y observación de la morfología plaquetaria al microscopio óptico es un complemento imprescindible para el estudio de las plaquetopenias(4).
Las PTCP pueden producirse por causas preanalíticas como la toma inadecuada de la muestra, el desarrollo de coágulos, dilución u homogeneización inadecuada. También, se presentan por fenómenos inducidos por anticoagulante (3)(5)(6). La presencia de macroplaquetas (MACROPLT) también se manifiesta en las PTCP. (1)(4)(7)
Los mecanismos por los cuales se presenta PTCP inducida por anticoagulantes como el ácido etilen-diamino-tetra-acético (EDTA), el citrato, el ácido-citrato-dextrosa (ACD), el oxalato y la heparina, son el satelitismo(8) y la agregación plaquetaria(9).
El satelitismo plaquetario es la adherencia de plaquetas a la periferia de los neutrófilos que se caracteriza por la formación de “rosetas” observadas en el frotis de sangre periférica. En la mayoría de los casos, reduce significativamente el recuento real de PLT.
La formación de agregados plaquetarios se explica por el efecto anticoagulante ejercido por el EDTA, el cual quela el calcio. En ausencia de calcio, la glicoproteína IIb/IIIa, receptor plaquetario del fibrinógeno, cambia su estructura, con expresión de nuevos antígenos de superficie sobre los que actúan anticuerpos antiplaquetarios de las clases IgG (más frecuentes), IgM e IgA produciendo la agregación plaquetaria. La formación de agregados es dependiente del tiempo y se produce más fácilmente por debajo de los 37°C. Este fenómeno, además de reducir el recuento de PLT en el autoanalizador, origina pseudoleucocitosis, que es un falso incremento en el recuento automatizado de leucocitos, que se manifiesta al contar los agregados plaquetarios, como leucocitos(2).
Las MACROPLT, tienen un volumen plaquetario medio (VPM) mayor a 12,3 fL, similar al de un microcito y por lo tanto son contadas, por el autoanalizador, como glóbulos rojos (GR) produciendo la disminución en el recuento automatizado de PLT.(10)(11)
Frente al hallazgo de un recuento automatizado de PLT menor a 150 x109/L, la primera acción, a cargo del laboratorio clínico, debe ser descartar la posibilidad de una PTCP, a través de protocolos diagnósticos, para suministrar al médico datos certeros sobre el estado del paciente(7).
Objetivo
Este estudio tiene como objetivo determinar la prevalencia de pseudotrombocitopenia en nuestro medio, conocer las principales causas y su relación con las variables de la población estudiada.
Metodología
Entre el 22 de agosto y 29 de diciembre de 2016 realizamos un estudio de cohorte prospectivo en el servicio de Bioquímica Clínica, sección Hemograma del Hospital Luis C. Lagomaggiore, que incluyó 7403 muestras para hemograma. Las mismas se recolectaron en tubos comerciales anticoagulados con EDTAK2, de 4 o 0,5 mL según las características del paciente. A las muestras se les realizó recuento de plaquetas mediante 2 métodos. El primero fue el Automatizado(7), a través del contador hematológico Sysmex XT 2000i de Roche que utiliza como método de detección la impedancia con tecnología de enfoque hidrodinámico. Este autoanalizador participa en el Programa Insight de Evaluación de la Calidad Interamericano de Laboratorio.
El otro método utilizado fue el Manual(7) que consiste en contar, en el frotis realizado de la gota fresca de sangre y coloreado con May Grunwald Giemsa, al microscopio óptico con aumento de 100X, las plaquetas en 5 campos de 200 glóbulos rojos cada uno, expresado en valor absoluto con respecto al recuento total de GR. El recuento de GR es proporcionado por el autoanalizador.
Se clasificaron como positivas para PTCP a todas las muestras con recuento Automatizado de PLT menores a 150 x109/L que fueron corregidas a valores iguales o por encima de 150 x109/L, por el Método Manual.
Para determinar las causas de las muestras positivas para PTCP se diseñó un protocolo diagnóstico. (Figura 1)
Figura 1: Algoritmo para determinar las causas de PTCP.
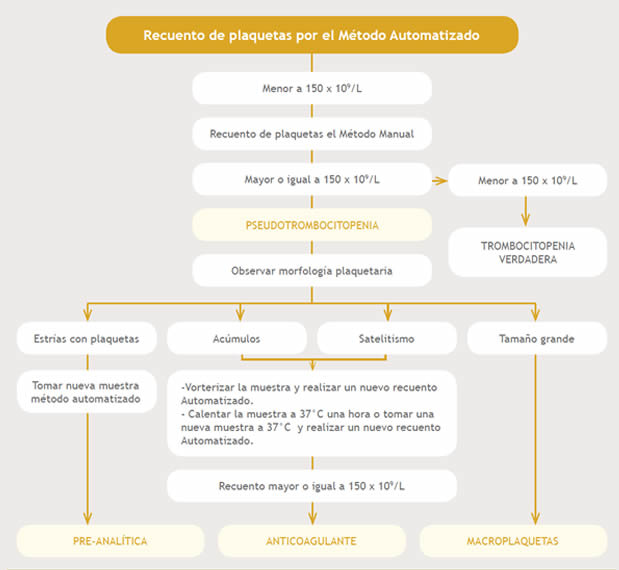
Cuando el recuento de plaquetas por el Método Manual sigue siendo menor a 150 x 109/L, estamos en presencia de una Trombocitopenia verdadera. Si es corregido a valor mayor o igual de 150. 109/L, se observa la morfología plaquetaria para determinar la causa de PTCP. Al hallar Acúmulos y/o Satelitismo, se vorteriza la muestra, se calienta 37° durante una hora o se realiza una nueva toma de muestra con un anticoagulante diferente y se realiza nuevo recuento automatizado. Si es mayor o igual a 150 x 109/L la causa es PTCP inducida por ANTICOAGULANTE. Al observar PLT de tamaño semejante a un microcito con recuento mayor o igual a 150 x 109/L la causa es la presencia de MACROPLAQUETAS. El hallazgo de estrías de PLT, sobre todo en la cola del frotis, obliga la nueva toma de muestra y recuento Automatizado que al encontrarse mayor o igual a 150 x 109/L se dice que la causa es PREANALÍTICA.
Para el seguimiento de las muestras se creó una planilla que aseguraba todos los datos necesarios.
Posteriormente se calculó la prevalencia y las principales causa, analizando los datos con el software InfoStat/L. Para evaluar la significancia estadística usamos la prueba de chi2 para variables categóricas. Un valor de p menor a 0,05 se consideró estadísticamente significativo.
El estudio se realizó bajo la autorización del Comité de Ética en Investigación del Hospital Luis C. Lagomaggiore.
Resultados
De las 7403 muestras incluidas en el periodo de estudio, 46 (0,621%) presentaron PTCP. Siendo la principal causa la presencia de MACROPLT 27 (59%), seguida de causas preanalíticas 15 (32%), en tercer lugar se ubicaron los fenómenos inducidos por los anticoagulantes 4 (9%) (Gráfico1)
Gráfico 1. Porcentaje de pacientes y las distintas causas de PTCP
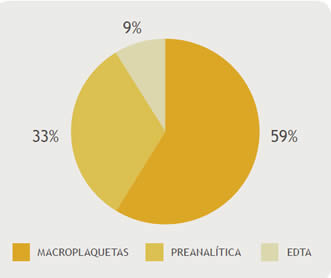
Tabla 1: Distribución de PTCP y sus causas según las distintas variables estudiadas.
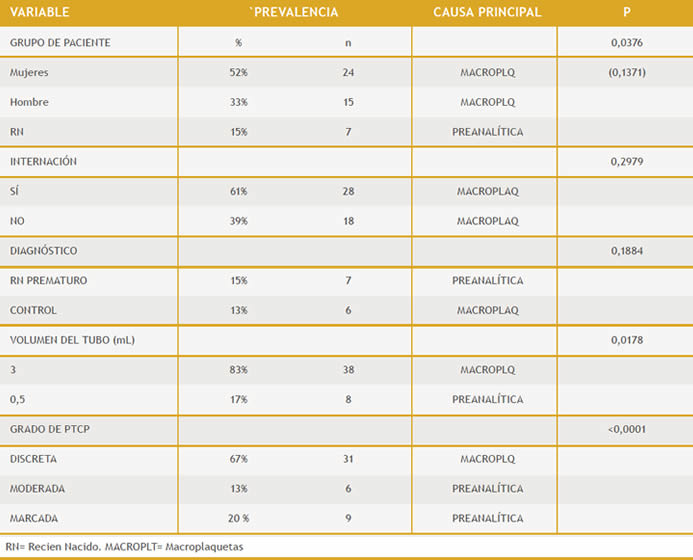
El recuento medio de PTCP fue de 102 x109/L con un valor mínimo de 8 y un máximo de 147 x109/L. De los pacientes con PTCP (Tabla 1) 24 (52%) eran adultos del sexo femenino y 15 (33%) del sexo masculino siendo los 7 (15%) restante recién nacidos (RN). Se encontró influencia entre la causa de PTCP y estos 3 grupos de pacientes, p=0,0376 (Gráfico 2), pero al comparar solo entre hombres y mujeres no se observó relación, p=0,1371. No hubo relación entre la causa de la PTCP y la condición de internación. 28 (61%) de los pacientes se encontraban internados y 18 (39%) no lo estaban, p=0,2979 (Gráfico 3), tampoco se relacionó la causa con los 22 diagnósticos diferentes que presentaron los pacientes, p=0,1884 (Tabla 2)
Tabla 2: Relación entre los diagnósticos y las causas de PTCP.
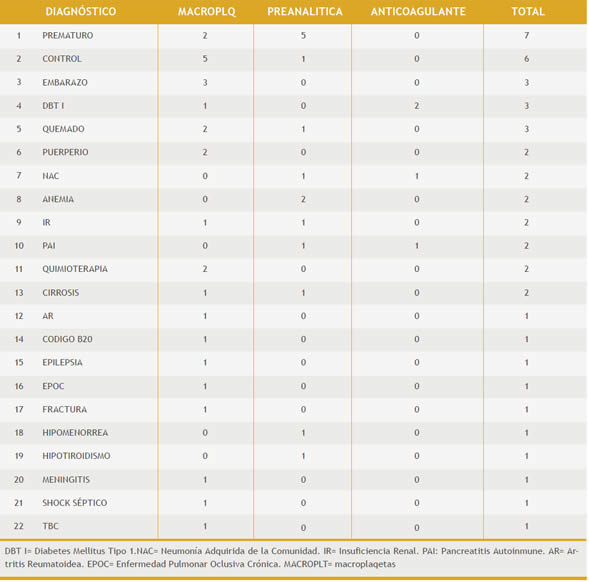
Gráfico 2. Relación entre el grupo de paciente y la causa de PTCP p=0,0376
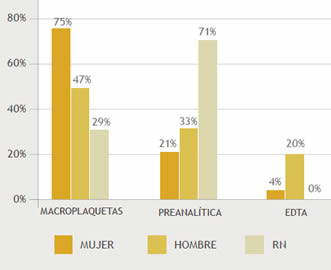
Gráfico 3. Relación entre la internación y la causa de PTCP. p= 0,2979
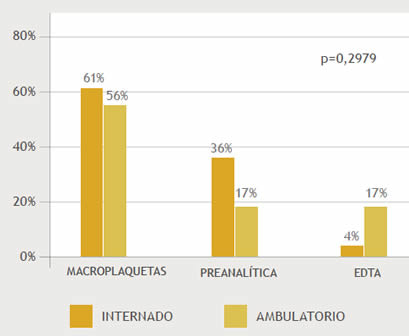
Fueron analizadas 38 (83%) muestras recolectadas en tubos comerciales de 3 mL, y 8 (17%) pediátricos (0,5 mL) encontrándose relación entre el volumen del tubo y la causa de PTCP, p=0,0178. (Gráfico 4)
Gráfico 4. Relación entre el volumen del tubo utilizado para la toma de muestra y la causa de PTCP. p=0,0178
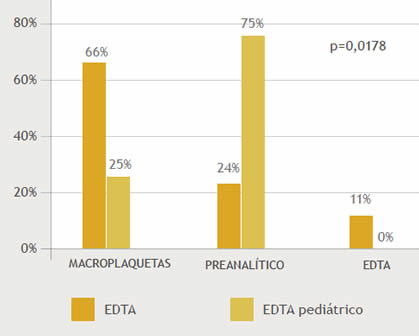
También se observó influencia entre el grado de la PTCP y la causa que la provoca, p <00,01(Tabla 3)(Gráfico 5)
Tabla 3. Relación entre grado y causa de PTCP
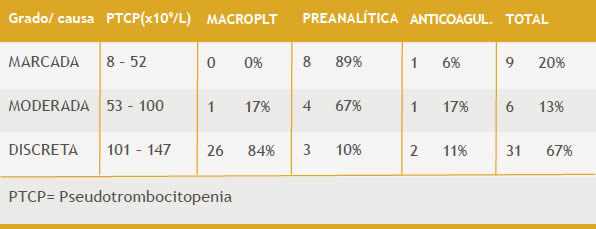
Gráfico 5. Relación entre el grado de PTCP y la causa que lo provoca. p <00,01
Discusión
Los resultados mostraron una baja prevalencia de PTCP en nuestro medio, dato que coincide con la bibliografía(12)(13)
La causa principal observada fue la presencia de MACROPLT. El aumento del tamaño de las plaquetas puede explicarse por efecto del anticoagulante (EDTAK2), que produce un cambio de forma progresivo por el cual éstas tienden a redondearse y aumentar de volumen. El aumento del volumen plaquetario también puede observarse en plaquetas jóvenes, que se presentan como mecanismo compensador de plaquetopenia periférica. Para explicar este fenómeno hay que tener en cuenta el fundamento del recuento automatizado. Para disminuir la prevalencia de PTCP por MACROPLT se pueden analizar las muestras entre las 2 y 6 horas de la extracción, ya que es el período idóneo para realizar el recuento, porque el VPM se estabiliza(2). La identificación de las plaquetas jóvenes o reticuladas pueden determinarse mediante un nuevo parámetro, la fracción de plaquetas inmaduras (IPF%)(14). La causa menos frecuente fue la PTCP dependiente de anticoagulante EDTA, que fue resuelta al realizar el recuento con un anticoagulante diferente como EDTA o Heparina. Existen anticoagulantes alternativos con aditivo a base de sal de Magnesio eficaz para resolver la PTCP inducida por EDTA.(15)(16)(17). Además se ha demostrado que la adición de amikacina a la muestra, revierte la aglutinación plaquetaria.(18)
Al relacionar las causas de PTCP con las variables de nuestra población, encontramos mayor prevalencia de MACROPLT en el sexo femenino y de los 7 RN con PTCP estudiados, 5 presentaron PTCP por causas preanalíticas (muestras coaguladas), dato que tiene mucho sentido al considerar la dificultad que presenta la toma de muestra en un RN. La condición de internación fue un factor que intervino en la frecuencia de PTCP predominando en la Unidad de Terapia Intensiva (22%) y siendo la causa principal la presencia de MACROPLT, aunque no hubo diferencias entre la causa de PTCP con los pacientes no internados. Se registraron 22 diagnósticos diferentes (Tabla 2), siendo el más común 7 (15%) RN prematuro, cuya causa principal fue la preanalítica 5 (71%) (muestra coagulada). Existen en la bibliografía entidades clínicas relacionadas con la PTCP causada por anticoagulante EDTA, que es la PTCP más estudiada(19) ,pero en este trabajo la distribución entre causa de PTCP y diagnóstico fue al azar. 2 (4%) paciente con diagnóstico de control postquimioterapia presentaron MACROPLT, esto podría explicarse porque un incremento de las PLT inmaduras se produce 2 o 3 días antes a la recuperación plaquetaria., sin embargo se requieren más estudios para confirmar este hallazgo(14).
La PTCP dependiente de EDTA se describe en asociación con enfermedades autoinmunes (AI)(18), neoplásicas, inflamatorias crónicas e infecciosas(20). De los 4 (9%) pacientes con PTCP producida por EDTA, solo 1 (2%) tenía Neumonía Adquirida de la Comunidad (NAC), de los 6 (13%) pacientes con enfermedades infecciosas. 2 (4%) con Diabetes tipo I (DBT I) y 1 (2%) paciente con diagnóstico de Pancreatitis Autoinmune (PAI), de los 6 (13%) pacientes con enfermedades AI. (Tabla 4)
Tabla 4: Cantidad de pacientes con enfermedades infecciosas y autoinmunes relacionadas a las causas de PTCP
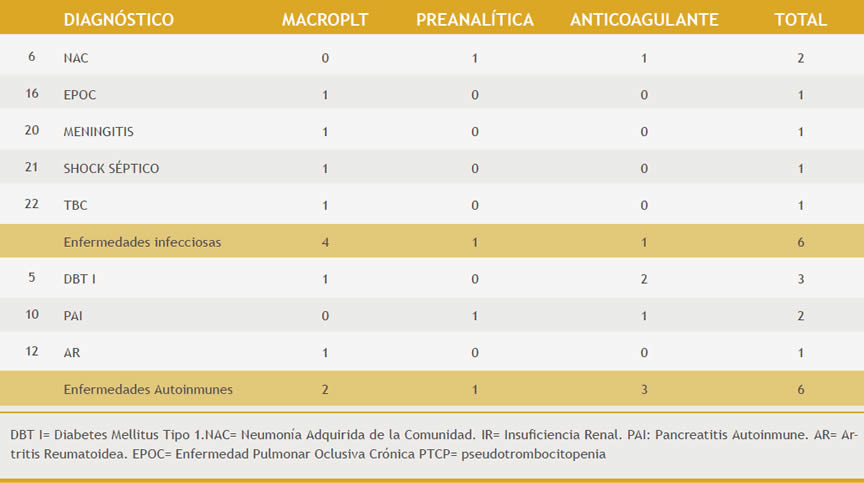
La principal causa de PTCP en tubos de 4 mL fue la presencia de MACROPLT y en tubos pediátricos de 0,5 mL fue la causa preanalítica (muestra coagulada), este último es de esperarse ya que los tubos de menor volumen son utilizados para extracciones dificultosas.
Agrupamos los valores de PTCP en 3 grados (Tabla 4) y observamos que 31 (67%) de las muestras tenían una PTCP entre 101 y 147 x109/L siendo la principal causa las MACROPLT (84%). Este dato debe tenerse en cuenta ya que algunos autores, basándose en la detección de trombocitopenias discretas en individuos aparentemente sanos, han establecido límites inferiores de normalidad más bajos, alrededor de 100 X 109/L (2). 9 (20%) tenía un recuento entre 8 y 52 x109/L (89%) correspondiente a causas preanalíticas (muestra coagulada). Entonces frente a recuentos ubicados en el límite inferior normal hay que considerar la presencia de MACROPLT y corregir la cantidad mediante el Método Manual y en recuentos marcadamente bajos pensar en que la muestra puede encontrarse coagulada y sugerir una nueva recolección.
Agrupar todas las causas de PTCP en este estudio nos permitió realizar un abordaje diagnóstico más completo para hacer una discriminación entre plaquetopenia verdadera y PTCP que puede ser descartada en el laboratorio, informando al médico un dato certero que puede resolver situaciones futuras, ya que se ha demostrado que la PTCP tiene recurrencia(12). Su identificación puede evitar procedimientos diagnósticos y terapéuticos innecesarios(7)(21)(22). Se debe tener en cuenta sobre todo cuando se observa trombocitopenia sin signos clínicos de sangrado.
La observación microscópica del frotis de sangre es fundamental para interpretar la PTCP, permite encaminarnos al abordaje de protocolos diagnósticos para confirmar o descartar patologías, muchas veces, sin necesidad de recolectar una nueva muestra.(1)(2)(5)(7)(11). Es de destacar la importancia de informar al paciente sobre la presencia de este fenómeno, así como también, consignarlo en la historia clínica, para así comunicarlo a todo el equipo de salud previniendo la toma de malas decisiones y perturbar el bienestar del paciente.
Referencias Bibliográficas
1. Maya GC. Evaluación del paciente con trombocitopenia. La clínica y el Lab. 2007;13(5):9–10.
2. Sans-Sabrafen J, Raebel CB. Hematología Clínica. Cuarta. S.A. © MMVI Elsevier España., Infanta Mercedes 90 – 7.a pl., 28020, editors. Madrid. España; 2001. 876 p.
3. M Morales1, A Moreno2 MM e YB. Pseudotrombocitopenia Edta-Dependiente: Rol Del Laboratorio Clínico En La Detección Y El Correcto Contaje Plaquetario. Vol. 24, Scielo. 2001.
4. Tessier-marteau A. Anomalies et erreurs de détermination de l ’ hémogramme avec les automates d ’ hématologie cellulaire. Ann Biol Clin (Paris) [Internet]. 2010;68(4):393–407. Available from: http://www.ncbi.nlm.nih.gov/pubmed/20650734
5. Xu W, Chen B, Chen Y. Ethylenediaminetetraacetate-dependent pseudothrombocytopenia accompanied by morphological changes. Int J Hematol. 2014;99(4):357–8.
6. Védy S, Boom B, Perez P, Schillinger S, Ragot C, Bakkouch S, et al. Numération automatique des plaquettes sur citrate de sodium: Le résultat est-il exact? Ann Biol Clin (Paris). 2011;69(4):453–8.
7. Lewis S, Bain BJ, Bates I. Dacie y Lewis HEMATOLOGIA PRACTICA. 10th ed. 2008.
8. Bobba RK, Doll DC. Platelet satellitism as a cause of spurious thrombocytopenia. Blood. 2012.
9. Tan GC, Stalling M, Dennis G, Nunez M, Kahwash SB. Pseudothrombocytopenia due to Platelet Clumping: A Case Report and Brief Review of the Literature. Case Rep Hematol [Internet]. 2016;2016:1–4. Available from: https://www.hindawi.com/journals/crihem/2016/3036476/
10. Salto Adriana Beatriz., Fontana Silvia., Marquesoni Eduardo. CMF. Valoración de índices plaquetarios en las trombocitopenias. Acta Bioquím Clín Latinoam. 2012;
11. E. Castelletto. Recomendaciones Para La Interpretación Del Frotis Sanguíneo Del Subprograma De Morfología Sanguínea. Septiembre 12 [Internet]. 2012; Available from: http://www.ispch.cl/sites/default/files/interpretacion frotis sanguineo – 14052013A.pdf
12. Froom P, Barak M. Prevalence and course of pseudothrombocytopenia in outpatients. Clin Chem Lab Med. 2011;49(1):111–4.
13. Xiao Y, Yu S, Xu Y. The Prevalence and Biochemical Profiles of EDTA-Dependent Pseudothrombocytopenia in a Generally Healthy Population. Acta Haematol. 2015;134:177–80.
14. Cambiazzo S. Fracción de plaquetas inmaduras (IPF%). Hematología. 2017;21(3):335–7.
15. Schuff-Werner P, Steiner M, Fenger S, Gross HJ, Bierlich A, Dreissiger K, et al. Effective estimation of correct platelet counts in pseudothrombocytopenia using an alternative anticoagulant based on magnesium salt. Br J Haematol. 2013;162(5):684–92.
16. Choccalingam C, Kanna Nandagopal Radha R, Snigdha N. Estimation of Platelet Counts and Other Hematological Parameters in Pseudothrombocytopenia Using Alternative Anticoagulant: Magnesium Sulfate. Clin Med Insights Blood Disord. 2017;10:0–5.
17. Kovacs F, Varga M, Pataki Z, Rigo E. Pseudothrombocytopenia with multiple anticoagulant sample collection tubes. Interv Med Appl Sci [Internet]. 2016;8(4):181–3. Available from: http://www.ncbi.nlm.nih.gov/pmc/articles/PMC5283778/
18. Carvajal-Vega E, Padilla-Cuadra JI, López-Villegas J, Mata-Sánchez M del M. Pseudotrombocitopenia por EDTA en paciente con polineuropatía desmielinizante inflamatoria crónica. Acta Med Costarric. 2016;
19. Isik A, Balcik OS, Akdeniz D, Cipil H, Uysal S, Kosar A. Relationship between some clinical situations, autoantibodies, and pseudothrombocytopenia. Clin Appl Thromb. 2012;18(6):645–9.
20. Xiao Y, Xu Y. Concomitant spuriously elevated white blood cell count, a previously underestimated phenomenon in EDTA-dependent pseudothrombocytopenia. Platelets. 2015;26(7):627–31.
21. Yin XL, Shen WD, Chen YS, Zhou Y, Zhang XH. Refractory platelet transfusion in a patient with CD36 deficiency due to pseudothrombocytopenia. Platelets. 2011;22(3):237–40.
22. General M. Uso Clínico de la Sangre. Organ Mund la Salud [Internet]. 2001;381. Available from: http://www.who.int/bloodsafety/clinical_use/en/Manual_S.pdf
https://www.sysmex.com/la/es/Products/Hematology/XTSeries/Pages/XT-2000-Hematology-Analyzer.aspx
https://www.sysmex.com/Insight/English/Pages/Contact-Us.aspx












