
Perfil de auto-anticuerpos y lactancia materna en pacientes diabéticos tipo 1
Francisco Pérez-Bravo1, M. Virginia Riesco S2 , Cecilia Albala B,Amaya Oyarzún A1 ,J Luis Santos M1 , Elena Carrasco P 2 .
1Bioquímico; 2Nutricionista
Correspondencia a: Dr. Francisco Pérez-Bravo, PhD. Laboratorio Biología Molecular, INTAUniversidad de Chile. Casilla 138-11 Santiago, Chile.
E-mail: fperez@uec.inta.uchile.cl
Rev. méd. Chile v.129 n.6 Santiago jun. 2001
Background: Islet cell-specific autoantibodies such as islet cell antibody (ICA), antiinsulin (IAA), anti-glutamic acid decarboxylase (GAD) and anti-tyrosine phosphatase (IA2) can be present in patients with type I diabetes. Breast feeding duration and the early exposure to milk substitutes are environmental factors associated to etiology of type 1 diabetes. Aim To study the frequency of the anti-GAD, anti- IA-2 e ICA antibodies in Chilean type 1 diabetic patients and determine the possible modulator effect of the breast feeding. Patients and methods: One hundred thirty four type I diabetic patients, aged one to 15 years old, were studied at the moment of their diagnosis. Patients were classified according to the duration of exclusive breast feeding. IA- 2 and GAD were determined by radio immuno assay and ICA by means of indirect immunofluorescence. Results: Subjects with three months or less and those with more than three months of breast feeding were positive for ICA in 78.8 and 90.6% of cases respectively, for GAD in 75 and 54.6% of cases respectively (p=0.024) and for IA-2 in 73 and 43.8% of cases respectively (p=0.001).
All three antibodies were positive in 53.9 and 21.8% of children with less or more than three months of breast feeding (p=0.001). Conclusion: Both IA-2 and GAD antibodies are less frequently positive in type 1 diabetic patients who have been breast fed for more than three months.
These findings suggest a possible attenuating role of exclusive breast feeding on pancreatic aggression events in patients with type 1 diabetes (Rev Méd Chile, 2001; 129: 611-9). (Key-words: Antibodies; Breast feeding; Diabetes mellitus; insulin-dependent)
Trabajo Financiado con Proyecto FONDECYT #1000944. Unidad de Nutrición Pública. Laboratorio de Biología Molecular. Instituto de Nutrición y Tecnología de los Alimentos (INTA). Universidad de Chile. Unidad de Diabetes y Nutrición. Hospital San Juan de Dios. Facultad de Medicina Occidente. Universidad de Chile.
La diabetes mellitus tipo 1 (insulinodependiente), es una enfermedad autoinmune caracterizada por la destrucción específica y paulatina de las células ß pancreáticas. Su mecanismo patogénico se explicaría, en parte, por la presencia de determinados factores ambientales que, ya sea en forma aislada o en combinación, gatillan en un individuo genéticamente susceptible un proceso de autoagresión conducente a la destrucción de las células ß pancreática (1,2).
No se conoce con certeza el mecanismo responsable de la destrucción de la célula ß pancreática. Existe amplia evidencia que relaciona la respuesta inmune, con una serie de eventos celulares, como la aparición de anticuerpos, entre ellos los denominados ICA (Islet Cell Antibodies), GAD (Decarboxilasa del Acido Glutámico), IAA (Insulin Autoantibodies), IA-2 (Anti tirosina fosfatasa) o anticuerpos anti BSA2,4.
Uno de los puntos más críticos en el estudio de la patogénesis de la diabetes tipo 1 ha sido entender por qué se desencadena la enfermedad, cuál es la importancia de la presencia de infiltrados mononucleares en el islote pancreático y la existencia de anticuerpos al momento del diagnóstico, cómo se desarrolla el proceso, cuales son las células y moléculas que participan, cuál es el orden de aparición de éstas, cómo y cuáles son las señales que se relacionan entre ellas y finalmente, cuáles son los mecanismos intracelulares que dañan específicamente al páncreas (3,5). Los diabéticos de diagnóstico reciente son los portadores del mayor número de ellos, siendo los más relevantes aquellos dirigidos contra las células del islote, ICA (6), y otros dirigidos contra determinadas entidades enzimáticas cuyo rol en la célula ß pancreática aún no está bien determinado, tal es el caso de la decarboxilasa del ácido glutámico, GAD (7), y la enzima tirosina fosfatasa, IA-2 (8). Numerosos estudios han determinado la frecuencia de GAD positivos en la diabetes tipo 1 de reciente diagnóstico, situando un título positivo entre el 70 a 80% de los casos y < 2% de positividad en individuos normales.En general parecen aumentar con la edad de diagnóstico y su presencia sería más frecuente en individuos portadores de alelos de riesgo como HLA-DR3 y su positividad en el individuo se limita sólo a algunos años post-diagnóstico (9). La proteína IA-2, es una enzima miembro de la familia proteína tirosina fosfatasa que no muestra una actividad enzimática importante y cuya función pancreática aún es desconocida. Se expresa en células neuroendocrinas y en muchas partes del sistema nervioso central. Se estima que cerca del 65% de diabéticos recién diagnosticados son portadores de IA-2+, en contraste con menos del 2,5% de los controles normales y diabéticos tipo 2, que poseen título positivo para este anticuerpo (10). La frecuencia de anticuerpos IA-2 en la diabetes tipo 1 varía con la edad, siendo alta en sujetos más jóvenes y en pacientes HLA-DR4, la positividad persiste a lo menos 1 año después del diagnóstico.
En términos generales, sólo 6% de los diabéticos tipo 1 recién diagnosticados son negativos a ICA, IA-2 y GAD (3,9,11,13). Estudios recientes indican que los ICA citoplasmáticos en ausencia de otros anticuerpos en contra de la célula ß confieren un bajo riesgo de progresión a diabetes aún en presencia de un alto título (14). Sujetos con altos niveles de GAD 65 y que poseen alelos protectores mantienen normal su primera fase de secreción insulínica, de tal modo que resulta difícil predecir su progresión al desarrollo de diabetes tipo 1. Las personas que presentan anticuerpos que reaccionan con más de un antígeno, usualmente progresan más rápidamente a diabetes tipo 1 (14,15). Desde el punto de vista nutricional, existen diversos estudios que concluyen que la leche materna contribuye activamente en la maduración del sistema inmunitario que procede con mayor celeridad en el niño amamantado por períodos más prolongados de tiempo (16).
La leche materna provee al individuo de determinadas hormonas y cofactores que contribuyen al revestimiento y sellado de la mucosa del intestino, haciéndolo más impenetrable a las agresiones externas (17,18). A nivel intestinal, la hiperactivación de las células T de la mucosa,
parece ser una característica relevante en varias enfermedades de base autoinmune. Dado que el sistema inmune a nivel del intestino, compromete cerca de los 2/3 del tejido linfoide en el hombre, podría esperarse que un detrimento en la respuesta a los componentes de la dieta tuviera alguna repercusión en otros órganos dianas como en el caso del páncreas (19,21).
Este estudio fue diseñado para evaluar el efecto de la lactancia materna exclusiva en un grupo de niños diabéticos de reciente diagnóstico planteándonos la hipótesis de que aquellos niños diabéticos con un período de lactancia exclusiva superior a 3 meses de duración, existiría un menor título de anticuerpos anti GAD y anti IA-2, como una forma de presentación más atenuada de su respuesta autoinmune.
Pacientes y Métodos
Pacientes. Los casos se obtuvieron de centros asistenciales públicos y privados. La primera fuente de información de casos pesquisados, correspondió a cada Unidad de Diabetes de los hospitales y clínicas participantes y como fuente secundaria de recolección de los casos,se utilizó la información de los registros de la Fundación de Diabetes Juvenil de Chile. Se incluyeron todos los casos nuevos diagnosticados en la Región Metropolitana, desde 1997 hasta 2000, menores de 15 años, que aceptaron participar. A todos ellos se les entregó información respecto de los objetivos y proyecciones de la investigación y se les solicitó un consentimiento escrito de participación voluntaria en el estudio. La fecha de diagnóstico correspondió al día de la primera inyección de insulina. El grupo de estudio así constituido, estuvo formado por 134 niños diabéticos con una edad promedio de 8,5 (1-15 años).
Se realizó un estudio caso-caso comparando el título del anticuerpos en relación al status de lactancia materna exclusiva mayor o menor de tres meses La determinación del perfil de autoanticuerpos se logró en el 81,3% de los niños con lactancia exclusiva ?3 meses y en el 91,0% de los casos con lactancia exclusiva ?3 meses. En un grupo de 54 niños captados durante 1997 y 1998, se estudió la persistencia del título de anticuerpos al año y a los dos años del diagnóstico. La encuesta nutricional fue realizada en 134 niños debutantes, no obstante en las tablas de resultados se resume la información relacionada a 116 en los cuales fue posible analizar completamente en estudio de anticuerpos.
En todos los casos, tanto diabéticos como en el grupo control se recolectó una única muestra de 5 mL de sangre para la obtención de suero y plasma. En el momento de la toma de muestra, al menos uno de los padres debió estar presente para firmar la autorización correspondiente.
Encuesta. En todos los casos se aplicó una encuesta para recopilar la información necesaria sobre antecedentes familiares de otras enfermedades, especialmente aquellas de origen autoinmune. La encuesta también consignó información relacionada a factores ambientales de exposición tales como: duración de lactancia materna exclusiva, lactancia total e incorporación a fórmulas lácteas artificiales, leche de vaca e introducción a otro tipo de alimentación sólida.
En el 70% de los casos la información obtenida en las encuestas fue validada comparándola con la respectiva ficha clínica del caso, principalmente el registro de patología viral y algunos datos de duración de lactancia materna, peso de nacimiento y registro de vacunación. Para efectos de comparación, la encuesta que hemos realizado, corresponde a una traducción y adaptación del sistema de encuesta validado por el Departamento de Medicina Preventiva y Biométrica de la Universidad de Colorado, Denver y ha sido facilitada por una de nuestras colaboradoras del Barbara Davis Center (Dra Jill Norris).
Laboratorio. La muestra de sangre obtenida luego de la punción venosa, fue procesada en el Laboratorio de Biología Molecular del INTA, centrifugada a 2500 rpm en centrífuga convencional durante 10 min. El plasma y suero obtenido, fue colectado en tubos eppendorfs de 1,5 mL en alícuotas de 100 ?l para las diversas determinaciones de anticuerpos. La caracterización de los anticuerpos se realizó en tres etapas. Para la determinación de anticuerpos anti decarboxilasa del ácido glutámico (GAD) y anticuerpos anti tirosina fosfatasa (IA-2) se empleó un radioinmunoanálisis (RIA) de los Laboratorios Cis Bio International (Francia). Ambos sistemas utilizan GAD e IA-2 humana recombinante, emplean como trazador 125 I y permiten establecer un sistema de discriminación de positividad o negatividad frente a curva de calibración. El coeficiente de variación intraensayo para anti-GAD fue de 2,9% y de 3,1% para anti-IA-2. El coeficiente de variación interensayo fue de 3,6% para anti-GAD y del 5,1% para anti-IA-2. La determinación de ICA fue realizada mediante inmunofluorescencia indirecta en cortes de páncreas humano en el laboratorio del Dr. Alberto de Leiva. Universidad Autónoma de Barcelona, España (6,22). Todas las determinaciones fueron realizadas en duplicado y en el caso de los pacientes diagnosticados en 1997-1998 la determinación se realizó en muestra congelada desde su debut (Proyecto Fondecyt 1970204) y en muestra fresca colectada el año 2000. Un grupo control sano formado por 107 niños cuya edad fue de 9 ± 4,6 años, todos ellos sin antecedentes de diabetes tipo 1, de los cuales sólo se consideró información relativa a la distribución de anticuerpos con el objetivo de tener un valor de referencia del título en población no diabética.
Análisis estadístico. La validación de los datos y su análisis fue realizado con el programa estadístico STATISTICA. Los valores de las variables se expresaron como media y desviación estándar cuando tenían una distribución normal o con rangos si no la tenían. La comparación entre los dos grupos de lactancia materna se evaluó a través de la prueba no paramétrica de Wilcoxon ya que la variable duración de lactancia exclusiva no es homogénea. Los valores del resto de las variables fueron analizadas mediante prueba «t» Student.
Resultados
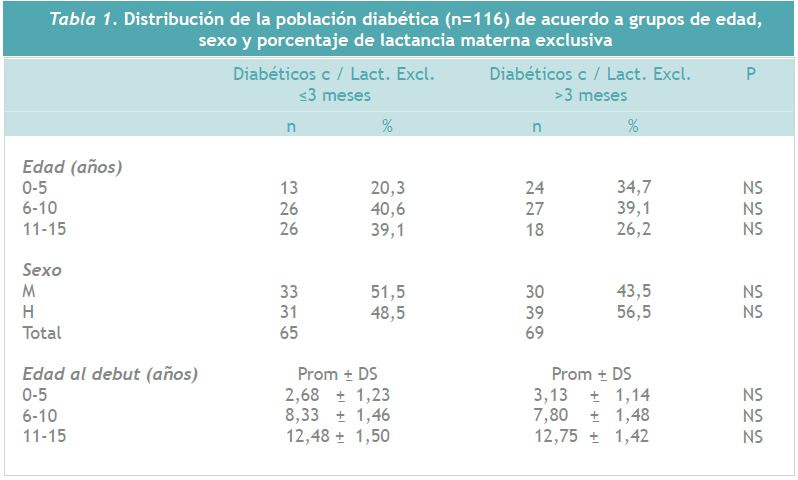
Los 134 diabéticos se dividieron en 2 grupos de acuerdo a la duración de lactancia materna exclusiva: mayor o igual de 3 meses y >3 meses. En este sentido, el promedio de lactancia materna exclusiva fue de 1,17 (rango 0-3) meses en el grupo que recibió lactancia por períodos ? 3 meses. El grupo con lactancia materna exclusiva superior a los tres meses presentó un promedio de 8,2 (rango 3,5 -24) meses. En relación a la lactancia materna exclusiva, la Tabla 1 resume la información relacionada a la distribución del grupo de niños, divididos por períodos de exclusividad de lactancia materna. No se observaron diferencias importantes al considerar grupos de edad, género y edad al inicio de la diabetes.
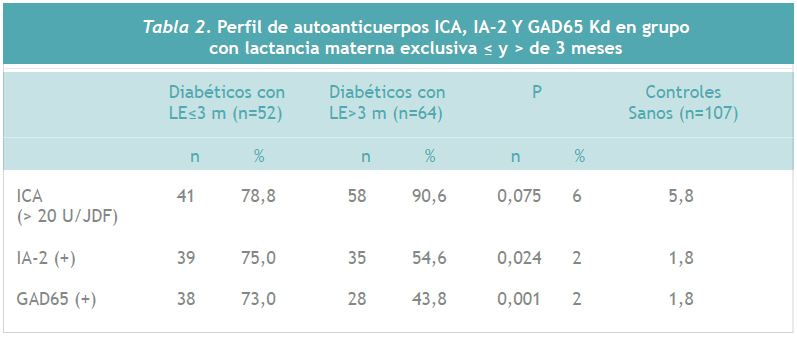
La Tabla 2 resume la información de la distribución de los anticuerpos según lactancia materna exclusiva. Para los anticuerpos IA-2 y GAD, la distribución del título positivo fue significativamente superior (p3 meses. Para el anticuerpo ICA, se detectó una positividad mayor, aunque no significativa, en los niños con lactancia exclusiva >3 meses. En relación al grupo de niños controles sanos, los porcentajes de títulos positivos para los 3 anticuerpos analizados, tanto ICA, IA-2 y GAD, se encuentran dentro de los rangos descritos para población sana.
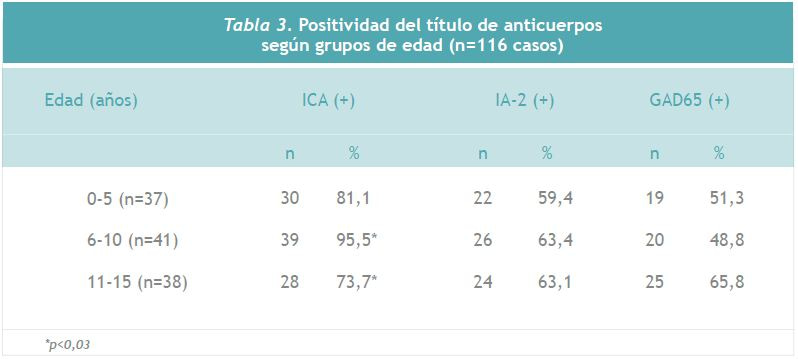
La Tabla 3 muestra la distribución de los anticuerpos positivos ICA, IA-2 y GAD según grupos de edad. La única variable que presenta un valor significativamente diferente entre los grupos de edad es el porcentaje de ICA positivos, que se encuentra en mayor proporción en los debutantes entre 6 y 10 años de edad. Respecto a IA-2 se observa una leve disminución de anticuerpos positivos en el grupo de menor edad. En el caso GAD, se observa una tendencia al aumento de positivos en el grupo de diagnóstico de mayor edad, sin alcanzar significación.
El porcentaje de títulos negativos en los niños diabéticos fue en promedio similar en aquellos con lactancia materna menor o igual a 3 meses. La La agregación de IA-2 y GAD positivos fue de 23,4% en el grupo con lactancia exclusiva menor o igual a 3 meses y del 63,4% en los diabéticos con lactancia reducida (p
Por otra parte, se analizó la persistencia en el tiempo del título positivo de cada anticuerpo Además, la agregación de 3 anticuerpos positivos fue claramente más frecuente en los niños con lactancia materna mayor o igual a 3 meses (53,9% vs 21,8%, p=0,001).
Por otra parte, se analizó la persistencia en el tiempo del título positivo de cada anticuerpo en un subgrupo de niños diabéticos (n=54) en los cuales había transcurrido un período de 1 y 2 años respectivamente desde su debut con la enfermedad (Figura 1). La persistencia del título positivo para ICA fue bastante alta en este subgrupo de niños diabéticos, incluso hasta pasados 2 años de su debut con la enfermedad.
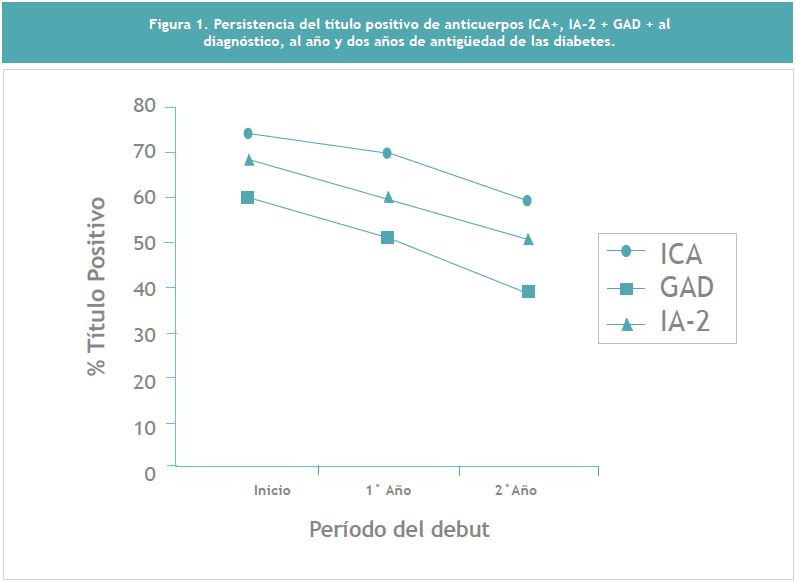
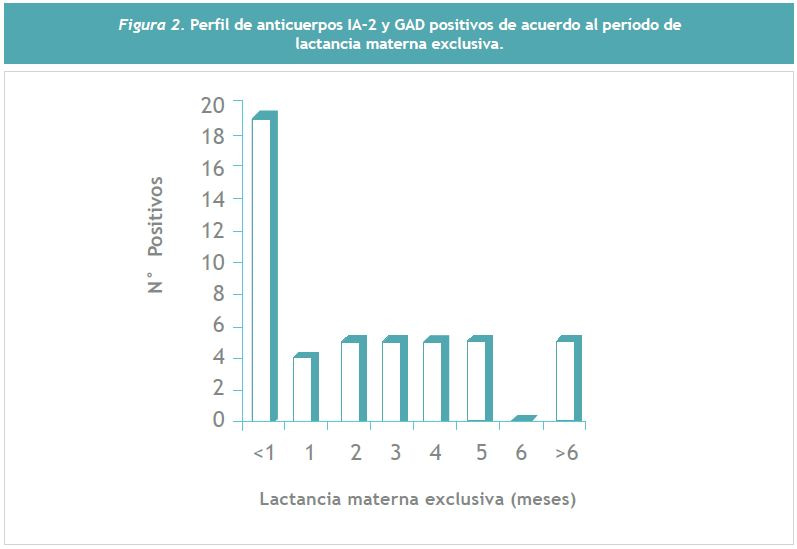
El descenso observado en IA-2 a los 2 años no alcanzó significancia. Finalmente, la Figura 2, indica la acumulación de anticuerpos positivos utilizando un corte más detallado del período de lactancia materna exclusiva. Se observa claramente que alrededor del 40% de los niños diabéticos que recibieron una lactancia materna exclusiva inferior al mes de duración, son portadores positivos de IA-2 y GAD, indicando probablemente que la lactancia superior al mes ya es un evento importante en la reducción de este perfil crítico de anticuerpos positivos.
Discusión
Dentro de los estudios epidemiológicos realizados en diabetes tipo 1 en Chile, hasta hace algunos años, Santiago presentaba uno de los registros de incidencia más bajos del mundo (23). Sin embargo, este patrón tendiente a bajos valores ha ido modificándose paulatinamente con un notorio incremento en los últimos años (24). Dicho aumento podría deberse a una pesquisa más eficiente por parte de los centros asistenciales, situación discutible ya que en Santiago en general la pesquisa de casos ha funcionado bien o a una segunda condición que está de acuerdo con un incremento real de los casos y que corresponde al reflejo de la mayoría de las patologías autoinmunes y alérgicas que se encuentran en franco aumento. La diabetes tipo 1 no escapa a este incremento, de modo que los factores ambientales y de estilo de vida estarían jugando un papel preponderante en su creciente desarrollo (9,19).
Si bien, la predisposición genética parece esencial, la destrucción selectiva de la célula ß, posiblemente depende en forma significativa de un elemento ambiental (1,9). El principal problema en el estudio de la diabetes tipo 1 resulta ser el desconocimiento del antígeno que genera la puesta en marcha del proceso autoinmune. Si bien, el número de antígenos propuestos es creciente, todos los descritos hasta la fecha se mantienen en calidad de supuestos candidatos en el proceso de autoagresión (25,26).
Los esfuerzos actuales en las investigaciones diabetológicas han generado tres vertientes mayoritarias, una focalizada en el ámbito genético (ya sea con la caracterización de nuevos genes candidatos o con protocolos de terapia génica en modelos animales), un segundo enfoque asociado a definir los componentes inmunológicos presentes en la génesis de la diabetes tipo 1 (con estudios de intervención en familiares de
riesgo) y una tercera variante que persigue la integración de estos dos ámbitos con variables ambientales y que permitan definir modelos de interacción (27).
Sin embargo, el objetivo final de cualquier enfoque persigue la identificación potencial de individuos de riesgo, lo cual ha despertado un interés mayor al conocerse que la enfermedad, en la mayoría de los casos, cursa por un período preclínico variable, lo cual abre una esperanza de intervención preventiva. Desde el punto de vista de los anticuerpos predictivos su presencia sirve como evidencia de la existencia de tejido dañado iniciado por un proceso autoinmune; su importancia radicaría en que: 1) dichas moléculas podrían actuar como marcadores predictivos, 2) el estudio de los posibles factores ambientales que modulan la respuesta inmune frente a un determinado antígeno podrían eventualmente ser una herramienta útil en el intento de modificar el curso de la enfermedad. Es conocido que la expresión de un único anticuerpo, aun cuando esté constantemente presente por años, no está asociado con progresión a diabetes tipo 1. Observaciones realizadas en parientes jóvenes de primer grado de diabéticos tipo 1, por ejemplo IAA+ en un período de varios años, demuestran la aparición paulatina de anticuerpos adicionales, este hecho sugiere que la pérdida de tolerancia es progresiva especialmente en individuos jóvenes (4).
Es de interés destacar que en adultos y niños mayores de 8 años, los niveles de anticuerpos son bastante estables a través de los años incluso en evaluaciones prospectivas, lo cual sugiere que una vez activado el proceso autoinmune los individuos se podrían agrupar en dos categorías: a) sujetos que se mantienen con un único anticuerpo y que tienen un bajo riesgo de progresión al desarrollo de diabetes tipo 1 y b) sujetos que portan múltiples anticuerpos y que se encuentran dentro de 80% de riesgo de desarrollar diabetes tipo 1 dentro de 10 años (4,9,11).
La descripción de un perfil de riesgo para algunos anticuerpos, de los cuales se ha establecido con claridad su frecuencia, ICA+ en el 70-80% de los pacientes, IAA+ en el 30-40% y GAD+ en 80- 90% de los casos de diabetes tipo 1(28,31), han permitido diseñar diversos estudios poblacionales y familiares para definir su papel predictivo, el cual lamentablemente no es completamente informativo. Así, sujetos que poseen hasta cuatro anticuerpos, pueden no desarrollar diabetes tipo 1 comparativamente a otros que son portadores de dos o tres anticuerpos (11).
Lo anterior es relevante ya que existirían combinaciones de anticuerpos que podrían generar mayor riesgo. Lo anterior guarda relación con el concepto de que ICAes uno de los anticuerpos más sensibles y con mayor persistencia en el diabético, no obstante en sujetos ICA positivos ha sido la fase precoz de respuesta a la insulina, el elemento predictivo más fuerte (12).
En otro sentido, la positividad de los otros anticuerpos como IA-2 y GAD se relaciona más con el grado de estabilidad metabólica que manifiestan los pacientes. ICA puede permanecer con un alto título positivo incluso cuando el diabético lleva años de evolución. No obstante, GAD e IA-2 son importantes en función que su positividad se ha asociado a la inestabilidad del diabético, como a una mayor tendencia a bajos niveles de péptido C con posterioridad al debut (13,32).
Nuestro estudio diseñado en población diabética ha analizado la modificación que genera un agente ambiental, en este caso la lactancia materna exclusiva, sobre el perfil de anticuerpos. Hace algunos años (33), nuestro grupo publicó un posible efecto de interacción entre períodos variables de lactancia materna con genotipos de riesgo HLA en un estudio casocontrol, donde fue posible observar variaciones
del riesgo relativo de padecer la enfermedad al incluir la variable lactancia.
Nuestros datos actuales describen un porcentaje promedio del 7,0% de títulos negativos entre esta población diabética, cifra similar al descrito en la literatura que destaca cifras del 6-8% y que han constituido en el último tiempo un subtipo de diabetes tipo 1 denominada «diabetes fulminante» o tipo 1b, la cual cursaría con mayor agresividad desde el punto de vista de la estabilidad metabólica del debutante y que carece de marcadores de autoinmunidad (32). También muestran una clara tendencia a una menor respuesta autoinmune aquellos niños que recibieron lactancia materna exclusiva más prolongada, efecto observado tanto en el porcentaje de positividad de los anticuerpos GAD e IA-2, como en la sumatoria de los tres anticuerpos positivos.
Respecto de la distribución de los anticuerpos positivos ICA, IA-2 y GAD según grupos de edad, existe evidencia bibliográfica que indica que la positividad de GAD aumenta con la edad del diagnóstico del paciente y que IA-2 cursaría en forma distinta, es decir, se encontrarían títulos más positivos mientras más precoz sea el debut de diabetes tipo 1 (14), lo que no fue corroborado en forma clara por este estudio.
La importancia de la lactancia materna como agente protector y potenciador del desarrollo inmune intestinal es evidente (16,18). Es posible especular, que la exclusividad de la lactancia materna tiene un papel clave en la maduración de este sistema, el cual en un ambiente adverso como una baja lactancia, podría exhibir una deficiente tolerancia a los antígenos dietarios recibidos en la alimentación posterior (34). Muy recientemente, se ha publicado en la literatura un nuevo estudio realizado en Finlandia, con un diseño muy similar al propuesto en nuestro estudio, que deja de manifiesto que la temprana exposición a sustitutos lácteos y una lactancia exclusiva disminuida serían elementos predisponentes en población susceptible a los signos de autoinmunidad beta celular (35).
Una característica clave de las patologías autoinmunes en el hombre, es lo restringido de los auto-antígenos. Dicha restricción antigénica filogenéticamente conservada es consistente con el concepto de que la no adaptación del sistema inmune innato es crítica en el desarrollo de la enfermedad. En este sentido, el impacto modulador de los factores dietarios parece esencial. La existencia de patologías autoinmunes como la diabetes tipo 1 o la enfermedad celíaca, induce a suponer la posibilidad de error en algunos de los mecanismos de control del sistema inmune, entre ellos el quiebre de tolerancia que podría ser gatillado por antígenos de la dieta (18,20).
La detección de población de riesgo a padecer diabetes tipo 1 seguirá constituyendo uno de los pilares fundamentales de la investigación en diabetes. Si bien, las investigaciones de orden farmacológico han presentado resultados discutibles, la búsqueda nuevas medidas de intervención, posibles antígenos desencadenantes de la respuesta inmune, así como la potenciación de medidas preventivas en la infancia cobran especial relevancia.
Agradecimientos
Este trabajo ha sido financiado totalmente con el Proyecto Fondecyt #1000944. Los autores agradecen profundamente la participación de todos los Hospitales y Clínicas participantes en este estudio, así como el apoyo de la Fundación de Diabetes Juvenil de Chile. Agradecemos en forma especial la colaboración de las enfermeras Sra. Alejandra Avila (IDIMI, Hospital San Borja Arriarán) y Sra. Claudia Ibarra (Clínica Alemana). Esta investigación constituyó la Tesis de Magister en Nutrición Clínica de María Virginia Riesco.
Referencias Bibliográficas
1. Dorman JS. Molecular epidemiology of insulin-dependent diabetes mellitus. Epidemiol Rev 1997; 19: 91-8. [Links]
2. Akerblom HK, Knip M, Hyoty H, Reijonen H, Virtanen S, Savilahti E, Ilonen J. Interaction of genetic and environmental factors in the pathogenesis of insulindependent diabetes mellitus. Clin Chim Acta 1997; 257: 143-56. [Links]
3. Leslie RDG, Atkinson MA, Notkins AL. Autoantigens IA- 2 and GAD in type 1 (insulin-dependent) diabetes. Diabetologia 1999; 42: 3-14. [Links]
4. Bingley PJ, Bonifacio E, Williams AJK, Genovese S, Bottazzo GF, Gale EAM. Prediction of IDDM in the general population: strategies based on combination of autoantibody markers. Diabetes 1997; 46: 1701-10. [Links]
5. Tian J, Olcott A, Hanssen L, Zekzer D, Kaufman DL.Antigen-based immunotherapy for autoimmune disease: from animal model to humans?. Immunol Today 1999; 20: 190-4. [Links]
6. Morales J, Puig-Domingo M, Lampasona V, Corcoy R, Dyrberg T, Mauricio D, et al. Can we replace ICA? Risk assessment by using fluid phase multiantibody analysis in a prediabetic Spanish cohort. Av Diabetol 1998; 14: 91-8. [Links]
7. Atkinson MA, Bowman MA, Campbell L, Darrow BL, Kaufman DL, Maclaren NK. Cellular immunity to a determinant common to glutamate decarboxilase and coxsackie virus in insulin-dependent diabetes. J Clin Invest
1994; 94: 2125-30. [Links]
8. Schloot NC, Pozzilli P, Mandrup-Poulsen T. Immune markers for monitoring the progression of autoimmune disease. Diabetes Metab Res Rev 1999; 15: 141-5. [Links]
9. Kukreja A, Maclaren NK. Autoimmunity and Diabetes. J Clin Endocrinol Metab. 1999; 84: 4371-7. [Links]
10. Payton MA, Hawkes CJ, Christie MR. Relation-ship of the 37,000 and 40,000 Mr tryptic fragments of islet antigens in insulin dependent diabetes to the protein tyrosine phosphatase like molecule IA-2 (ICA 512). J Clin Invest 1995; 96: 1506-11. [Links]
11. Kulmala P, Savola K, Petersen J, Vahasalo P, Karjalainen J, Lopponen T, et al. Prediction of insulin dependent diabetes mellitus in siblings of children with diabetes. A population based study. J Clin Invest 1998; 101: 327-36. [Links]
12. Maiz A, Manrique M, Hodgson MI, Diaz de Valdés M, Acosta AM, Andrade L, Olmos P. Prevalencia de anticuerpos anti islotes pancreáticos en 1021 parientes de diabetes tipo 1. Rev Méd Chile 1999; 127: 515-22. [Links]
13. Vandewalle CL, Falorni A, Lernmark A, Goubert P, Dorchy H, Coucke C, et al. Associations of GAD65 and IA-2 autoantibodies with genetic risk markers in new onset IDDM patients and their siblings. Diabetes Care 1997; 20: 1547-52. [Links]
14. Charles F, Verge and George S. Eisenbarth. Natural History of Autoimmunity in Type 1 DM. In: Derek leRoith (eds). Diabetes Mellitus, 1st ed. Philadelphia, USA 1996; 155-77. [Links]
15. Bonifacio E, Genovese S, Braghi S, Bazzigaluppi E, Lampasona V, Bingley PJ, et al. Islet autoantibody markers in IDDM: risk assessment strategies yielding high sensitivity. Diabetologia 1995; 38: 816-22. [Links]
16. Hanson LA. Human milk and host defence: immediate and long-term effects. Acta paediatr 1999; 88: 42-6. [Links]
17. AS Goldman. The immune system of human milk:antimicrobial, antiinflammatory and immuno-modulating properties. In: Pediatrics InfectiousDisease Journal 1993; 12: 664-71.
18. Kolb H, Pozzilli P. Cow`s milk and type 1 diabetes: the gut immune system deserves attention. Immunology Today 1999; 20: 108-10. [Links]
19. Dahlquist G. The aetiology of type 1 diabetes: an epidemiological perspective. Acta Paediatr 1998; 425 : 5 10. [Links]
20. Kolb H. On the aetiopathogenesis of type 1 diabetes: key roles for innate immunity and dietary antigens? Exp Clin Endocrinol Diabetes 1999; 107: 13-16. [Links]
21. Vaarala O, Knip M, Paronen J, Hamalainen AM, Muona P, Vaatainen M, Illonen J et al. Cow´s milk formula feeding induce primary immunization to insulin in infants at genetic risk for type 1 diabetes. Diabetes 1999; 48: 1389- 94. [Links]
22. Pilcher CC, Elliot RB. A sensitive and reproducible method for the assay of human islet cell antibodies. J Immunol Methods 1990; 129: 111-7. [Links]
23. Carrasco E, Pérez-Bravo F, Santos JL, López G, Calvillán M, Wolff C, García de los Ríos M. One of the lowest validated incidence rates of insulin dependent diabetes mellitus in the Americas: Santiago, Chile. Diab. Res Clin Pract 1996; 34: 153-7. [Links]
24. Carrasco E, Mondragón A, Santos JL, Pérez F. Incidence of type 1 diabetes mellitus under 15 years in Santiago, Chile 1993-1997. Diab Res Clin Pract 2000; 50: S-120. [Links]
25. Sabbah E, Savola K, Kulmala P, Reijonen H, Veijola R, Vahasalo P, et al. Disease-associated autoantibodies and HLA-DQB1 genotypes in children with newly diagnosed insulin-dependent diabetes mellitus (IDDM). Clin Exp Immunol 1999; 116: 78-85. [Links]
26. Strebelow M, Scholosser M, Ziegler B, Rjasanowski l, Ziegler M. Karlsburg type 1 diabetes risk study of a general population: frequencies and interactions of the four major type 1 diabetes-associated autoantibodies studied in 9419 schoolchildren. Diabetologia 1999;42:661-
27. Schaid DJ. Case-parents design for gene-environment interaction. Genetic Epi 1999: 6: 261-73. [Links]
28. Maclaren MK. How, when and why to predict IDDM. Diabetes 1988; 37: 1591-6. [Links]
29. Riley WJ. Identification of insulin-dependent diabetes mellitus before onset of clinical symptoms. J Pediatr 1988; 112: 314-318. [Links]
30. Ziegler AG. Predicting type I diabetes. Diabetes Care 1990; 13: 762-767. [Links]
31 Chase HP. Prediction of the course of pre-type I diabetes. J Pediatr 1991, 118: 838-841. [Links]
32. Carreras G, Pérez A, Mauricio D, Ortega E, Ortiz A, De Leiva A. Prevalence and characteristics of type 1 diabetes subtypes. Diabetologia 2000; 43 : A180. [Links]
33. Pérez-Bravo F, Carrasco E, Gutierrez-López MD, Martínez MT, López G, García de los Ríos M. Genetic predisposition and environmental factors leading to the development of insulin-dependent diabetes mellitus in Chilean children. J Mol Med 1996; 74: 105-9. [Links]
34. Paronen J, Bjorksten B, Hattevig G, Akerblom HK, Vaarala O. Effect of maternal diet lactation on development of bovine insulin-binding antibodies in children at risk for allergy. J Allergy Clin Immunol 2000; 106: 302-6.
35. Kimpimäki T, Erkkola M, Korhonen S, Kupila A, Virtanen SM, Illonen J, et al. Short-term exclusive breastfeeding predisposes young children with increased genetic risk of type 1 diabetes to progressive beta-cell autoimmunity. Diabetologia 2001; 44: 63-69. [Links]












