Manifestación hepática y colónica de la infección crónica activa por virus de Epstein Barr
CASO CLÍNICO
Alejandra Maricela Sabillón-Mendoza1 2 *
Karen Ignorosa-Arellano1
Jose Francisco Cadena-León1
Roberto Cervantes-Bustamante1 2
1Departamento de Gastroenterología y Nutrición, Instituto Nacional de Pediatría. Coyoacán, México.
2 Facultad de Medicina, Universidad Nacional Autónoma de México. Coyoacán, México.
versión On-line ISSN 2452-6053
Andes pediatr. vol.93 no.3 Santiago jun. 2022
http://dx.doi.org/10.32641/andespediatr.v93i3.3676
* Correspondencia: Alejandra Maricela Sabillón-Mendoza. Email: alesabillon@yahoo.com.
Este es un artículo publicado en acceso abierto bajo una licencia Creative Commons
Alcalde Eduardo Castillo Velasco 1838
Ñuñoa, Santiago
Casilla 593-11
Tel.: (56-2) 2237 1598 -2237 9757
revista@sochipe.cl
Resumen
Introducción
La infección crónica activa por Epstein Barr (CAEBV) es una condición poco común, donde el organismo no es capaz de contrarrestar la replicación del virus de Epstein Barr (EBV), llevando al paciente a un estado crónico con sintomatología variable. Es relevante el reconocimiento temprano de las manifestaciones clínicas poco frecuentes o atípicas, debido a las particularidades de su manejo y pronóstico.
Objetivo: describir un caso de CAEBV manifestada con colitis y hepatitis.
Caso Clínico: Niña de 6 años, previamente sana, presentó episodio recurrente de ictericia, hepatoesplenomegalia y fiebre, se diagnosticó hepatitis por EBV con una carga viral en sangre de 328,000 copias/mL. Su biopsia hepática reveló ARN codificado por el virus de Epstein Barr (EBER). Evolucionó con diarrea mucosanguinolenta y baja de peso, la colonoscopia mostró pérdida del patrón haustral, múltiples úlceras aftoides cubiertas con fibrina y se encontraron 7 millones de copias de EBV/gramo de tejido en colon. Se identificó la infección del linaje de células T, se inició Rituximab, con disminución de carga viral, resolución completa de diarrea y mejoría en pruebas de función hepática. El tratamiento definitivo realizado fue trasplante de médula ósea.
Conclusiones: La CAEBV es un trastorno grave, poco documentado, debe ser considerado ante el curso prolongado o intermitente de una hepatitis, acompañado de manifestaciones generales y gastrointestinales como diarrea crónica, hematoquecia, pérdida de peso, ya que su desenlace sin tratamiento puede ser fatal.
Palabras clave: Infección Crónica Activa por Virus de Epstein Barr, Hepatitis, Colitis, Mononucleosis
Abstract
Introduction: Chronic active Epstein Barr virus infection (CAEBV) is a rare condition, where the body is unable to counteract Epstein Barr viral replication (EBV), leading the patient to a chronic state with variable symptoms. Early recognition of infrequent or atypical clinical manifestations is relevant due to the particularities of their management and prognosis.
Objective: to describe a case of CAEBV manifes ted with colitis and hepatitis, summarizing the clinical-pathological and endoscopic characteristics and their evolution.
Clinical Case: A 6-year-old girl, previously healthy, presented recurrent episodes of jaundice, hepatosplenomegaly, and fever. EBV hepatitis was diagnosed with a blood viral load of 328,000 copies / mL. Her liver biopsy revealed Epstein-Barr virus-encoded small RNAs (EBER). She evolved with mucosanguineous diarrhea and weight loss; the colonoscopy showed loss of the haustral pattern, multiple aphthous ulcers covered with fibrin, and 7 million copies of EBV / gram of tissue were found in the colon. T-cell lineage infection was identified, therefore Rituximab was started, with a decrease in viral load, complete resolution of diarrhea, and improvement in liver function tests. The definitive treatment was bone marrow transplantation.
Conclusions: CAEBV is a serious disor der, little documented, and should be considered in the face of a prolonged or intermittent course of hepatitis, accompanied by general and gastrointestinal manifestations such as chronic diarrhea, hematochezia, and weight loss, since its outcome without treatment can be fatal.
Keywords: Chronic Active Epstein Barr Virus Infection, Hepatitis, Colitis, Mononucleosis
¿Qué se sabe del tema que trata este estudio?
El virus de Epstein Barr (VEB) es un microrganismo que infecta a más del 90% de la población mundial. La infección primaria que ocurre durante la infancia suele ser asintomática o puede causar síntomas autolimitados. Existe un grupo pequeño de pacientes que pueden tener un curso de infección crónica persistente con afección a órganos como hígado y colon.
¿Qué aporta este estudio a lo ya conocido?
Este texto aporta un caso clínico relevante que ayudará al reconocimiento temprano de las manifestaciones clínicas poco frecuentes o atípicas de la infección crónica por virus de Epstein Barr; establece diagnósticos diferenciales, debido a las particularidades de su manejo y pronóstico.
Introducción
El virus de Epstein Barr (VEB) es un herpes virus que infecta a más del 90% de la población mundial1. La infección primaria que ocurre durante la infancia suele ser asintomática, sin embargo, durante la adolescencia o más tarde, puede causar mononucleosis infecciosa autolimitada2. En un 20% de los pacientes, tras la infección primaria, el VEB toma un estado de latencia predominante en los linfocitos B con una expresión génica limitada que garantiza la evasión del reconocimiento por linfocitos T3. Algunos pacientes tendrán reactivación del virus y desarrollarán un curso crónico con síntomas persistentes o intermitentes, lo que se conoce como infección crónica activa por Epstein-Barr (CAEBV). Ésta tiene un carácter multifacético, con di versas manifestaciones clínicas y criterios diagnósticos que incluyen: a) síntomas similares a la mononucleosis, tales como fiebre, hepatoesplenomegalia y linfadenopatía durante más de tres meses de duración, en donde la hepatitis es común, se ha reportado elevación de transaminasas en 80% de los pacientes e ictericia en el 6,6%; b) títulos de anticuerpos contra el VEB y/o detección de una carga elevada del virus en sangre periférica o tejidos afectados; c) enfermedad crónica que no puede explicarse por otros procesos patológicos al momento del diagnóstico4.
En este sentido, cobra importancia el reconocimiento temprano de las manifestaciones clínicas poco frecuentes o atípicas, tales como una diarrea crónica intermitente acompañada o no con hepatitis recurren te en un paciente inmunocompetente, ya que a me nudo puede ser diagnosticado como una enfermedad inflamatoria intestinal, cuyas características clínicas, endoscópicas e histológicas son similares y se convierte en un desafío discernir si los síntomas son atribuibles o no a la infección. Los tratamientos para las dos enfermedades son completamente diferentes ya que los corticosteroides, inmunoterapia y fármacos citotóxicos serán tratamientos no curativos en el escenario de CAEBV y los pacientes pueden desarrollar trastornos de proliferación linfoide con un mal pronóstico y una alta tasa de mortalidad5, en su lugar, el trasplante alogénico de células madre hematopoyéticas cambiará la historia natural de esta enfermedad6,7. Una de las herramientas diagnósticas que marcará la diferencia será la presencia del ARN codificado por el virus de Epstein Barr (EBER) en tejido4.
El objetivo de este artículo es describir el caso de una paciente con colitis y hepatitis por VEB, se resumen las características endoscópicas, clínico-patológicas y evolución.
Caso clínico
Niña de 6 años, previamente sana, eutrófica, de procedencia rural, debutó con fiebre alta, mialgias, artralgias, acompañada de vómitos, diarrea, inapetencia y dolor abdominal en hipocondrio derecho. Dos semanas después se agregó ictericia, acolia y coluria, fue manejada en su comunidad como hepatitis viral, al encontrar pruebas de inflamación y excreción hepática elevadas: aspartato aminotransferasa (AST) 913 UI/L, alanino-aminotransferasa (ALT) 1376 UI/L, gamma-glutamiltranspeptidasa (GGT) 92,4UI/L, lactato deshidrogenasa (LDH) 675 UI/L, bilirrubina to tal (BT) 2,64mg/dL, bilirrubina directa (BD) 1,87mg/dL, pruebas de síntesis conservadas, albúmina (ALB) 4,1 g/dL, tiempo de protrombina (Tp): 12,3 segundos. Las serologías para Hepatitis A, B, C fueron negativas. Ocho semanas después se encontró completamente asintomática, con controles de enzimas hepáticas en ALT: 798 UI/L AST: 655 UI/L, sin lograr diagnóstico etiológico.
Seis meses después de este evento fue derivada a un hospital de referencia por nuevo episodio de fiebre, ictericia, vómitos, diarrea acuosa intermitente sin sangre, acompañada de dolor abdominal en hipocondrio derecho, con presencia de adenopatías cervicales y axilares, distensión abdominal, hígado de 4 cm y bazo 2 cm por debajo del reborde costal. Ultrasonido abdominal reportó hepatoesplenomegalia y engrosamiento de la pared vesicular de 3 a 4 mm, pruebas de inflamación hepática elevadas ALT: 1.945 U/L AST: 956 U/L, con colestasis GGT: 980 U/L BT: 6 mg/dL BD: 5 mg/ dl, ALB: 3,3 g/dL, se repitió serología en busca de virus hepatótropos, se descartó hepatitis A, B, C, citomegalovirus, parvovirus B19, anticuerpos IgM contra la cápside del virus del Epstein-Barr (EBV VCA IgM) negativos, anticuerpos IgG contra la cápside del virus del Epstein-Barr (EBV VCA IgG) positivos, antígeno temprano (EBV EA) y nuclear positivo (EBV EBNA). Se solicitó carga viral con reactivo Elitech® en sangre total por PCR cuantitativa con 328.000 copias/ml, subpoblaciones de linfocitos con afección en CD3, CD4 y CD19/20, estudios de autoinmunidad y metabolopatía negativos (Tabla 1).
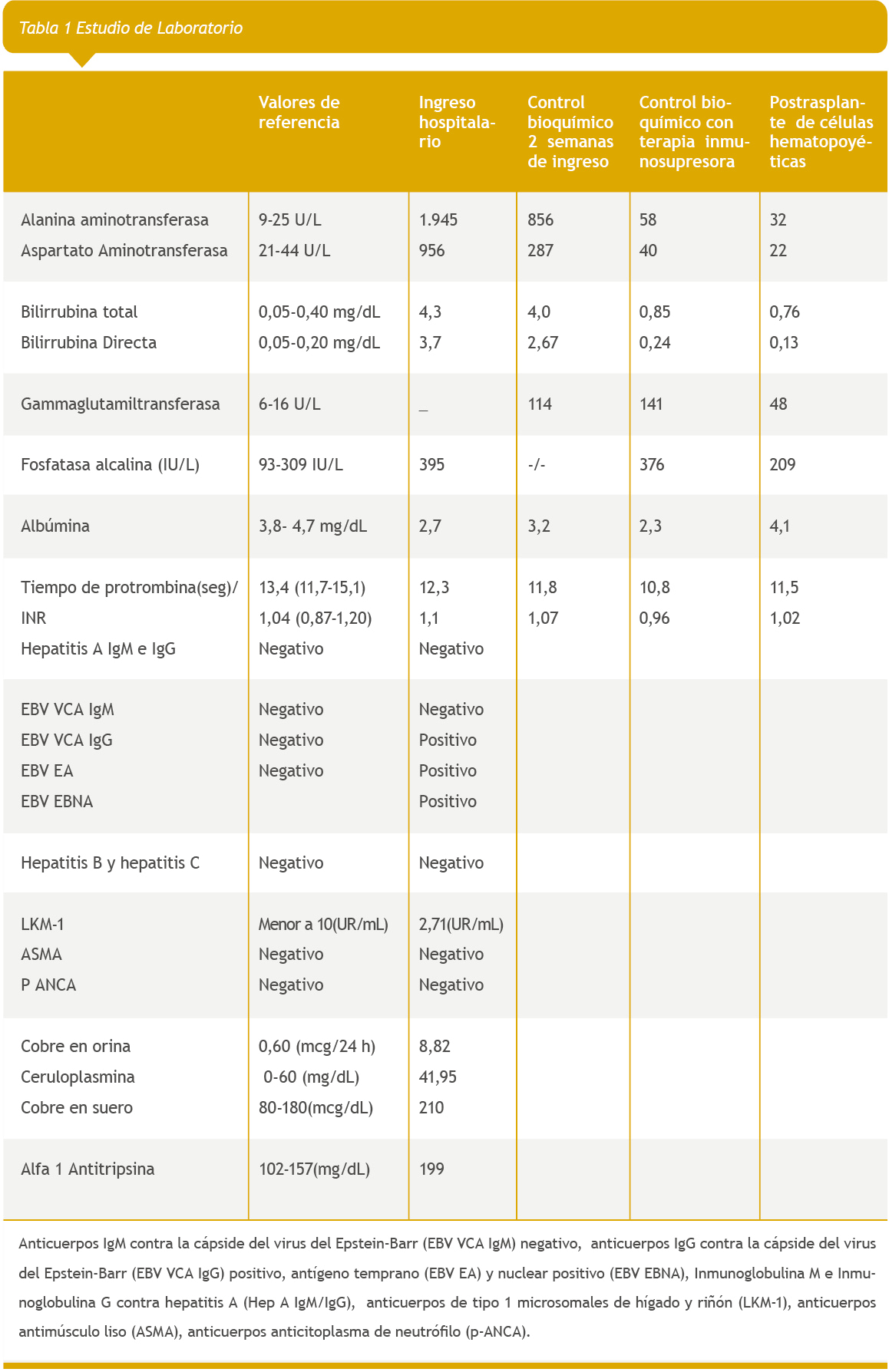
Debido a la carga viral de VEB se realizó biopsia hepática con inmunomarcaje para virus de Epstein Barr positivo (Figuras 1) (Figura 2), estableciendo el diagnóstico de hepatitis por VEB. Rápidamente progresó a deterioro del estado general, con fiebre alta, ictericia, dolor, distensión abdominal e inapetencia; además se cuantificó aumento de la hepatomegalia de hasta 6 cm por debajo del reborde costal y bazo de 4 cm por debajo del reborde costal. Dos semanas después de su ingreso se agregó diarrea muco-sanguinolenta, acompañada de dolor abdominal cólico y vómitos, con baja de peso progresiva de 5 kg durante su hospitalización, por lo que fue necesario el inicio de nutrición parenteral. Sus estudios coprológicos, coprocultivos, panel viral gastrointestinal, fueron negativos.
Ante la sospecha de una expansión clonal de EBV se instauró tratamiento con anticuerpo monoclonal anti CD20, a pesar de esto persistió carga viral en 328.000 copias/mL en sangre. Una semana después se añadió ciclosporina y metilprednisolona, sin mejoría, ya que continuó con fiebre, diarrea, ictericia y hematoquecia, por lo que se orientó el abordaje hacia una enfermedad inflamatoria intestinal, presentando anticuerpos anti-nucleares (ANA), anticuerpos frente al citoplasma de neutrófilos (p-ANCA) negativos, se descartó infección por Clostridium difficile.
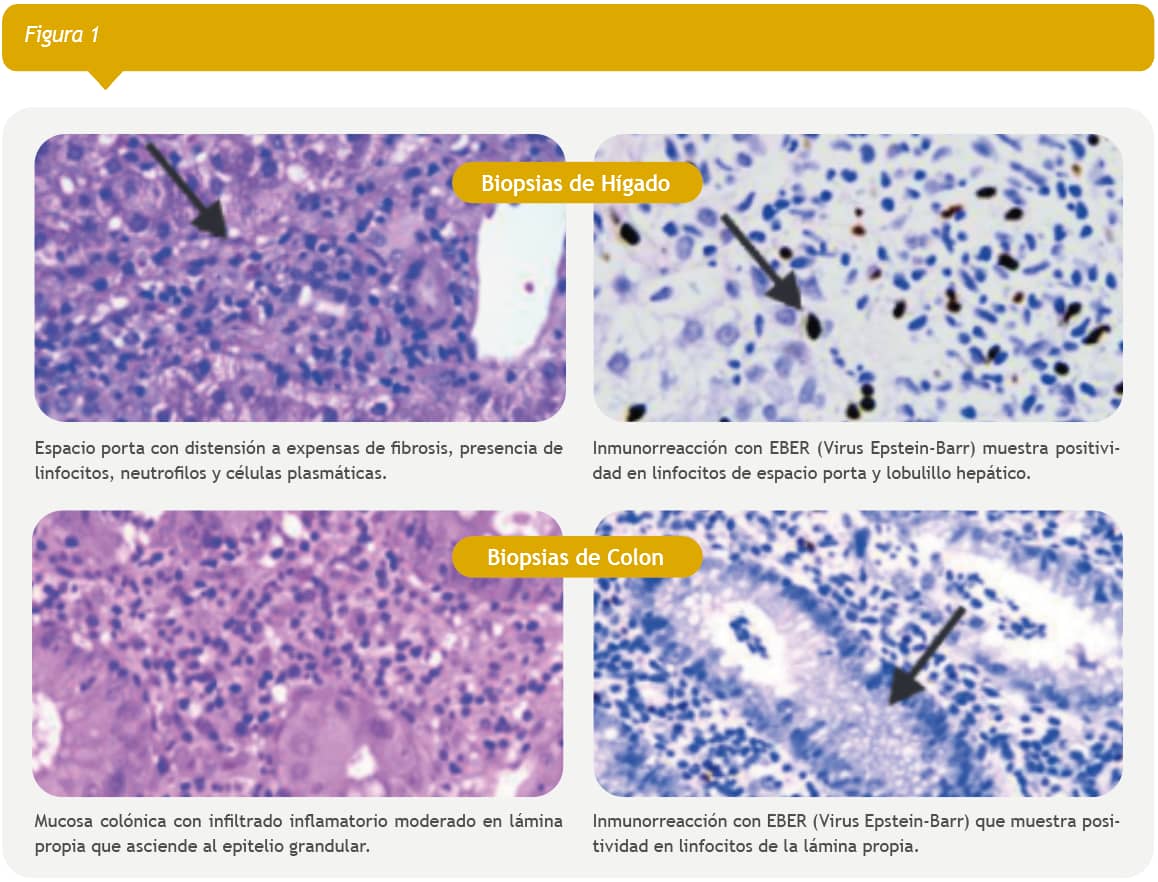
Se realizó pan-endoscopía y colonoscopía (Figura 2), donde se encontraron lesiones aftosas en mucosa de colon, pérdida del patrón haustral, aumento del patrón vascular y mucosa sumamente friable. Las biopsias reportaron inflamación crónica leve en cuerpo gástrico, colitis crónica y PCR en tejido con presencia de 7 millones de copias/gramo de tejido colónico de VEB (Fi gura 2), en el análisis de subpoblaciones de linfocitos, la línea de linfocitos T fue la afectada.
Siete meses después del inicio del tratamiento inmunomodulador se procedió al trasplante de células madre hematopoyéticas como único tratamiento curativo de esta afección. Evaluada siete meses postrasplante se encuentra asintomática, con pruebas de funciona miento hepático en límites normales, sin diarrea y con adecuado crecimiento (Tabla 1).
Discusión
La infección por EBV se adquiere desde edades muy tempranas; en la mayoría de los casos, cursa asintomática o como un proceso infeccioso autolimitado caracterizado por fiebre, coriza, adenopatías que generalmente dura dos semanas, de tal manera que, al llegar a la adultez, el 90% de la población presenta anticuerpos contra VEB8. No obstante, en un pequeño porcentaje de la población, la infección puede ser letal como un síndrome hemofagocítico o neoplasias malignas hematolinfoides como el linfoma de Burkitt, el linfoma de Hodgkin clásico y trastornos linfoproliferativos asociados a inmunodeficiencia9; en otros pacientes, el curso de la enfermedad evolucionará hacia una infección crónica activa. Esta última se caracteriza por proliferaciones de células B, T o Natural Killer del EBV cuyo diagnóstico precisa el cumplimiento de criterios específicos4. En nuestro paciente predominó el compromiso hepático y gastrointestinal.
Por su parte, la hepatitis causada por VEB es común, leve y autolimitada en la mayoría de los casos. La elevación de transaminasas que se observa en el 90% de los pacientes es transitoria, suele ser no mayor a 2 veces el límite superior de los niveles normales y son reflejo de la disfunción hepática parenquimatosa, la ictericia es secundaria a colestasis por la inhibición del trans porte de bilirrubina, así como daño citopático viral a los colangiocitos10,12. Los hallazgos ecográficos en la hepatitis por EBV incluyen características inespecíficas como hepatomegalia, esplenomegalia, adenopatía de portahepatis, edema periportal y engrosamiento de la pared de la vesícula biliar. O’Donovan y cols; realiza ron una asociación entre el engrosamiento de la pared de la vesícula biliar y la hepatitis por EBV, postulándolo como un signo de la gravedad de la enfermedad13. En pacientes con infección aguda primaria por EBV, la insuficiencia hepática fulminante es la principal causa de muerte, aunque el compromiso hepático grave es poco común10,11.
A nivel de intestino, el patrón endoscópico mostrado de úlceras superficiales se ha confundido con enfermedad inflamatoria intestinal (EII), sin embargo, su pronóstico es malo y su tasa de mortalidad es elevada sin tratamiento14. Un diagnóstico erróneo de CAEBV puede llevar a desenlaces fatales, por lo que se recomienda un amplio interrogatorio en búsqueda de síntomas consistentes y persistentes de mononucleosis infecciosa. En un estudio retrospectivo, Xu y cols.?(15?compara ron doce pacientes con CAEBV y enteritis contra veinticuatro pacientes con EII diagnosticada, se analizaron las características clínico-patológicas y endoscópicas, encontrando que las principales presentaciones clínicas de los pacientes con CAEBV fueron fiebre intermitente (100%), hepatoesplenomegalia (58%), linfadenopatía (50%), diarrea (50%) y hematoquecia (50%). En comparación con los pacientes con EII, la incidencia de fiebre intermitente y aumento del nivel de ferritina fue significativamente mayor entre los pacientes con CAE- BV. Los principales hallazgos endoscópicos de CAEBV incluyen úlceras multifocales o aisladas, irregulares, multiformes e inflamación difusa, sin la apariencia típica de adoquín. El tiempo medio de supervivencia en esta serie fue de 21 meses. Por su parte, Liu y su grupo16?encontraron que la frecuencia de fiebre intermitente, hepatomegalia, esplenomegalia, linfadenopatía, el valor de la proteína C reactiva y el ADN del virus de Epstein- Barr en suero fueron significativamente más altos en los pacientes con enteritis infecciosa crónica por el virus de Epstein-Barr activo en comparación con EII (p < 0,01). El estándar de oro para detectar el virus de Epstein-Barr en biopsias es hibridación in situ para ARN codificado por el virus de Epstein-Barr17. Los hallazgos histológicos en común mostraron inflamación transmural con infiltración linfoide extendida, úlceras fisurantes y linfocitosis intraepitelial. Sin embargo, la enteritis infecciosa crónica activa por el virus de Epstein-Barr carecía de granulomas y cambios en el tejido conectivo, como la hipertrofia neural y el engrosamiento de la muscularis mucosae. La diferencia entre estas dos entidades es fundamental para el tratamiento, ya que se han intentado múltiples terapias con esteroides e inmunosupresores18, concluyendo que éstos pueden disminuir la carga viral y evitar la expansión clonal. Sin embargo, es el tras plante alogénico de células madre hematopoyéticas el único tratamiento definitivo curativo, ya que permite la sustitución por células sanguíneas no infectadas por el virus19. Los protocolos de tratamiento actuales se basan en la quimioterapia seguido de trasplante, similar a las estrategias terapéuticas desarrolladas para la linfohistiocitosis hemofagocítica20,21. Cabe resaltar la importancia de conocer el linaje de linfocitos afectado, para el establecimiento adecuado de la terapia inmunomoduladora.
En nuestra paciente se utilizaron múltiples medicamentos inmunomoduladores para disminuir el ADN viral, obteniendo carga viral más baja y resolución de síntomas, con aplicaciones mensuales de rituximab, tal y como se ha descrito en la literatura con éxito en trastornos linfoproliferativos asociados a VEB22. Posteriormente recibió trasplante de médula ósea exitoso, con resolución de los síntomas tanto gastrointestinales como hepáticos.
Conclusiones
La infección crónica activa por el virus de Epstein- Barr es un trastorno grave, que debe ser considerado ante múltiples manifestaciones conjuntas o aisladas, hepáticas y gastrointestinales. Nuestro paciente ilustra la necesidad de mantener una alta sospecha de CAE- BV ante los signos de fiebre intermitente, hepatoesplenomegalia, adenopatías, hallazgos ultrasonográficos y endoscópicos atípicos, que no sean explicados por otros trastornos. Se deben realizar análisis de sangre para ADN-VEB y biopsia para EBER mediante hibridación in situ para confirmar el diagnóstico y no retrasar el tratamiento inmunomodulador, evitando la expansión clonal viral. En aquellos pacientes que debutan con síntomas digestivos, como diarrea crónica, es necesario establecer una ruta de diagnóstico que incluya etiologías infecciosas en primer lugar y, al tener resultados positivos por EBV, identificadla presencia del linaje celular afectado para orientar el tratamiento inmunomodulador.
Responsabilidades Éticas
Protección de personas y animales: Los autores declaran que los procedimientos seguidos se conformaron a las normas éticas del comité de experimentación humana responsable y de acuerdo con la Asociación Médica Mundial y la Declaración de Helsinki.
Confidencialidad de los datos: Los autores declaran que han seguido los protocolos de su centro de trabajo sobre la publicación de datos de pacientes.
Derecho a la privacidad y consentimiento informa do: Los autores han obtenido el consentimiento informado de los pacientes y/o sujetos referidos en el artículo. Este documento obra en poder del autor de correspondencia.
Conflicto de intereses: Los autores declaran no tener conflicto de intereses.
Referencias Bibliográficas
1. Chang CM, Yu KJ, Mbulaiteye SM, et al. The extent of genetic diversity of Epstein- Barr virus and its geographic and disease patterns: a need for reappraisal. Virus Res. 2009;143:209-21.
2. Balfour HH Jr, Holman CJ, Hokanson KM, et al. A prospective clinical study of Epstein-Barr virus and host interactions during acute infectious mononucleosis. J Infect Dis. 2005;192(9):1505-12.
3. Fernandez-Pol S, Silva O, Natkunam Y. Defining the elusive boundaries of chronic active Epstein-Barr virus infection. Haematologica 2018;103(6):924-7.
4. Kimura H, Cohen J. Chronic Active Epstein-Barr Virus Disease. Front. Immunol. 2017;8:1867.
5. Roth DE, Jones A, Smith L, et al. Severe chronic active Epstein-Barr virus infection mimicking steroid-dependent inflammatory bowel disease. Pediatr Infect Dis J. 2005;24(3):261-4.
6. Sawada A, Inoue M, Kawa K. How we treat chronic active Epstein-Barr virus infection. Int J Hematol. 2017;105(4):406- 18.
7. Okano M, Kawa K, Kimura H, et al. Proposed guidelines for diagnosing chronic active Epstein-Barr virus infection. Am J Hematol. 2005;80(1):64-9.
8. Fugl A, Andersen CL. Epstein-Barr virus and its association with disease – a review of relevance to general practice. BMC Fam Pract. 2019;20(1):62.
9. Gratzinger D, de Jong D, Jaffe ES. T and NK-Cell Lymphomas and Systemic Lymphoproliferative Disorders and the Immunodeficiency Setting: SH/EAHP Workshop Report – Part 4. Am J Clin Pathol. 2017;147(2):188-203.
10. Feranchak AP, Tyson RW, Narkewicz MR, et al. Fulminant Epstein-Barr viral hepatitis:orthotopic liver transplantation and review of the literature. Liver Transpl Surg. 1998;4:469-76.
11. Leonardsson H, Hreinsson JP, Löve A, et al. Hepatitis due to Epstein-Barr virus and cytomegalovirus: clinical features and outcomes. Scand J Gastroenterol. 2017;52(8):893-7.
12. Zhen H, Kong P, Christina O, et al, Prolonged hepatitis and jaundice: a rare complication of paediatric Epstein- Barr virus infection Singapore Med J 2015;56(7):112-15.
13. O’Donovan N, Fitzgerald E. Gallbladder wall thickening in infectious mononucleosis:an ominous sign. Postgrad Med J. 1996;72:299-300
14. Xuyang D, Ji L, Yue L, et al. The clinical characteristics of immunocompetent adults with chronic active Epstein-Barr virus associated enteritis. Chin J Intern Med 2018;57:487-93. [?Links?]
15. Xu W, Jiang X, Chen J, et al. Chronic active Epstein-Barr virus infection involving gastrointestinal tract mimicking inflammatory bowel disease. BMC Gastroenterol. 2020;20(1):257
16. Liu R, Wang M, Zhang L, et al. The clinicopathologic features of chronic active Epstein-Barr virus infective enteritis. Mod Pathol. 2019;32(3):387-95.
17. Kimura H, Hoshino Y, Kanegane H. Clinical and virologic characteristics of chronic active Epstein-Barr virus infection. Blood. 2001;98(2):280-6.
18. Cohen JI, Jaffe ES, Dale JK, et al. Characterization and treatment of chronic active Epstein-Barr virus disease: A 28-year experience in the United States. Blood. 2011;117(22):5835-49.
19. Sawada A, Inoue M, Kawa K. How we treat chronic active Epstein-Barr virus infection. Int J Hematol. 2017;105(4):406-18.
20. Okamura T, Hatsukawa Y, Arai H, et al. Blood stem-cell transplantation for chronic active Epstein-Barr virus with lymphoproliferation. Lancet. 2000;356:223-4.
21. Cacioppo JT, Kiecolt-Glaser JK, Malarkey WB, et al. Autonomic and glucocorticoid associations with the steady-state expression of latent Epstein-Barr virus. Horm Behav. 2002;42:32-41.
22. Shimizu H, Kobayashi N, Mihara M, et al. Successful Treatment of Epstein-Barr Virus-Associated Lymphoproliferative Disorder with Rituximab in a Patient Undergoing Immunosuppressive Therapy for Aplastic Anemia. Acta Haematol. 2016;136(3):174-7.







