
Hipopotasemia severa asociada al consumo excesivo de regaliz
Artículo Original
Rodríguez Rodríguez M., García Cano A., Rosillo Coronado M. y Jiménez Mendiguchía L.
Servicio de Bioquímica Clínica. H.U. Ramón y Cajal. Madrid
1- Rodríguez Rodríguez María del Mar. Licenciada en Bioquímica y CC. Químicas, y Dra en Bioquímica. Bioquímica Clínica, cuarto año.
Residente. H.U. Ramón y Cajal, Carretera de Colmenar Viejo, Km 9.1 28034, Madrid. Correo electrónico: mar_rodrirodri@hotmail.com
Tel: 600721429
2- García Cano, Ana. Licenciada en Farmacia, Facultativo Especialista. H.U. Ramón y Cajal, Carretera de Colmenar Viejo, Km 9.1 28034,
Madrid. Correo electrónico: anarex.1982@hotmail.com Tel: 679346371
3- Rosillo Coronado, Marta. Licenciada en CC. Químicas y Dra en Químicas. Facultativo Especialista. H.U. Ramón y Cajal, Carretera de
Colmenar Viejo, Km 9.1 28034, Madrid. Correo electrónico: mroscoro@yahoo.es Tel: 625496978
4- Jiménez Mendiguchía, Lucía. Licenciada en CC. Químicas. Facultativo Especialista. H.U. Ramón y Cajal, Carretera de Colmenar Viejo,
Km 9.1 28034, Madrid. Correo electrónico: luciamendi@hotmail.com Tel: 650279130
Resumen
Se presenta un caso clínico de hipopotasemia severa en el que se alcanzó el diagnóstico de pseudohiperaldosteronismo primario inducido por consumo excesivo de regaliz.
Un hombre de 55 años de edad es remitido al hospital por hipertensión (152/88 mmHg), hipopotasemia severa (1.8 mM/L) asociada con alcalosis metabólica (pH 7.57; bicarbonatos totales: 27.9 mmol/L) y modificaciones en el electrocardiograma (ECG). Ante la sospecha de aldosteronismo primario, se le realizan los procedimientos adicionales de diagnóstico. Una muestra de orina indica una inadecuada eliminación de potasio asociada a niveles bajos tanto de renina como de aldosterona en plasma, lo que orienta hacia un caso de pseudohiperaldosteronismo.
Una historia más detallada revela el consumo diario de regaliz, lo que ilustra la importancia primordial de un buen cuestionario.
Además, en este artículo se revisa la fisiopatología y las principales complicaciones del cuadro.
Abstract
A case of severe hypokalemia is presented, in which the diagnosis of liquorice-induced pseudohyperaldosteronism was made.
A 55-year old man is referred to our hospital for hypertension (152/88 mmHg), severe hypokalemia (1.8 mMol/l) associated with metabolic alkalosis (pH 7.57; total bicarbonates: 27.9 mmol/l) and ECG modifications. Primary aldosteronism is suspected and further diagnostic procedures are performed. An urine sample shows inappropriate potassium elimination associated with both low plasmatic renin and aldosterone levels, orienting the diagnosis toward a case of pseudohyperaldosteronism. A more detailed history reveals daily consumption of licuorice. This case illustrates the paramount importance of a detectivelike questioning.
Furthermore, in this article, the pathophysiology and the most serious complications of this syndrome are reviewed.
Palabras Claves: Hiperaldosteronismo primario, ácido glicirrético, hipopotasemia e hipertensión arterial. Primary aldosteronism, glycyrrhetinic
acid, hypopotasemia and arterial hypertension.
Presentación del Caso
Motivo de consulta: El paciente es remitido por el médico de atención primaria por alteraciones en el ECG no especificadas, sensación de mareo constante en los últimos dos días, astenia y parestesias distales en extremidades.
Antecedentes personales: Varón de 55 años con hipertensión arterial, gota, hipercolesterolemia e hipertrigliceridemia, estos dos últimos corregidos con dieta y estatinas.
El tratamiento actual que toma es: Pravastatina, indapamida, hipertene y alopurinol.
En la exploración física el paciente se encuentra consciente, orientado y bien hidratado. No focalidad neurológica motora ni sensitiva. TA: 152/88 mmHg, FC: 73 l.p.m., Tª: 36,5ºC. Buen estado general, no palidez, ictericia, cianosis, equimosis ni petequias. Abdomen blando, depresible, sin masas ni megalias. Tono rítmico y sin soplos, roces ni extratonos.
Respecto al informe del laboratorio: La bioquímica general y el hemograma demostraron que la mayoría de los parámetros estaban dentro de los intervalos de referencia (Tabla I). Los resultados bioquímicos más reseñables son el K de 1.8 mM/L y una troponina de 0.1 ng/mL. En la gasometría venosa (Tabla II) cabe destacar la alcalosis metabólica que presenta el paciente.
Tabla I. Bioquímica y hemograma del paciente a su ingreso.
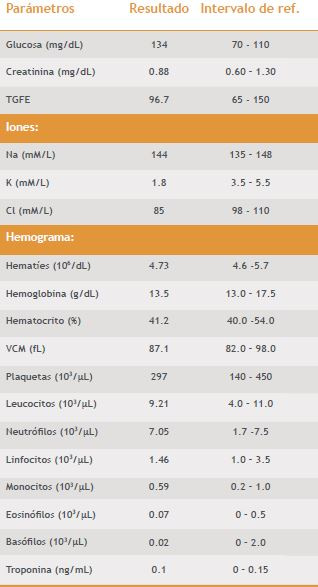
TGFE: Tasa de filtrado glomerular calculada por la ecuación MDRD4; VCM: Volumen corpuscular medio
El paciente permanece asintomático, clínica y hemodinámicamente estable durante toda su estancia en el Servicio de Urgencias. Sin embargo, las analíticas muestran una hipopotasemia severa mantenida a pesar de la sueroterapia y los aportes endovenoso y orales de potasio.
En nuevas entrevistas con el paciente, niega tomar más de una pastilla diaria de indapamida y diarrea, vómitos, dolor torácico, disnea, mareo o calambres musculares. Refiere haber tomado mucha agua, pero sin sustancias hipertónicas, niega fiebre o sintomatología infecciosa. Únicamente indica astenia y debilidad en los últimos dos días. Tampoco ha tenido cambios recientes en el tratamiento, pero reconoce comer dos tiras de regaliz (10 g/día) de manera habitual.
Tabla II. Gasometría venosa del paciente a su ingreso.

Además, se determinaron una serie de pruebas bioquímicas para el despistaje de la hipertensión y que permiten descartar algunas causas endocrinas que causan hipertensión secundaria:
a. La determinación de cortisol en suero (9.10 mg/dL con valores de referencia 3.70 – 19.40), la cortisoluria (53.25 mg /24h con valores de referencia 0 – 140) y ACTH (24.10 pg/mL con valores de referencia 5.0 – 46.0) descartan el síndrome de Cushing.
b. La determinación de la TSH (2.28 mUI/mL con valores de referencia 0.35 – 4.95) y T4 libre (0.94 ng/dL con valores de referencia 0.80 – 1.90) descartan una causa tiroidea.
c. La determinación de la concentración en suero de aldosterona (3.4 ng/dL) y de la actividad de renina plasmática (<0.31 ng/mL/h) son la prueba de primera línea para el despistaje del hiperaldosteronismo. Así, la proporción Ald/Ren en un paciente hipopotasémico hipertensivo nos indica (1,2):
- Hiperaldosteronismo secundario cuando ambas estén aumentadas y la proporción sea menor de 10, por ejemplo en la enfermedad renovascular.
- Cuando ambas están suprimidas debe considerarse una fuente alternativa de agonismo de receptor de mineralcorticoide, por ejemplo por un tumor exógeno, un síndrome de Cushing o una hiperplasia suprarrenal congénita.
- Cuando la renina está suprimida y la aldosterona está aumentada se sospecha de hiperaldosteronismo primario (HAP), dando lugar a una proporción Ald/Ren aumentada.
En el caso de este paciente, tanto la aldosterona como la renina, se encontraban suprimidas, lo que hace sospechar de un caso de pseudoaldosteronismo.
Por otro lado, las pruebas bioquímicas realizadas en orina de 24 horas revelan una concentración de potasio de 94.8 mM/L. El gradiente de potasio transtubular (GTTK) calculado mediante la siguiente ecuación:

resultó 19.35, el cual es elevado y con esto se confirma la pérdida excesiva de K renal. Siguiendo el algoritmo diagnóstico de la Fig.1, la medición de la excreción de potasio urinario en 24 horas puede establecer si la pérdida de K es renal. Además, la hipomagnesemia, que induce hipopotasemia, se descartó en este paciente debido a que la concentración de magnesio estaba en el intervalo de referencia, y el aumento de dióxido de carbono elimina la posibilidad de la cetoacidosis diabética y la acidosis tubular renal como causas.
Por otro lado, es necesario tener en cuenta la concentración urinaria de cloro (en este caso 117 mEq/L) que refleja el estado volumétrico del paciente. En función del cloro urinario se pueden agrupar las causas de la alcalosis metabólica en dos grupos:
- Las que presentan un cloro urinario disminuido (<15 mEq/L) y refleja una retención urinaria máxima de cloro y un estado de hipovolemia. En este grupo encontramos pérdidas digestivas de hidrogenoides, efecto tardío de diuréticos y alcalosis post-hipercapnia.
- Las causas de alcalosis metabólica que cursan con cloro urinario elevado (>15 mEq/L). En estos casos la tensión arterial aporta mucha información, pues si es normal cabe pensar en el síndrome de Bartter o de Gitleman. Si por el contrario la tensión es elevada, nos encontramos ante el caso de nuestro paciente, que se trata de un hipermineralcorticismo, un síndrome de Liddle o el abuso de regaliz.
Con objeto de evaluar el subtipo de aldosteronismo se le realizaron los estudios de imágenes de las glándulas suprarrenales:
• El TAC abdominal reveló un derrame pleural bilateral de moderada cuantía y distribución típica que condiciona atelectasia pasiva de ambos módulos inferiores. Hígado, bazo, páncreas y riñones sin hallazgos patológicos. Ambas adrenales son de tamaño y morfología normales, sin identificar nódulos ni otras lesiones. No se observan adenopatías retroperitoneales ni mesentéricas de tamaño significativo.
El paciente ingresa en la Unidad de Agudos para la monitorización y canalización de la vía central para reposición intravenosa de potasio. En días sucesivos, sigue una dieta normal sin sal, suspendiendo el consumo de regaliz y con el siguiente tratamiento: Potasion solución oral, aldactone, enalapril, pravastatina y alopurinol, presentando mejoría clínica, analítica y electrocardiográfica hasta normalización de potasio (Fig.2).
Discusión
Las alteraciones del metabolismo del potasio se encuentran entre las más frecuentes en la práctica clínica. Su espectro de gravedad es variable, desde la hipopotasemia leve inducida por diuréticos a la hiperpotasemia grave de consecuencias fatales. Ambas ocasionan alteraciones de la polarización de la membrana celular que dan lugar a diversas manifestaciones clínicas. La gravedad de las manifestaciones clínicas de la hipopotasemia se correlaciona con los niveles de potasio sérico y con la velocidad de su instauración. La hipopotasemia moderada (3-3.5 mEq/L) generalmente no producen síntomas. Sin embargo, grados más importantes de hipopotasemia pueden causar síntomas cardiacos (anomalías del ECG), neuromusculares (debilidad, astenia, calambres, parestesias…) y renales (disminución del filtrado glomerular, alcalosis metabólica, pérdida de cloro,…), así como diversas alteraciones endocrinas y metabólicas como el descenso de insulina e intolerancia a los hidratos de carbono.
Los hallazgos primarios anormales, encontrados en este paciente, fueron la hipertensión con hipokalemia concurrente y alcalosis metabólica. Esta hipopotasemia con alcalosis metabólica, presenta un amplio diagnóstico diferencial. La medición de la excreción de potasio urinario en 24 h estableció la pérdida excesiva del mismo y esto, junto con un gradiente de potasio transtubular elevado, una hipertensión y unos bajos niveles de renina y aldosterona, conlleva a que la pérdida es debida a tres posibles causas principalmente (Fig 1). Este pseudohiperaldosteronismo es una condición que clínicamente imita al hiperaldosteronismo con la supresión de los niveles de la actividad de renina en plasma y de aldosterona. Las causas más frecuentes se pueden clasificar en dietéticas, genéticas y endocrinas. Las causas genéticas incluyen el síndrome de Liddl debido a una mutación del gen que codifica para las subunidades beta y gamma del canal de sodio, incrementando la reabsorción del mismo(3). Entre las causas endocrinas la principal es la hiperplasia suprarrenal congénita. Y entre las causas dietéticas se incluye el consumo excesivo de regaliz(4),
carbenoxolona o jugo de pomelo, siendo el regaliz el causante del caso presente.
Figura 1. Algoritmo diagnóstico de la hipopotasemia.

Por otro lado, la pérdida de potasio urinario puede ser causado por diuréticos tiazídicos como es la indapamida que actúa inhibiendo el sistema de transporte Na/Cl en el túbulo distal renal, disminuyendo la reabsorción de Na y aumentando su excrección. De esta forma, estos diuréticos disminuyen la presión arterial, pero pueden no ser suficientes para normalizar la hipertensión refractaria. Nuestro paciente, aunque toma indapamida, negó haber modificado la dosis en los últimos meses. Además de la indapamida, el paciente toma imidapril, que es un inhibidor de la enzima convertidora de angiotensina (ECA) que disminuye la presión arterial disminuyendo la producción de aldosterona y, por lo tanto, la de sodio y agua y así disminuye la volemia. Este fármaco presenta una tendencia a producir hiperpotasemia, no pudiendo ser el causante de la patología descrita. Sin embargo, hay que tenerlo en cuenta puesto que puede alterar los resultados obtenidos en la actividad de la renina. En este caso, los valores de la actividad de renina fueron indetectables, lo que es un fuerte predictor de hiperaldosteronismo primario, independientemente de la ingesta de inhibidores de ECA.
Figura 2. Evolución del potasio en el paciente durante las primeras 60 horas de ingreso.

Como ya se ha descrito, el consumo de regaliz puede causar efectos indeseables como hipertensión e hipopotasemia, síntomas y hallazgos similares a los que también se observan en el síndrome de Cushing, el síndrome ectópico de ACTH, anomalías de los receptores mineralcorticoides, y el síndrome de exceso aparente de mineralcorticoide(5,6). La ingesta crónica de la raíz del regaliz (Glyzyrrhiza glabra) y su extracto o compuestos similares como la carbenoxolona produce una forma adquirida leve de exceso aparente de mineralcorticoides con HTA, hipopotasemia, alcalosis metabólica, actividad de renina plasmática baja y niveles plasmáticos de aldosterona disminuidos(7). Cantidades relativamente pequeñas de regaliz de tan sólo 50 g/día durante dos semanas elevan la presión arterial en individuos normales(8). El principio activo del regaliz es el ácido glicirrízico, que se hidroliza in vivo a su aglicona, el ácido glicirretínico. El ácido glicirrízico y el glicirretínico tienen una baja afinidad por el receptor mineralcorticoide, pero son potentes inhibidores de la 11—hidroxiesteroide deshidrogenasa tipo 2 (11-HSD2) (tanto competitivamente como reduciendo su expresión genética), causando a través de este mecanismo sus efectos mineralocorticoides(9,10).
La glicirrina, el constituyente principal del regaliz, se absorbe como ácido glicirretínico, que es producido por enterobacterias antes de su liberación a la circulación. El ácido glicirretínico circulante se metaboliza en el hígado convirtiéndose en 3-mono-glucuronil-glicirretínico (3MGA), que se excreta en la bilis vía Mrp2 (multidrug resistance protein 2). Si la función de Mrp2 está dañada por alguna causa, 3MGA se secreta desde el hígado a la circulación, excretándose en la orina a través de los transportadores de aniones orgánicos expresados en la membrana basolateral de las células epiteliales tubulares. En el caso del ácido glicirretínico, que se une a la albúmina sérica, no pasa a través de la filtración glomerular, no siendo sustrato de los transportadores(11,12).
El pseudohiperaldosteronismo inducido por el consumo de regaliz se desarrolla por la inhibición de la 11-HSD2, acumulándose cortisol en las células epiteliales tubulares que activarán los receptores de corticoides minerales y éstos a su vez la excreción de potasio. Como el ácido glicerritínico no puede pasar a las células epiteliales tubulares, es el 3MGA el agente causal(13).
Conclusión
En este paciente parece que la hipopotasemia es consecuencia de una distribución intracelular de potasio como consecuencia de varios factores: el estrés junto con pérdidas renales debido al uso de diuréticos y a la toma de regaliz, provocando el pseudohiperaldosteronismo primario. El regaliz, que parece ser el factor desencadenante principal en este caso, presenta una ligera actividad mineralcorticoide, por lo que aumenta la reabsorción de sodio y agua, y favorece la pérdida renal del potasio. Parece ser que estos efectos mineralcorticoides podrían deberse en un primer momento a la inhibición de la 11-HSD2 renal, disminuyendo la degradación de cortisol a cortisona. Este aumento de los niveles de cortisol estimula a los receptores de aldosterona. Por otra parte, el ácido glicirrético se une a los receptores de aldosterona, ejerciendo unos ligeros efectos mineralcorticoides directos. En pacientes que toman altas dosis de regaliz (100 mg/24 h) o durante períodos continuados (4-6 semanas) podría aparecer un desequilibrio hidroeléctrico caracterizado por hipernatremia, hipervolemia y/o hipopotasemia.
Por lo tanto, la ingesta de regaliz es una de las causas de hipermineralcorticismo no relacionado con la aldosterona. Aunque es una situación muy poco frecuente y que requiere una alta sospecha clínica, no se debe olvidar esta causa en una situación de hipertensión e hipopotasemia persistentes, ya que se pueden tener graves efectos clínicos si no se trata adecuadamente, suspendiendo la toma de regaliz y con suplementos de potasio.
Financiación. No se ha recibido financiación.Conflicto de Intereses. Los autores declaran no tener ningún conflicto de intereses.
Referencias Bibliográficas
1.-Mattsson C. and Young WF Jr. Primary aldosteronism: diagnostic and treatment strategies. Nat. Clin. Pract. Nephrol. 2006. 2: 198-208.
2.-Young WF and Kaplan NM. Pathophysiology and clinical features of primary aldosteronism. UpT oDate, 2016.
3.-Scheinman SJ, Guay-Woodford LM, Thakker RV and Warnock DG. Genetic disorders of renal electrolyte transport. N Engl J Med. 1999; 340(15):1177-87.
4.-Hesham R. Omar, Irina Komarova, Mohamed El-Ghonemi, Ahmed Fathy, Rania Rashad et al. Licorice abuse: time to send a warning message. Ther Adv Endocrinol Metab. 2012; 3(4): 125–38.
5.-Yasue H, Itoh T, Mizuno Y and Harada E. Severe hypokalemia, rhabdomyolysis, muscle paralysis and respiratory impairment in a hypertensive patient taking herbal medicines containing licorice. Intern Med. 2007; 46:575–578.
6.-Draper N and Stewart PM. 11 Beta-hydroxysteroid dehydrogenase and the pre-receptor regulation of corticosteroid hormone action. J Endocrinol. 2005; 186:251– 71.
7.-Bozec E, Lacolley P, Bergaya S, Boutouyrie P, Meneton P. et al. Arterial stiffness and angiotensinogen gene in hypertensive patients and mutant mice. J Hypertens 2004; 22(7):1299-307.
8.-Benetos A, Topouchian J, Ricard S, Gautier S, Bonnardeaux A, et al. Influence of angiotensin II type 1 receptor polymorphism on aortic stiffness in never-treated hypertensive patients. Hypertension 1995; 26(1):44- 7.
9.-Benjafield AV, Wang WY and Morris BJ. No association of angiotensin converting enzyme 2 gene (ACE2) polymorphisms with essential hypertension. Am J Hypertens 2004; 17(7):624-8.
10.-White PC, Agarwal AK, Li A, Nikkila H, Pratt JH, et al. Possible association but no linkage of the HSD11B2 gene encoding the kidney isozyme of 11beta-21 hydroxysteroid dehydrogenase to hypertension in Black people. Clin Endocrinol (Oxf) 2001; 55(2):249-52.
11.-Ploeger BA, Meulenbelt J and DeJongh J Physiologically based pharmacokinetic modeling of glycyrrhizic acid, a compound subject to presystemic metabolism and enterohepatic cycling.Toxicol Appl Pharmacol. 2000; 162(3):177-88.
12.-Palermo M, Armanini D and Delitala. Grapefruit juice inhibits 11beta-hydroxysteroid dehydrogenase in vivo, in man. G Clin Endocrinol (Oxf). 2003; 59(1):143-4.
13.-Armanini D, Calò L and Semplicini A. Pseudohyperaldosteronism: pathogenetic mechanisms. Crit Rev Clin Lab Sci. 2003; 40(3):295-335.











