Fracción de plaqueta inmadura e índice de granulocitos inmaduros como indicador de infección, analizados en el Sysmex XE 2100, en pacientes con concentraciones altas de procalcitonina, Medellín, Colombia
Patricia E. Jaramillo A (1), Astrid Escobar (2), Julia M Urrea (2), Ana C. Cardona R.+ Leidy P. Arcila L (3), Kelly J. Sánchez C. (3)
(1) Magister en Microbiología Enf Hematología, Especialista en hematología y Manejo de Banco de Sangre, Docente Universidad de Antioquia.
(2) Bacterióloga IPS Clínica León XIII
(3) Estudiante de pregrado Microbiología y Bioanalisis Universidad de Antioquia.
Resumen
Introducción: El diagnóstico temprano de la infección es valioso en el paciente hospitalizado que ingresa con síntomas compatibles de sepsis con leucocitosis o el paciente leucopénico hospitalizado durante la quimioterapia, la búsqueda de nuevos marcadores de infección como la procalcitonina (PCT), los granulocitos inmaduros (GI), la fracción de plaqueta inmadura (FPI) como marcadores tempranos, indican que no es necesario un recuento alto de leucocitos para que estos parámetros me sugieran infección bacteriana.
Objetivos: Correlacionar la FPI, los GI el conteo de leucocitos (CL) en pacientes con sospecha de infecciónque tiene la PCT elevada con el resultado del hemocultivo.
Metodología: Se realizó un estudio descriptivo, transversal en 52 pacientes hospitalizados en la clínica León XIII IPS U de A, con sospecha de infección que presentaron la PCT elevada, evaluada por electroquimioluminicencia procesada en el COBAS 6000, se comparó con las variables FPI, GI y CL realizadas por citometría de flujo y fluorescencia, en el Sysmex XE-2100, y el resultado del hemocultivo procesados en el Versa –Trek, por medio de transducción de presión y presencia de gases. La información fue almacenada en una base de datos en el software SPSS versión 18.0, se tomó un nivel de significación estadística de 0,05.
Resultados: El grupo de estudio presentó una diferencia en el manejo de hospitalización por infección donde la PCT fue significativamente elevada, pacientes con sospecha de infección sin quimioterapia (QT) y otro grupo con QT que presentaron leucopenia, en general presentaron una media de PCT de 19.5 ng/dL, los leucocitos arrojaron valores entre 0,05 x 103/uL y 34,1 x 103/uL, el 50% de los valores centrales de la FPI estuvo entre 2,4% y 7,9%, resaltamos valores de GI entre 1.7% en quimioterapia y 1.3% en infección sin QT y valores de la FPI de 6.9% y 6.3% respectivamente. La PCT, los GI, y la FPI fueron más altas en los pacientes con hemocultivo positivo que tenían leucopenia por quimioterapia.
Conclusiones: La PCT se considera predictor de infección y se ha demostrado que dependiendo de su concentración es el grado de infección, lo que se pudo confirmar en esta investigación, del mismo modo los GI y la FPI se hallaron significativamente aumentados en los pacientes con infección que tenían hemocultivos positivos aún en pacientes leucopénicos.
Palabras clave: Procalcitonina, granulocitos inmaduros, fracción de plaqueta inmadura, sepsis, infección, infección posquimioterapia.
Introducción
La sepsis es considerada una de las principales causas de morbilidad intrahospitalaria y su tratamiento eficaz depende de un diagnóstico oportuno. El diagnóstico de epsis basado solo en signos y síntomas se ha reemplazado por el uso de herramientas diagnosticas que sirvan como marcadores de infección temprana como la PCT(1, 2), y el uso de parámetros en el hemograma automatizado como los GI (3, 4) y la FPI (5, 6) que se considera un examen de rutina e informan al clínico de una infección temprana en pacientes sin síntomas e independiente del conteo de leucocitos, incluso antes de un hemocultivo positivo (7).
La PCT, es una prohormona precursora de la calcitonina, en condiciones normales es sintetizada por las células C de la tiroides, sin embargo en infecciones severas puede sintetizarse en tejidos extratiroideos. Durante el proceso infeccioso, se induce la liberación de procalcitonina, planteándose su función en la regulación del óxido nítrico como causante de la hipotensión en el proceso séptico(2, 8).
Varios estudios, han sugerido la PCT para el diagnóstico de sepsis, proponiendo intervalos biológicos de referencia que permiten evaluar la severidad de la infección. Según estudios realizados en varios hospitales de Badalona y Málaga en España, Kuroda y colaboradores encontraron que valores menores de 0,5 ng/mL corresponden a individuos sanos o infecciones víricas; entre 0,5 y 2 ng/mL a infecciones bacterianas localizadas, entre 2 y 10 ng/mL es probable el diagnóstico de sepsis y mayores a 10 ng/mL sepsis severa o shock séptico (2). No obstante, aunque la evaluación del parámetro permite predecir un proceso séptico, el hecho de que se limite a infecciones bacterianas, hace necesario investigar nuevas alternativas para el diagnóstico oportuno y de rutina en la evolución de la sepsis.(9)
Así mismo el conteo de los GI se ha convertido en un parámetro importante para el diagnóstico de infección y el seguimiento del paciente leucopénico por quimioterapia (10). En pacientes normales, se considera casi indetectable entre el 1 y 2% GI relativo, el equipo automatizado hace una búsqueda aproximada de 10.000 celulas comparado con un recuento manual de 100 a 200 celulas, la citometría de flujo combinada con métodos de tinción para los ácidos nucléicos detectando las celulas con mayor cantidad de éste, que equivalen a celulas GI (3, 11, 12)(promielocitos, metamielocitos y mielocitos neutrofilos), haciendo diferencia entre los estadios de maduración mieloide siendo capaz de precisar un número de células en absoluto y relativo.
En estudios relacionados con la medición de GI realizados en equipos como el utilizado en esta investigación, demostró una sensibilidad del 92%, una especificidad del 81% y una eficiencia del 83%(3). Así mismo algunos estudios proponen intervalos biológico de referencia de 0.03×103/dL como valor absoluto y 0.0 a 0.4% para el valor relativo.(12)
De otra parte, la plaqueta inmadura o plaqueta reticulada (PR) es un nuevo parámetro incorporado por la tecnología laser y medición por fluorescencia, capaz de teñir el ácido ribonucleico (ARN) de las plaquetas inmaduras. Así mismo la FPI nos da la oportunidad de medir en forma indirecta la producción y estimulación de la MO a través de una producción acelerada de los megacariocitos, liberando plaquetas jóvenes con mayor contenido de ARN.(13). Un valor óptimo de FPI es entre 1% a 7% y los valores superiores a estos son relacionados con una producción temprana de plaquetas en la MO,(14, 15) esta información ayuda al manejo del paciente como un marcador inminente de la recuperación plaquetaria, sea por respuesta a una infección, inflamación o un estímulo medular. La FPI es usada comoparámetro de respuesta a infecciones bacterianas en pacientes con neutrofília, igualmente muestra una correlación estadísticamente significativa en pacientes con hemocultivos positivos (5, 16), del mismo modo este parámetro puede usarse rutinariamente en el laboratorio, en pacientes con neutrofília y sin ella, como una prueba de bajo costo en la detección de infección bacteriana temprana.
Estas razones indican que la PR se presenta aumentada en varias entidades no malignas que cursan con trombocitosis (17), cirrosis hepática (18) como en caso de inflamación, infección, observándose que se presentan más aumentadas durante la fase aguda de la enfermedad infecciosa, demostrando que este parámetro es útil para el seguimiento de infecciones agudas. (16, 19)
El objetivo de este estudio es evaluar la FPI, los GI, el CL en pacientes hospitalizados con sospecha de infección, que presenten concentraciones altas de PCT, comparados con los resultados del hemocultivo, con el fin de implementar parámetros de rutina como los GI y la FPI en el hemograma automatizado, como herramienta para predecir un proceso séptico en menor tiempo y costo.
Materiales y métodos
Obtención de la muestra y análisis
Se realizó un estudio descriptivo prospectivo de corte transversal, se estudiaron 52 pacientes hospitalizados en la IPS universitaria Clínica León XIII en el periodo comprendido entre marzo y diciembre del 2012, con diferentes diagnósticos, dentro de sus exámenes de laboratorio incluía la PCT realizada en suero con la metodología de electroquimioluminicecia procesada en el COBAS 6000,en sangre total con ETA, el hemograma con la tecnología de citometría de flujo y fluorescencia, en el Sysmex XE-2100 (ROCHE) y el hemocultivo realizado por método automatizado en el Versa –Trek, por medio de transducción de presión y presencia de gases. La recolección de la información se obtuvo a partir de una base de datos suministrada por el laboratorio clínico de dicha institución, por lo que no fue necesario requerir el consentimiento informado de los pacientes, según la resolución N°008430 de 1993 se considera una investigación sin riesgo, fue aprobado por el comité de ética de la SIU y de investigación de la institución.
Criterios de inclusión y exclusión
Se tuvieron en cuenta pacientes hospitalizados en la IPS Universitaria Clínica León XIII, con niveles de procalcitonina > 2 ng/mL. Se excluyeron pacientes con hipertiroidismo y a los cuales no se les hubiese ordenado alguno de los exámenes de interés (Hemograma, Hemocultivo).
Análisis estadístico
Para la descripción de las variables cualitativas, se calcularon frecuencias absolutas, frecuencias relativas e intervalos de confianza del 95%; para las variables cuantitativas se calcularon medidas de tendencia central, medidas de posición y medidas de dispersión; además se realizaron comparaciones entre el sexo, los grupos de estudio y el resultado de los hemocultivos con los análisis de laboratorio mediante las pruebas U de Mann Whitney o T-Student según la distribución de las variables. Finalmente, se exploró la correlación entre los niveles de procalcitonina y las variables hematológicas mediante la prueba Rho de Spearman. El supuesto de normalidad se evaluó a través de la prueba de Shapiro Wilk. En todos los análisis se tomó un nivel de significación estadística de 0,05. La información fue almacenada en una base de datos en el software SPSS versión 18.0.
Resultados
En los sujetos de estudio el 59,6% fueron hombres, la edad promedio fue de 53 años con un rango entre 16 y 86 años, la enfermedad de base más frecuente fue pacientes en tratamiento de quimioterapia (QT) con el 44,2%, seguida de las infecciones con el 23,1%. Los pacientes que presentaron hemocultivos positivos fueron de un 23,1%. (datos no mostrados en tabla).
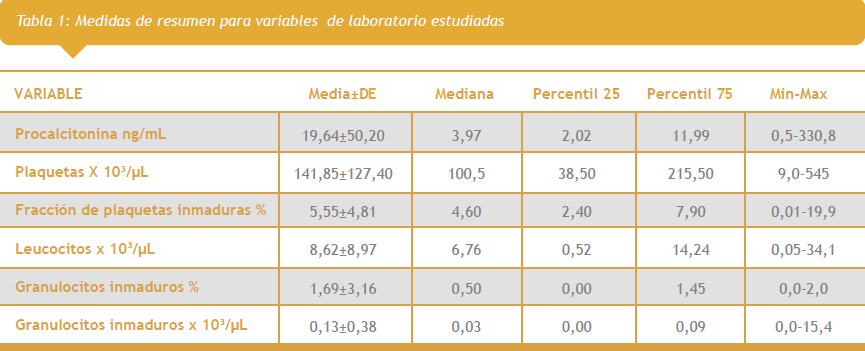
En las pruebas de laboratorio, los valores promedio para PCT fueron de 19,6 ng/mL y el 50% de los valores centrales estuvo entre 2,02 ng/mL y 11,99 ng/mL; para el CP plaquetas el recuento promedio fue de 141,8 x 103/uL con valores que oscilaron entre 9 x 103/uL y 545 x 103/uL; por su parte, el 50% de los valores centrales de la FPI estuvo entre 2,4% y 7,9%; el CL arrojó valores entre 0,05 x 103/uL y 34,1 x 103/uL con un promedio de 8,62 x 103/uL; en referencia al promedio del valor relativo de GI fue de 1,69%; finalmente el recuento absoluto de GI estuvo entre 0,0 y 15,4 con un promedio de 0,13 (Tabla 1 ver primer imagen a la derecha).
Análisis bivariado
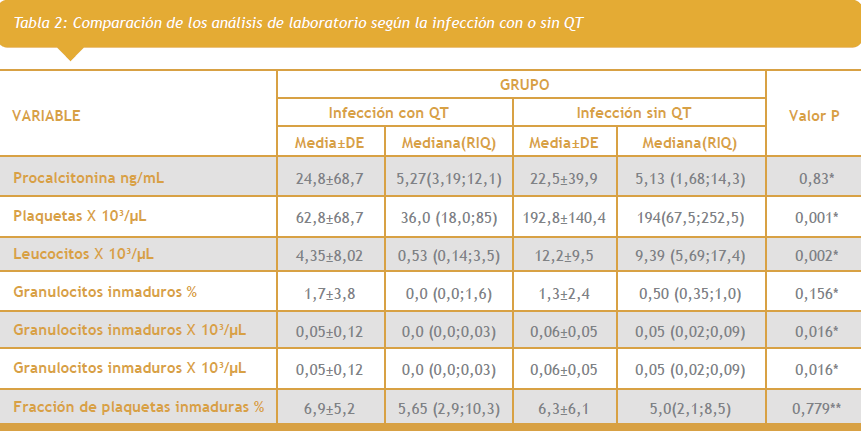
Con el objetivo de identificar diferencias entre los valores de laboratorio según el sexo se realizó la prueba U de Mann Whiney. A partir de los hallazgos de esta prueba se concluyó que no hay diferencias significativas entre el sexo y los análisis de laboratorio (datos no presentados en tabla). El conteo de las plaquetas, los leucocitos y el recuento absoluto de granulocitos inmaduros presentaron diferencias estadísticamente significativas entre quienes tenían quimioterapia e infecciones sin QT, con valores significativamente mayores entre quienes tenían infecciones sin QT. La prueba T-student no evidenció asociación con la fracción de plaquetas inmaduras entre quienes presentaron infección con QT ni en quienes tenían infección sin QT (Tabla 2).
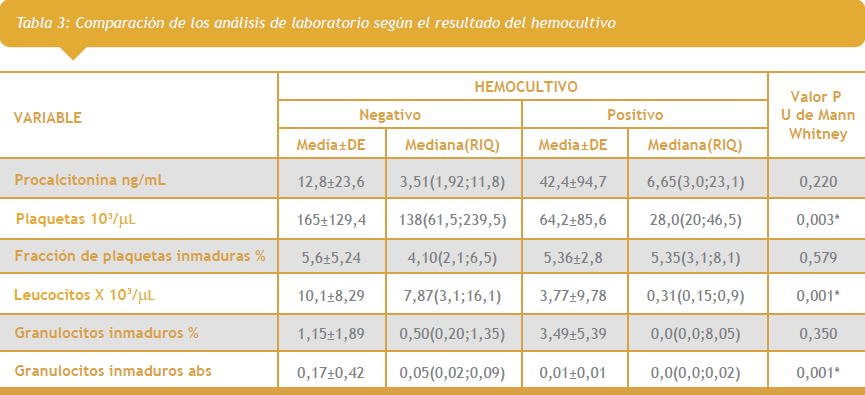
Con el objetivo de comparar las pruebas de laboratorio según el resultado de los hemocultivos se realizó la prueba U de Mann Whitney. Se encontró asociación entre los niveles de plaquetas, leucocitos y el recuento absoluto de granulocitos inmaduros, siendo significativamente menores entre quienes tuvieron hemocultivos positivos (Tabla 3 ver segunda imagen a la derecha).
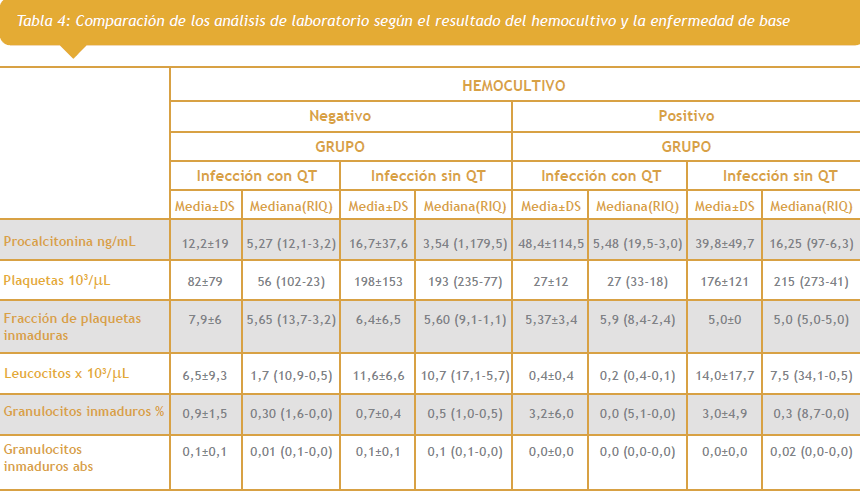
Con respecto a los hemocultivos se observa que 12 de los pacientes presentaron hemocultivos positivos, de los cuales el 66,7% tenía como enfermedad de base neoplasias y eran pacientes en o posquimioterapia y el 25% infecciones sin QT (datos no mostrados en tabla). Así mismo se comparan los análisis de laboratorio según el resultado del hemocultivo y la enfermedad de base con o sin QT, con estos datos se pone en evidencia que la mitad de las personas que tenían hemocultivo positivo y eran pacientes en o posquimioterapia presentaron valores de FPI de 5,9 o más, GI% inferiores a 1 y GI absolutos inferiores a 1 x 103/uL. Con respecto a los valores de PCT, el 50% de las datos centrales estuvo entre 3 y 19,5 ng/mL, El CP entre 18 y 33 x 103/uL y el CL entre 0,1 y 0,4 x 103/uL (Tabla 4). Al comparar el valor de leucocitos de las personas con quimioterapia y con hemocultivo negativo se observa que estos presentaron valores de mediana y rango intercuartil superior a quienes tenían hemocultivo positivo, indicando que los datos pueden estar disminuidos por los conteos tan bajos en estos pacientes.
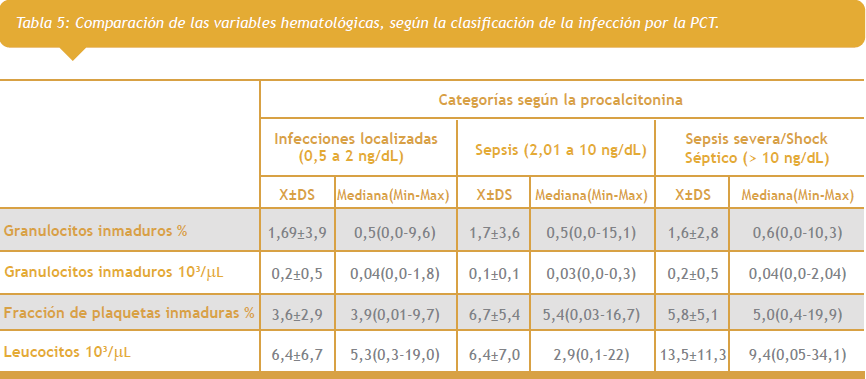
Según los rangos de la PCT se puede clasificar la infección como localizada, sepsis y sepsis severa/shock séptico con valores de 0.5 a 2, 2.01 a 10, y >10 ng/dL respectivamente encontramos la población estudiada que el 25% de los pacientes presentaron infecciones localizadas, el 44% sepsis y el 31% sepsis severa o shock séptico. Así mismo se encontró como resultado más relevante, que la mitad de las personas que tenían infecciones localizadas presentaron valores de FPI de 3,9 x 103/uL o menos y leucocitos de 5,3 x 103/uL o menos. Al analizar los pacientes con sepsis severa se observa un aumento en la mediana para la FPI y los leucocitos con valores de 5,0 x 103/uL y 9,4 x 103/uL respectivamente. (Tabla 5 ver tercer imagen a la derecha).
Análisis
La PCT como marcador predictor de infección en pacientes con leucocitosis y en pacientes con tratamientos de QT es de gran utilidad diagnóstica preventiva en el paciente hospitalizado, en este estudio se encontró concentraciones de PCT, desde 0.5 y 330 ng/dL, (Tabla 1) lo que se puede explicase por el estado de infección de los pacientes (Tabla 6) donde se observó que el 44% de los pacientes estaban en sepsis y el 31% en sepsis severa. Como se ha citado en la literatura estas infecciones son producidas por agentes bacterianos lo que hace gran diferencia de la PCT con otros marcadores de infección como la proteína C reactiva (PCR) que es reactante de fase aguda y como diferencial entre infección viral y bacteriana (20, 21), se encontró que solo el 23% de los pacientes presentaron hemocultivo positivo a pesar de la PCT alta, lo que indicaba infección localizada, teniendo en cuenta que el 44% de los pacientes eran inmunocomprometidos por la leucopenia severa y su estado de quimioterapia. (22)
Para lograr el objetivo de esta investigación, nos basamos en el desarrollo de los siguientes objetivos específicos:
Para el primer objetivo: Describir cual es la expresión de las plaquetas reticuladas (PR) por medio de la FPI, en los pacientes de la población estudiada. Encontramos que el valor de FPI en los grupos de pacientes con QT y sin QT, se encontraban entre 6.9% y 6.3 respectivamente (Tabla 2), para evaluar este dato tenemos que hacer referencia de la importancia que tiene la FPI en la evaluación de la producción medular, su presencia indica producción temprana de plaquetas, aunque el conteo total de plaquetas como sucede en el paciente con QT sea mínimo, lo que apreciamos en el estudio con conteos de plaquetas bajos en los pacientes con quimioterapia desde 9 x 103/uL (Tabla 1) siendo significativamente estadístico la diferencia entre los dos grupos de estudio con una p: 0.001 (Tabla 2), así mismo no se vio una significancia estadística con la PCT en cuanto a los grupos de infección (Tabla 3) ni entre la presencia de hemocultivo positivo (Tabla 4). Sin embargo se observa diferencias de la FPI en los pacientes según el grado de infección dependiendo de la concentración de PCT, los que tenían mayor de 2 ng/dL de PCT fue más salta la FPI, con respecto al grupo de infección localizada (Tabla 5). El respaldo de numerosos estudios indican que la presencia RNA en la plaqueta joven identifica la producción de estas plaquetas reticuladas(5, 6) por medio de tecnología de fluorescencia en pacientes posquimioterapia indicando producción medular (15, 23), igualmente para el manejo de la trasfusión(24), en el paciente vascular (25, 26) y principalmente en el paciente séptico con o sin QT (27, 28), es de anotar que en los pacientes con trombocitopenia con quimioterapia es importante resaltar que el valor del intervalo de referencia difiere del intervalo de referencia de los pacientes con plaquetas normales, cambiando su interpretación. En un estudio realizado por Jung H y colaboradores encontraron que el intervalo de referencia en pacientes con trombocitopenia sea periférica o central oscilaba entre 0.5 a 3.2% en hombres y 0.4 a 3% en mujeres,(28) rangos que difieren de pacientes con CP normales de 0.5 a 7 (29, 30) lo que indica que la interpretación de los resultados es muy significativa ya que superan la cifra de referencia en pacientes trombocitopénicos como se presentó en éste estudio en los pacientes con quimioterapia donde la media de la FPI es de 6.9 % (Tabla 2).
El segundo objetivo: Describir cual es el índice de GI en pacientes con infección que presentan PCT elevada. Para este objetivo tenemos que hacer referencia que la media del CL en la población general fue de 8.62 X 103/uL (Tabla 1), teniendo en cuenta que el grupo de pacientes que recibían quimioterapia presentaron CL muy bajos, con una media de 0.53 X 103 /uL con un RIQ = 0.14 a 3.5 X 103/uL (Tabla 2) siendo estadísticamente significativa esta diferencia entre los dos grupos de estudio con una p: 0.002. Teniendo en cuenta lo anterior correlacionamos este CL con la PCT y vemos que no es estadísticamente significativa la diferencia en cuanto al valor de la PCT, en la que encontramos una cifra de PCT muy similar en los grupos de estudio 24.8 y 22.5 ng/dL en pacientes con QT y sin ella respectivamente (Tabla 2) indicando que el aumento de leucocitos no es un parámetro predictor de sepsis e infección.
Así mismo se evalúo el valor absoluto y relativo de los GI parámetro reconocido en varios estudios como indicador de sepsis (12, 31) comparándolo con otros marcadores de sepsis temprana como la PCT y la PCR, siendo los GI un parámetro que está en una prueba de rutina como es el hemoleucograma automatizado de fácil acceso y bajo costo. Teniendo en cuenta un valor de referencia de GI de 0.1 a 0.4% en pacientes con leucocitos normales, los datos obtenidos en pacientes con quimioterapia rescatan la importancia de este valor predictivo de infección ya que la tecnología permite hacer recuentos en más de 10.000 células lo que para la lectura manual sería difícil en pacientes leucopénicos encontrando diferencias significativas. Los resultados nos indican que la presencia de GI está aumentada y es proporcional al aumento de la PCT en pacientes con hemocultivos negativos con una media de 0.9% de GI y con 12.2 ng/dL de PCT que tenían quimioterapia con cifras similares en los de infección sin QT comparados con el grupo de hemocultivos positivos que presentaron cifras mayores tanto de PCT como de GI en pacientes con y sin quimioterapia con una media de 3.2% de GI y 48.4 ng/dL de PCT. (Tabla 4), lo que no se puede evidenciar al hacer la diferenciación por grados de infección según la concentración de PCT con el total de la población (Tabla 5), donde el valor de los GI no generan una diferencia significativa como si lo hace la PCT (8), en el estudio de Karlsson (32) y colaboradores se evaluaron los niveles de PCT según el grado de infección encontraron como los niveles más altos en los pacientes con sepsis severa y shock séptico a pesar del hemocultivo en algunas ocasiones negativo.
Así mismo Roerhl y colaboradores realizaron un estudio en 2400 pacientes para determinar los valores de GI según la edad y los estados patológicos, encontrando que por encima de 0.3% y 0.04 x103/uL de GI relativo y absoluto respectivamente, se considera aumentados con presencia de celulas de maduración intermedia mieloide como posible respuesta a un agente infeccioso, como un probable predictor de infección, dentro de las infecciones más comunes fueron otitis, infecciones respiratorias, gastroenteritis, en menores de 10 años y en mayores de 10 años infecciones severas en enfermedades malignas hematológicas, en quimioterapias, pacientes embarazadas entre otras. Anotando finalmente que la interpretación adecuada de los rangos de referencia de los GI en el hemograma automatizado, es una poderosa herramienta en el diagnostico diferencial de sepsis.(33)
El tercer objetivo: Correlacionar los valores séricos de PCT con los resultados de las FPI y el GI en la población de estudio
Para este objetivo usamos la información de la PCT en las diferentes categorías de infección (Tabla 5), donde confirmamos que a más valor de PCT mayor gravedad de la infección, encontrando los valores de GI aumentados sin una diferencia en cada uno de los estadíos tanto en relativo como en absoluto, sin embargo en la FPI se puede observar un aumento a medida que se aumenta el grado de infección, teniendo en cuenta que en este análisis no se presentó separación por grupo de estudio, con y sin quimioterapia por lo que respecta a la interpretación por el conteo de leucocitos (6).
Con todo lo anterior comparamos los 3 parámetros en pacientes con y sin quimioterapia con respecto al hemocultivo positivo (Tabla 4) donde observamos que la media de PCT, FPI y los GI% fueron significativamente mayor que la presentada en los pacientes con hemocultivo negativo tanto con o sin quimioterapia con cifras de 48.4 ng/dL, 5.37%, y 3.2% respectivamente, no así las cifras de CP, CL, GI absolutos que permanecieron bajas, resultado que se justifica por la disminución tan severa en los conteos absolutos de la mayoría de los pacientes con hemocultivo positivo y con quimioterapia.
Conclusión
La PCT sigue siendo uno de los mejores marcadores de sepsis temprana. Con la nueva tecnología de detección por fluorescencia de la inmadurez de las plaquetas y la interpretación de la FPI, y con la clasificación del nuevo parámetro en el diferencial de los leucocitos con alta sensibilidad, los GI, presentamos estos dos parámetros como marcadores tempranos de la infección en diferentes patologías hematológicas y no hematológicas, que se obtienen con un resultado de rutina como es el hemoleucograma automatizado, generando mayor oportunidad para el diagnóstico precoz de la sepsis y menores costos.
En esta investigación resaltamos la importancia de estos parámetros en pacientes con quimioterapia y más en el manejo de pacientes hematológicos como en esta población estudiada donde aplicamos la importancia de la FPI como renovación medular, e igualmente en la evaluación en conjunto con la PCT y los GI en el diagnostico diferencial de sepsis, independiente del CL.
Los valores de referencia tanto de los GI como de la FPI deben manejarse dependiendo del caso clínico y el estado del paciente para una mejor interpretación y el manejo del diagnóstico diferencial, como es en el paciente leucopénico.
Es de resaltar que la comunidad médica, los clínicos, que son los que reciben los resultados del laboratorio se actualicen en los nuevos parámetros que ofrece la tecnología para un mejor aprovechamiento de estos recursos.
Referencias Bibliográficas
1. Shima H, Inaba M. [Calcitonin (CT), procalcitonin (PCT)]. Nippon Rinsho. 2010;68 Suppl 7:325-7.
2. Kuroda S. [Clinical usefulness of procalcitonin measurement]. Kansenshogaku Zasshi. 2010;84(4):437-40.
3. Senthilnayagam B, Kumar T, Sukumaran J, M J, Rao K R. Automated measurement of immature granulocytes: performance characteristics and utility in routine clinical practice. Patholog Res Int. 2012;2012:483670.
4. Nahm CH, Choi JW, Lee J. Delta neutrophil index in automated immature granulocyte counts for assessing disease severity of patients with sepsis. Ann Clin Lab Sci. 2008;38(3):241-6.
5. Di Mario A, Garzia M, Leone F, Arcangeli A, Pagano L, Zini G. Immature platelet fraction (IPF) in hospitalized patients with neutrophilia and suspected bacterial infection. J Infect. 2009;59(3):201-6.
6. De Blasi RA, Cardelli P, Costante A, Sandri M, Mercieri M, Arcioni R. Immature platelet fraction in predicting sepsis in critically ill patients. Intensive Care Med. 2013;39(4):636-43.
7. Yamaoka G, Kubota Y, Nomura T, Inage T, Arai T, Kitanaka A, et al. The immature platelet fraction is a useful marker for predicting the timing of platelet recovery in patients with cancer after chemotherapy and hematopoietic stem cell transplantation. Int J Lab Hematol. 2010;32(6 Pt 1):e208-16.
8. Takajo I, Okayama A. [Diagnosis of bacterial infection using procalcitonin]. Rinsho Byori. 2010;58(5):517-22.
9. Beloborodova NV, Vostrikova TIu, Chernevskaia EA. [Etiology of postoperative bacteremias in an intensive care unit: an association with the level of procalcitonin]. Anesteziol Reanimatol. 2008(4):22-7.
10. Nierhaus A, Klatte S, Linssen J, Eismann NM, Wichmann D, Hedke J, et al. Revisiting the white blood cell count: immature granulocytes count as a diagnostic marker to discriminate between SIRS and sepsis–a prospective, observational study. BMC Immunol. 2013;14:8.
11. Fujimoto H, Sakata T, Hamaguchi Y, Shiga S, Tohyama K, Ichiyama S, et al. Flow cytometric method for enumeration and classification of reactive immature granulocyte populations. Cytometry. 2000;42(6):371-8.
12. Briggs C, Kunka S, Fujimoto H, Hamaguchi Y, Davis BH, Machin SJ. Evaluation of immature granulocyte counts by the XE-IG master: upgraded software for the XE-2100 automated hematology analyzer. Lab Hematol. 2003;9(3):117-24.
13. Michelson AD. Platelets. segunda ed. USA: Elsevier; 2007. p. 446-84.
14. Briggs C, Harrison P, Grant D, Staves J, MacHin SJ. New quantitative parameters on a recently introduced automated blood cell counter–the XE 2100. Clin Lab Haematol. 2000;22(6):345-50.
15. Cannavo I, Ferrero-Vacher C, Sudaka I, Aquaronne D, Berthier F, Raynaud S. [Assessment of an immature platelet fraction (IFP%) in the diagnosis of thrombocytopenia]. Ann Biol Clin (Paris). 2010;68(4):415-20.
16. Cox D, Kerrigan SW, Watson SP. Platelets and the innate immune system: Mechanisms of bacterial-induced platelet activation. J Thromb Haemost. 2011.
17. Guthikonda S, Alviar C, Vaduganathan M, Arikan M, Tellez A, DeLao T, et al. Role of reticulated platelets and platelet size heterogeneity on platelet activity after dual antiplatelet therapy with aspirin and clopidogrel in patients with stable coronary artery disease. J Am Coll Cardiol. 2008;52(9):743-9.
18. Kim H, Park B, Lee M, Park A, Ahn J. [Comparison of an immature platelet fraction and reticulated platelet in liver cirrhosis]. Korean J Lab Med. 2007;27(1):7-12.
19. Paula Neto HA, Kubes P. Platelets, endothelium and shear join forces to mislead neutrophils in sepsis. Crit Care. 2011;15(1):103.
20. [Prognostic significance of test with procalcitonin in diagnosis of endogenous intoxication severity in extended purulent peritonitis]. Klin Khir. 2011(4):31-4.
21. Alkholi UM, Abd Al-Monem N, Abd El-Azim AA, Sultan MH. Serum procalcitonin in viral and bacterial meningitis. J Glob Infect Dis. 2011;3(1):14-8.
22. al-Nawas B, Shah PM. Procalcitonin in patients with and without immunosuppression and sepsis. Infection. 1996;24(6):434-6.
23. Gonçalo AP, Barbosa IL, Campilho F, Campos A, Mendes C. Predictive value of immature reticulocyte and platelet fractions in hematopoietic recovery of allograft patients. Transplant Proc. 2011;43(1):241-3.
24. Bat T, Leitman SF, Calvo KR, Chauvet D, Dunbar CE. Measurement of the absolute immature platelet number reflects marrow production and is not impacted by platelet transfusion. Transfusion. 2012.
25. Cesari F, Marcucci R, Gori AM, Caporale R, Fanelli A, Casola G, et al. Reticulated platelets predict cardiovascular death in acute coronary syndrome patients. Insights from the AMI-Florence 2 Study. Thromb Haemost. 2013;109(5):846-53.
26. Grove E, Hvas A, Kristensen S. Immature platelets in patients with acute coronary syndromes. Thromb Haemost. 2009;101(1):151-6.
27. Have LW, Hasle H, Vestergaard EM, Kjaersgaard M. Absolute immature platelet count may predict imminent platelet recovery in thrombocytopenic children following chemotherapy. Pediatr Blood Cancer. 2013.
28. Jung H, Jeon HK, Kim HJ, Kim SH. Immature platelet fraction: establishment of a reference interval and diagnostic measure for thrombocytopenia. Korean J Lab Med. 2010;30(5):451-9.
2 9. Ko YJ, Kim H, Hur M, Choi SG, Moon HW, Yun YM, et al. Establishment of reference interval for immature platelet fraction. Int J Lab Hematol. 2013.
30. Pons I, Monteagudo M, Lucchetti G, Muñoz L, Perea G, Colomina I, et al. Correlation between immature platelet fraction and reticulated platelets. Usefulness in the etiology diagnosis of thrombocytopenia. Eur J Haematol. 2010;85(2):158-63.
31. Bernstein LH, Rucinski J. Measurement of granulocyte maturation may improve the early diagnosis of the septic state. Clin Chem Lab Med. 2011;49(12):2089-95.
32. Karlsson S, Heikkinen M, Pettilä V, Alila S, Väisänen S, Pulkki K, et al. Predictive value of procalcitonin decrease in patients with severe sepsis: a prospective observational study. Crit Care. 2010;14(6):R205.
33. Roehrl MH, Lantz D, Sylvester C, Wang JY. Age-dependent reference ranges for automated assessment of immature granulocytes and clinical significance in an outpatient setting. Arch Pathol Lab Med. 2011;135(4):471-7.
Agradecimientos: A la compañía ROCHE como patrocinadores de las pruebas hematológicas. A la Clínica León XIII IPS Universidad de Antioquia.






