
Faringitis por Estreptococos de los Grupos C y G: se tratan o no se tratan
Dres. H. Lopardo1, S. Ruvinsky2 , R. Bologna3
1 Consultor del Servicio de Microbiología, Profesor Consulto de la Cátedra de Microbiología Clínica, Carrera de Bioquímica, Facultad de Ciencias
Exactas, Universidad Nacional de La Plata.
2 Infectóloga. Servicio de Epidemiología e Infectología.
3 Jefa del Servicio de Epidemiología e Infectología. Hospital de Pediatría Juan P. Garrahan.
http://www.medicinainfantil.org.ar
Introducción
Los estreptococos han sido clasificados por Rebecca Lancefield en grupos que van desde la A hasta la V en base a la presencia de los correspondientes carbohidratos antigénicos de la pared celular1. Solamente los estreptococos de los grupos A, B, C, F y G presentan hemólisis beta en agar sangre ovina. En faringitis los más frecuentes son los de grupo A que en casi su totalidad pertenecen a la especie Streptococcus pyogenes. Solo algunas pocas cepas de otras especies pueden aglutinar con el antisuero A. Los de grupo B (Streptococcus agalactiae) no han sido reconocidos como agentes de faringitis.
Los estreptococos del grupo C pertenecen a varias especies y subespecies (Tabla 1). Streptococcus dysgalactiae subsp equisimilis es la más frecuente de estos estreptocos C en infecciones humanas. Esta especie también puede presentar carbohidratos de grupo G o más raramente de grupo A o L. Dentro del grupo C también encontramos especies y subespecies de origen animal algunas de las cuales, eventualmente pueden producir infecciones en humanos: Streptococcus dysgalactiae subsp. dysgalactiae, Streptococcus equi subsp. Equi y Streptococcus equi subsp. zooepidemicus. Streptococcus canis, es otra especie que puede aglutinar con antisueros G y se la ha aislado principalmente de piel y mucosas de perros y bovinos, aunque también de gatos, ratas, arminios, conejos y zorros. En estos animales puede producir también infecciones de todo tipo, incluso síndrome de shock tóxico y fascitis necrotizante. En humanos las infecciones por S. canis son raras aunque seguramente subestimadas por no efectuarse en todos los casos la identificación en forma completa2 (Tabla 1).
Tabla 1. Especies y subespecies de estreptococos Beta-Hemolíticos.
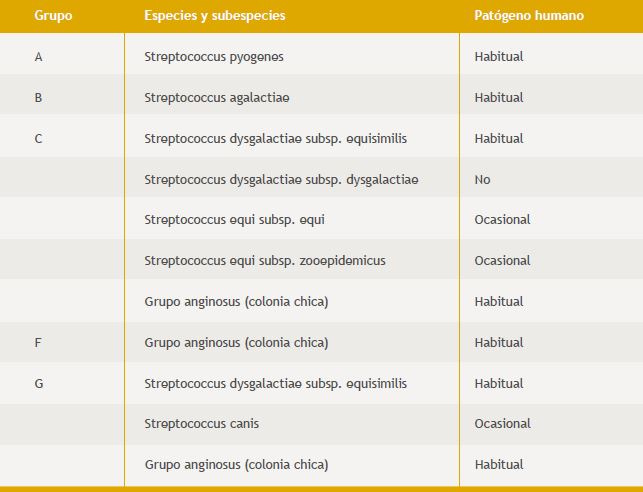
Hay otras bacterias que en realidad pertenecen al grupo viridans de estreptococos, pero que en algunos casos pueden dar hemólisis beta. Pertenecen al grupo anginosus, normalmente presentan el antígeno F o no son serotipificables, pero hay cepas que pueden dar reacciones serológicas cruzadas con los grupos C, G y hasta con el grupo A. No se ha establecido su relación con casos de faringitis excepto en un trabajo controvertido3 (Tabla 1).
La bacteria que vamos a considerar en este artículo es Streptococcus dysgalactiae subsp. Equisimilis portador habitual de los antígenos C o G.
Streptococcus dysgalactiae subsp. equisimilis
Desde su primera descripción en 1935, Rebecca Lancefield consideraba que los estreptococos de los grupos C y G no eran virulentos1.
Durante mucho tiempo se consideró que S. dysgalactiae subsp. equisimilis era un colonizante habitual de las vías aéreas superiores incapaz de producir episodios de faringitis. El estudio de brotes de faringitis tanto en adultos como en niños fue revirtiendo este concepto4,5,6.
Su frecuencia en casos de faringitis atribuidas 10-15%, es decir, menos de 5% del total de casos de faringitis. Se ha observado que la faringitis por grupo C aumentaba los títulos de antiestreptolisina O, podía producir glomerulonefritis posestreptocócica y generar complicaciones supurativas7,8. Hay trabajos que reconocen la similitud de los síntomas y signos clínicos de las faringitis por estreptococos de los grupos A, C y G9. No obstante, las guías de 2012 de la Infectious Diseases Society of America recomiendan efectuar el tratamiento sólo de las faringitis producidas por S. pyogenes (grupo A)10.
El rol de los estreptococos de los grupos C y G como agentes etiológicos de faringitis fue claramente establecido tanto en niños11,12,13 como en adultos7,14,15,16. De hecho, estos estreptococos han sido descritos como agentes de escarlatina17, shock tóxico estreptocócico posterior a faringitis18, faringitis recurrente19,20 y de brotes familiares5 o de origen alimentario21. También se los ha caracterizado como generadores de complicaciones supurativas, algunas de ellas graves22 y de secuelas no supurativas como la artritis reactiva23,24 y la glomerulonefritis25.
En 2012 se publicaron la guía sobre manejo de la faringitis aguda de la Sociedad Europea de Microbiología Clínica y Enfermedades Infecciosas (ESCMID)26, la guía para el diagnóstico y manejo de la faringitis estreptocócica de la Sociedad Americana de Enfermedades Infecciosas (IDSA)10 y los resultados del Consenso Intersociedades sobre Diagnóstico y Tratamiento de Infecciones de las Vías Respiratorias Altas (Sociedad Argentina de Infectología –SADI, Sociedad Argentina de Pediatría –SAP, Sociedad Argentina de Medicina –SAM y Sociedad Argentina de Bacteriología, Micología y Parasitología Clínicas -SADEBAC)27. En estas tres guías, donde se discute el tratamiento de la faringitis estreptocócica, queda poco clara la actitud que un pediatra o un médico de adultos debe adoptar ante un caso de un paciente sintomático al que se le aísle de sus fauces un estreptococo del grupo C o del grupo G.
En el consenso argentino sólo se menciona que los estreptococos del grupo C (GCS) o del grupo G (GGS) pueden estar asociados en un 4,3% a cuadros de faringitis aguda y se los incluyó dentro de otras causas bacterianas de faringitis. Sin embargo no incluyen recomendaciones específicas para estos casos27. En una reciente carta a la revista Medicina se expuso en forma resumida este problema28.
En la guía europea se reconoce el rol de los GCS y GGS en faringitis y se cita sólo a un estudio caso-control y un estudio de cohortes que determinaron que los síntomas eran más leves que los de la faringitis por estreptococos del grupo A (GAS), mientras que cinco estudios observacionales (tres de cohortes y dos caso-control) no encontraron diferencias en los cuadros clínicos5,7,9,29,30,31,32. Se mencionaron además 12 estudios originales (la mayoría reportes de casos o series de casos) que describieron síntomas o complicaciones graves posteriores a faringitis agudas por GCS y GGS17,19,20,33,34,35,36
También se refirieron a casos de faringitis recurrente por GCS y un estudio caso-control en estudiantes de un colegio en el que se determinó que GCS se aislaba más frecuentemente de los casos que de los controles35. Sin embargo, destacaban que había poca evidencia que relacionara a los GGS con faringitis severa o recurrente.
También mencionaron que se habían descrito complicaciones de las faringitis por GGS o GCS tales como artritis reactiva, empiema subdural y glomerulonefritis aguda, pero que no se había establecido claramente su relación causal18,22,24,37. Asimismo admitieron que en 1997, en Inglaterra, se reportaron casos de septicemia por GCS y GGS, algunos de ellos como complicaciones de faringitis15. Si bien no se ha constatado el desarrollo de fiebre reumática posterior a faringitis por GCS o GGS hay estudios y opiniones de expertos que sugieren que estos microorganismos podrían contribuir a desencadenar esta complicación en sitios de alta incidencia de fiebre reumática38,39.
A pesar de todo esto y por una sobrevaloración de los métodos rápidos de diagnóstico que no incluyen la detección de antígenos de los grupos C ni G, la guía europea se basó en la combinación de estos métodos para indicar tratamiento antibiótico, previa evaluación de los pacientes (niños o adultos) a través de los criterios clínicos de Centor. Incluso no recomiendan efectuar cultivo de control para los casos en que el método rápido resulte negativo (Tabla 2)26,40,41. De esta manera, las faringitis por GCS y GGS quedarían sin ser tratadas, excepto en los casos muy graves donde el médico administraría antibióticos sin necesidad de efectuar la prueba rápida.
Tabla 2. Criterios clínicos de centor modificados por mcisaac et al. y sus respectivos puntajes para lograr el score.
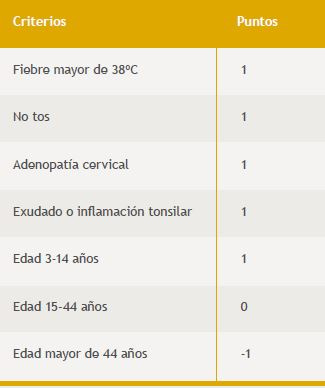
En cierta coincidencia con esta postura, el consenso argentino recomienda aplicar los criterios de Centor. Si se obtiene un puntaje de 0 a 1 no tratar, de 2 a 3 realizar pruebas rápidas y tratar a los positivos (sin control por cultivo de los negativos), y si es de 4 o 5 se puede optar por realizar pruebas rápidas o directamente tratar a todos27. De esta forma también las infecciones por GCS o GGS quedarían ignoradas excepto las que induzcan a producir signos y síntomas clasificados como 4 o 5 según los criterios de Centor y el médico opte por no realizar alguna prueba rápida.
La guía de la IDSA considera al cultivo como pilar fundamental del diagnóstico y para la evaluación clínica utiliza un índice de sospecha diferente al de Centor10 (Tabla 3). Según esta guía el tratamiento debería basarse en estudios microbiológicos (pruebas rápidas y cultivo) porque los signos y síntomas de las faringitis estreptocócica y viral se superponen y la capacidad para identificar la faringitis estreptocócica sólo con bases clínicas generalmente es pobre, excepto cuando hay evidencia concreta de que se trata de una faringitis viral40,42,43,44,45.
Tabla 3. Signos y síntomas que según la guía de la IDSA contribuyen a sospechar o descartar una faringitis estreptococica.
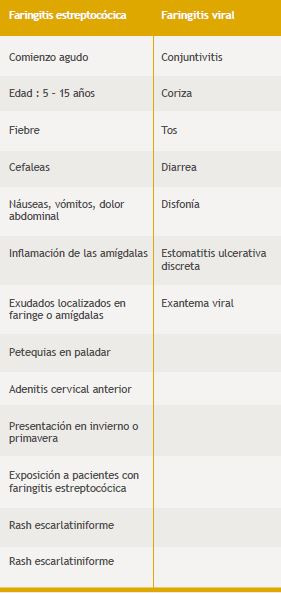
En esta guía se dice que los scores son útiles para reconocer pacientes con bajo riesgo de padecer una faringitis estreptocócica, los que pueden quedar sin diagnóstico microbiológico y obviamente sin tratamiento antibiótico. Sin embargo, personas con máximos valores en los scores tienen sólo entre un 35 y un 50% de probabilidad de tener una faringitis estreptocócica y esto se da especialmente en niños44,46. Por ello recomiendan efectuar una prueba rápida, con cultivo de control en los casos negativos ya que es altamente específica pero habitualmente tiene una sensibilidad menor del 90%, en especial en niños y adolescentes. Además esa sensibilidad es variable según el método y el equipo que se utilice47,48,49. Hay pruebas rápidas con mayor sensibilidad pero son lentas (1h 30 min – 2 h), costosas o dependientes de ciertos equipos47.
En el caso de adultos, donde la incidencia de faringitis estreptocócica es baja y la fiebre reumática prácticamente nula, no recomiendan realizar cultivos de control posteriores a la prueba, pero sí para los niños y adolescentes.
¿Cuál es el objetivo de tratar un episodio de faringitis?
Tanto para el consenso argentino27 como para la guía de la IDSA10 el tratamiento antibiótico debe indicarse para:
- disminuir la duración y la intensidad de los síntomas,
- prevenir el desarrollo de fiebre reumática,
- prevenir complicaciones supurativas (otitis media, sinusitis, abscesos periamigdalinos o retrofaríngeos, linfadenitis cervical, mastoiditis y posiblemente otras infecciones), prevenir la transmisión a contactos cercanos (especialmente importante en niños) y permitir la reanudación rápida de las tareas habituales tanto a niños como a adultos.
Para la guía europea26 la prevención de fiebre reumática en personas de bajo riesgo (pacientes sin historia previa de fiebre reumática) o la prevención de complicaciones supurativas no son indicaciones específicas de tratamiento antibiótico de las faringitis.
Si para los tres documentos uno de los objetivos del tratamiento de las faringitis es disminuir la duración y la intensidad de los síntomas y para dos de ellos, otro de los objetivos es prevenir complicaciones supurativas, no se entiende por qué no deben tratarse las faringitis por GCS o GGS, que producen sintomatología similar a las del grupo A y complicacionessupurativas algunas de ellas graves22.
Conclusiones
Considerando que:
- La fiebre reumática es prevenible en más de un 60% de los casos en poblaciones de alto riesgo y estos estreptococos podrían inducirla50.
- La glomerulonefritis no parece ser prevenible por el tratamiento de la faringitis precedente, pero éste reduciría la circulación de cepas nefritogénicas y se han documentado casos y brotes de glomerulonefritis posteriores a faringitis por GGS o GCS.
- Se han documentado otros tipos de complicaciones supurativas y no supurativas posteriores a faringitis por estos estreptococos, que son prevenibles con el tratamiento antibiótico.
- Que sus factores de virulencia son muy similares a los de S. pyogenes.
- Que el costo y el impacto ecológico que implica el tratamiento antibiótico de las faringitis por Streptococcus dysgalactiae subsp. equisimilis no parece ser significativo.
- Que se puede facilitar la tarea de los laboratorios de bacteriología de menor complejidad y además acelerar el tiempo del informe si se considera en conjunto con S. pyogenes a todos los estreptococos beta-hemolíticos de colonia grande.
Y aceptando que, como se dice en la guía de la IDSA, que no hay suficientes estudios controlados de respuesta clínica a la antibioticoterapia en pacientes con faringitis aguda por GGS o GCS, consideramos que se podría incluir el tratamiento de los mismos como recomendación débil, en lugar de ausencia de indicación.
Referencias Bibliográficas
1. Lancefield RC, Hare R. The serological differentiation of pathogenic and non-pathogenic strains of hemolytic streptococci from parturient women. J Exp Med 1935; 61: 335-49.
2. Whatmore AM, Engler BKH, Gudmundsdottir G, et al.. Identification of isolates of Streptococcus canis infecting humans. J Clin Microbiol 2001; 39: 4196-9.
3. Whiley RA, Hall LM, Hardie JM, et al. A study of small-colony, betahemolytic, Lancefield group C streptococci within the anginosus group: description of Streptococcus constellatus subsp. pharyngis subsp. nov. associated with the human throat and pharyngitis. Int J Syst Bacteriol 1999; 49: 1443-9.
4. Benjamin JT, Perriello VA. Pharyngitis due to group C hemolytic streptococci in children Pediatrics 1976; 89; 254-6.
5. Gerber MA, Randolph MF, Martin NJ, et al. Community-wide outbreak of group G streptococcal pharyngitis. Pediatrics 1991;87:598–603
6. Turner JC, Hayden FG, Lobo MC, et al. Epidemiologic evidence for Lancefield group C beta-hemolytic streptococci as a cause of exudative pharyngitis in college students. J Clin Microbiol 1997; 35:1–4.
7. Meier FA, Centor RM, Graham L, et al. Clinical and microbiological evidence for endemic pharyngitis among adults due to group C streptococci. Arch Intern Med 1990; 150: 825-9
8. Gupta N, Lovvorn J, Centor RM. Peritonsilar abscess requiring intensive care unit admission caused by group C and G streptococcus: a case report. Cases J 2009; 2: 6808.
9. Lindbæk M, Høiby EA, Lermark G, et al. Clinical symptoms and streptococci groups C or G versus group A. Brit J Gen Pract 2005; 55: 615-9.
10. Shulman ST, Bisno AL, Clegg HW, et al. Clinical practice guideline for the diagnosis and management of group A streptococcal pharyngitis: 2012 update by the Infectious Diseases Society of America Clin Infect Dis 2012;55:e86–102.
11. Esposito, Benjamin, Turner JC, et al. Epidemiologic evidence for Lancefield group C beta-hemolytic streptococci as a cause of exudative pharyngitis in college students. J Clin Microbiol 1997; 35:1–4.
12. Cimolai N, Elford RW, Bryan L, et al. Do the betahemolytic nongroup A streptococci cause pharyngitis? Rev Infect Dis 1988; 10:587–601.
13. Zaoutis T, Attia M, Gross R, et al. The role of group C and group G streptococci in acute pharyngitis in children. Clin Microbiol Infect 2004; 10: 37–40.
14. Chowdhury MN, Kambal AM, al-Eissa YA, et al. Non-group A streptococci: are they pathogens in the throat? J R Soc Health 1997; 117: 160–3
15. Efstratiou A. Pyogenic streptococci of Lancefield groups C and G as pathogens in man. Soc Appl Bacteriol Symp Ser 1997; 26: 72S–79S.
16. Fox K, Turner J, Fox A. Role of beta-hemolytic group C streptococci in pharyngitis: incidence and biochemical characteristics of Streptococcus equisimilis and Streptococcus anginosus in patients and healthy controls. J Clin Microbiol 1993; 31: 804–7
17-Corson AP, Garagusi VF, Chretien JH, Group C Beta-hemolytic steptococci causing pharyngitis and scarlet fever. South Med J 1989; 82:1119–21.
18. Natoli S, Fimiani C, Faglieri N et al. Toxic shock syndrome due to group C streptococci. A case report. Intensive Care Med 1996; 22: 985–9.
19. Morgan MC, Rice LI. Recurrent group C streptococcal tonsillopharyngitis in an adolescent. J Adolesc Health Care. 1989; 10: 421–2.
20. Fulginiti VA, Ey JL, Ryan KJ. Recurrent group C streptococcal tonsillitis in an adolescent male requiring tonsillectomy. Clin Pediatr (Philad) 1980; 19: 829–30
21. Cohen D, Ferne M, Rouach T, et al. Food-borne outbreak of group G streptococcal sore throat in an Israeli military base. Epidemiol Infect. 1987;99:249-55.
22. Gettler JF, el-Sadr W. Group C streptococcal subdural empiema in a healthy man: possible complication of pharyngitis. Clin Infect Dis 1993; 16: 726–7.
23. Jansen TL, Janssen M, de Jong AJ. Reactive arthritis associated with group C and group G beta-hemolytic streptococci. J Rheumatol 1998; 25: 1126–30.
24. Young L, Deighton CM, Chuck AJ, et al. Reactive arthritis and group G streptococcal pharyngitis. Ann Rheum Dis 1992; 51:1268 25: 1126–30., y la glomerulonefritis.
25. Gnann JW Jr, Gray BM, Griffin FM Jr, et al. Acute glomerulonephritis following group G streptococcal infection. J Infect Dis. 1987 156:411-2
26. Pelucchi C, Grigoryan L, Galeone C, et al. Guideline for the management of acute sore throat. Clin Microbiol Infect 2012; 18 (Suppl. I): 1-27,
27. Lopardo G, Calmaggi A, Clara L, et al. Consenso Intersociedades sobre Diagnóstico y Tratamiento de Infecciones de las Vías Respiratorias Altas. Medicina (Buenos Aires) 2012; 72: 484-94.
28. Lopardo H. Faringitis por estreptococos de los grupos C y G (Carta de lectores). Medicina (Buenos Aires) 2013, 73:605-606.
29. Fretzayas A, Moustaki M, Kitsiou S, et al. The clinical pattern of group C streptococcal pharyngitis in children. J Infect Chemother 2009; 15: 228–32.
30. Zwart S, Ruijs GJ, Sachs AP, et al. Beta-haemolytic streptococci isolated from acute sore throat patients: cause or coincidence? A case–control study in general practice. Scand J Infect Dis 2000; 32: 377–84.
31. Dagnelie CF, Touw-Otten FW, Kuyvenhoven MM, et al. Bacterial flora in patients presenting with sore throat in Dutch general practice. Fam Pract 1993; 10:371–7.
32. Turner JC, Fox A, Fox K et al. Role of group C ß-hemolytic streptococci in pharyngitis: epidemiologic study of clinical features associated with isolation of group C streptococci. J Clin Microbiol 1993; 31: 808–11.
33. Turner JC, Hayden FG, Lobo MC, et al. Epidemiologic evidence for Lancefield group C Beta-hemolytic streptococci as a cause of exudative pharyngitis in college students. J Clin Microbiol 1997; 35: 1–4.34. udley JP, Sercarz J. Pharyngeal and tonsil infections caused by nongroup A streptococcus. Am J Otolaryngol 1991; 12: 292–6.
35. Turner JC, Hayden GF, Kiselica D, et al. Association of group C Beta-hemolytic streptococci whit endemic pharyngitis among college students. JAMA 1990; 264: 2644–7.
36. Shah M, Centor RM, Jennings M. Severe acute pharyngitis caused by group C streptococcus. J Gen Intern Med 2007; 22: 272–4.
37. Jansen TL, Janssen M, de Jong AJ. Reactive arthritis associated whit group C and group G Beta-hemolytic streptococci. J Rheumatol 1998; 25: 1126–30.
38. Haidan A, Talay SR, Rohde M, et al. Pharyngeal carriage of group C and group G streptococci and acute rheumatic fever in an aboriginal population. Lancet 2000; 356: 1167–9.
39. McDonald M, Currie BJ, Carapetis JR. Acute rheumatic fever: a chink in the chain that links the heart to the throat? Lancet Infect Dis 2004; 4: 240-5
40. Centor RM, Witherspoon JM, Dalton HP, et al. The diagnosis of strep throat in adults in the emergency room. Med Decis Making 1981; 1: 239–6.
41. McIsaac WJ, White D, Tannenbaum D, et al. A clinical score to reduce unnecessary antibiotic use in patients with sore throat. Can Med Assoc J 1998; 158: 75–83.
42. Wannamaker LW. Perplexity and precision in the diagnosis of streptococcal pharyngitis. Am J Dis Child 1972; 124:352–8.
43. Breese BB. A simple scorecard for the tentative diagnosis of streptococcal pharyngitis. Am J Dis Child 1977; 131:514–7.
44. McIsaac WJ, Kellner JD, Aufricht P, et al. Empirical validation of guidelines for the management of pharyngitis in children and adults. JAMA 2004; 291:1587–95.
45. Poses RM, Cebul RD, Collins M, et al. The accuracy of experien-ced phycisians probability estimates for patients whit sore throats. Implications for decision making. JAMA 1985; 254:925–9.
46. Kaplan EL, Top FH Jr, Dudding BA, et al. Diagnosis of streptococcal pharyngitis: differentiation of active infection from the carrier state in the symptomatic child. J Infect Dis 1971; 123:490–501.
47. Gerber MA, Shulman ST. Rapid diagnosis of pharyngitis caused by group A streptococci. Clin Microbiol Rev 2004; 17:571–80.
48. Tanz RR, Gerber MA, Kabat W, et al. Performance of a rapid antigen-detection test and throat culture in community pediatric offices: implications for management of pharyngitis. Pediatrics 2009; 123:437–44.
49. Gerber MA. Comparison of throat cultures and rapid strep tests for diagnosis of streptococcal pharyngitis. Pediatr Infect Dis J 1989; 8:820–4.
50. Lennon D, Kerdemelidis M, Arroll. Meta-analysis of trials of streptococcal throat treatment programs to prevent rheumatic fever. Pediatr Infect Dis J 2009; 28: e259-64.










