
Factores Pre-Analíticos en la determinación de hormonas tiroideas
Liliana M. Bergoglio, Bioquímica Endocrinóloga, Universidad Nacional de Córdoba, Córdoba, Argentina
E-mail: liberg@uolsinectis.com.ar
Jorge H. Mestman, Médico Endocrinólogo, Universidad del Sur de California, Los Angeles, CA, Estados Unidos
NACB: Guía de Consenso para el Diagnóstico y Seguimiento de la Enfermedad Tiroidea
Fuente: Revista Argentina de Endocrinología y Metabilismo, Vol 42, N° 2, Año 2005
Mencionamos con reconocimiento los nombres de los profesionales que participaron en la revisión de la traducción del documento original sobre el cual está basada esta monografía:
Claudio Aranda, Hospital Carlos C. Durand, Buenos Aires, Argentina
Aldo H. Coleoni, Universidad Nacional de Córdoba, Córdoba,Argentina
N. Liliana F. de Muñoz, Hospital de Niños de la Santísima Trinidad,Córdoba, Argentina
Silvia Gutiérrez, Hospital Carlos C. Durand, Buenos Aires, Argentina
H. Rubén Harach, Hospital Dr. A. Oñativia, Salta, Argentina
Gustavo C. Maccallini, Hospital Carlos C. Durand, Buenos Aires, Argentina
Mirta B. Miras, Hospital de Niños de la Santísima Trinidad, Córdoba, Argentina
Hugo Niepomniszcze, Universidad Nacional de Buenos Aires, Buenos Aires, Argentina
Adriana Oneto, Hospital Carlos C. Durand, Buenos Aires, Argentina
Eduardo Pusiol, Universidad Nacional de Cuyo, Mendoza, Argentina
Gerardo C. Sartorio, Hospital J. M. Ramos Mejía, Buenos Aires,Argentina
Afortunadamente, la mayor parte de las variables pre-analíticas tienen poco efecto en la determinación de TSH, el análisis más comúnmente utilizado para evaluar el estado tiroideo en pacientes ambulatorios. Las variables analíticas, y la presencia de sustancias interferentes en la muestra, pueden influir en la unión de las hormonas tiroideas a las proteínas plasmáticas, y así disminuir la exactitud de un diagnóstico basado en las determinaciones de hormonas tiroideas totales y libres más que en las de TSH (Tabla 1). Los valores de T4L y de TSH pueden conducir a diagnósticos erróneos en pacientes hospitalizados con enfermedades severas no tiroideas (NTI). De hecho, estos pacientes eutiroideos, con frecuencia presentan valores anormales de TSH y/o de hormonas tiroideas totales y libres. Lo mismo puede ocurrir por ingestión de medicamentos que interfieren con la secreción o la síntesis hormonal. Cuando existe una sospecha importante de que alguna de estas variables pudiera afectar los resultados de los ensayos, es necesario consultar con el médico o el bioquímico especialistas.
Ver tabla 1 en las imágenes de la derecha.
Además de la variabilidad fisiológica intrínseca, factores individuales, tales como anormalidades genéticas en las proteínas transportadoras, o enfermedades severas no tiroideas (NTI) pueden influir en la sensibilidad y en la especificidad clínicas de un ensayo.
Asimismo, factores iatrogénicos como la administración de medicamentos tiroideos y no tiroideos (por ejemplo: glucocorticoides, betabloqueantes), y otros factores en la muestra, como la presencia de autoanticuerpos anti-hormonas tiroideas, anti-Tg, y anticuerpos heterófilos (HAMA) puede afectar la exactitud del diagnóstico al conducir a una interpretación errónea del resultado de un ensayo. La Tabla 2 enumera los factores pre-analíticos que se deben considerar en la interpretación de los ensayos tiroideos.
Ver tabla 2 a la derecha.
| Recomendación N°1. Orientación General para los Laboratorios y los Médicos |
| *Los laboratorios deberían conservar (entre 4 y 8ºC) las muestras de suero utilizadas para los ensayos tiroideos por lo menos durante una semana después de que se hayan informado los resultados a fin de permitir a los médicos solicitar pruebas adicionales.*Las muestras provenientes de pacientes con cáncer diferenciado de tiroides (CDT) enviadas para determinaciones de Tiroglobulina (Tg) sérica se deberían conservar (a –20°C) durante seis meses como mínimo. |
A. Variables fisiológicas
En la práctica, en los adultos ambulatorios, variables como edad, sexo, raza, estación del año, fase del ciclo menstrual, hábito de fumar, actividad física, ayuno o estasis venosa inducida por la flebotomía, ejercen efectos menores sobre los rangos de referencia de los ensayos tiroideos (18). Dado que las diferencias debido a estas variables fisiológicas son menores que las diferencias entre los distintos métodos de ensayo, se las considera insignificantes, en la práctica clínica.
1.Relación TSH / T4L
La comprensión de la relación normal que existe entre los niveles séricos de T4 libre (T4L) y TSH es esencial para la interpretación de los ensayos tiroideos. Un eje hipotálamo-hipofisario intacto es un requisito necesario si se quieren usar las determinaciones de TSH para diagnosticar disfunción tiroidea primaria (19).
Varias condiciones clínicas y agentes farmacológicos pueden alterar la relación T4L /TSH. Como muestra la Tabla 1 es más frecuente encontrar falsos resultados en la determinación de T4L que en la de TSH.
Cuando la función hipotálamo-hipofisaria es normal, se produce una relación logarítmica /lineal inversa entre la TSH y la T4L séricas por la retroalimentación negativa que ejercen las hormonas tiroideas inhibiendo la secreción de TSH hipofisaria. Por lo tanto, la función tiroidea se puede determinar directamente, midiendo el producto primario de la glándula tiroides, T4 (preferentemente como T4 libre) o indirectamente, midiendo TSH, que refleja (de manera inversa) la concentración de la hormona tiroidea detectada por la hipófisis. De esto se desprende que una TSH elevada y una T4L baja son características del hipotiroidismo, mientras que una TSH baja y una T4L elevada lo son del hipertiroidismo. De hecho, desde que ha mejorado la sensibilidad y especificidad de los ensayos de TSH, se acepta que el procedimiento indirecto (determinación de TSH sérica) ofrece una mayor sensibilidad para la detección de disfunción tiroidea que el procedimiento directo (determinación de T4L) (10).
Existen dos razones para utilizar una estrategia diagnóstica basada en la TSH para pacientes ambulatorios:
1) Como lo muestra la Figura 1, las concentraciones séricas de TSH y de T4L presentan una relación inversa logarítmica / lineal, de manera tal que ligeras modificaciones en la T4L producirán una respuesta mucho mayor (amplificada) en la TSH (20).
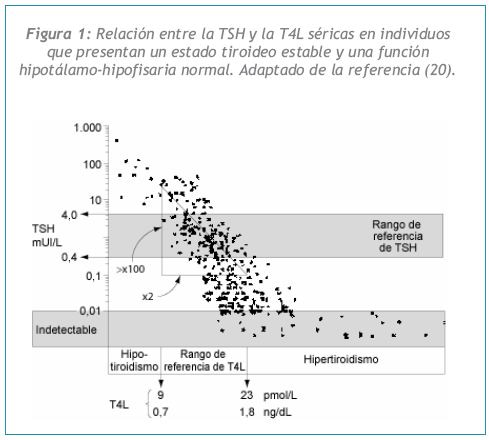
2) Las variaciones individuales en los valores de los ensayos tiroideos junto con estudios realizados en gemelos sugieren que cada individuo tiene un nivel propio de T4L genéticamente determinado (21, 22). Cualquier exceso o deficiencia leves de T4L será detectado por la hipófisis con relación al valor de T4L propio de ese individuo en particular, y provocará una respuesta amplificada e inversa en la secreción de TSH. En consecuencia, en las primeras etapas de la disfunción tiroidea, una anormalidad en la TSH precederá a una anormalidad en la T4L, ya que la TSH responde exponencialmente a cambios sutiles de la T4L que aún se halla dentro de los límites de referencia de la población. Esto se debe a que los límites de referencia de T4L de la población son amplios, y reflejan los diferentes niveles individuales de la cohorte de sujetos normales incluidos en el estudio para determinar el rango de referencia.
En la actualidad, la determinación de TSH sérica es el indicador más confiable del estado tiroideo a nivel tisular. En los estudios de exceso o deficiencia leves de hormona tiroidea (TSH anormal / T4L y T3L normales) se observan anormalidades en los marcadores de acción de la hormona tiroidea en diversos tejidos (corazón, cerebro, hueso, hígado y riñón). Estas anormalidades generalmente se revierten cuando se inicia el tratamiento para normalizar la TSH (23-26).
Es importante reconocer las situaciones clínicas en las que los valores de TSH o de T4L pueden generar un diagnóstico erróneo. Entre ellas se incluyen anormalidades en la función hipotalámica o hipofisaria, incluyendo tumores hipofisarios productores de TSH (27-29).
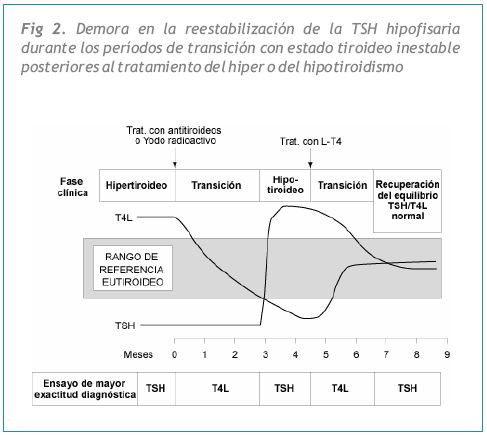
Además, como se muestra en la Figura 2, los valores de TSH resultan equívocos para el diagnóstico durante los períodos transitorios de estado tiroideo inestable, como el que se presenta en la fase temprana del tratamiento para el hiper o el hipotiroidismo, o en el cambio de dosis de L-T4. Se necesitan entre 6 y 12 semanas para que la TSH hipofisaria se reequilibre de acuerdo al nuevo estado de hormonas tiroideas (30). Estos períodos de estado tiroideo inestable también pueden presentarse luego de una tiroiditis, incluyendo la tiroiditis post parto durante la cual es posible observar discordancia entre TSH y T4L.
Las drogas que influyen en la secreción hipofisaria de TSH (por ejemplo, dopamina, glucocorticoides, etc.) o que alteran la unión de las hormonas tiroideas a las proteínas plasmáticas, también pueden provocar valores discordantes de TSH.
| Recomendación N° 2 Ensayos para evaluar la función tiroidea en pacientes ambulatorios |
| *Pacientes con estado tiroideo estable: Cuando el estado tiroideo es estable y la función hipotálamo-hipofisaria está intacta, la determinación de TSH es más sensible que la de T4L para detectar exceso o deficiencia leves (subclínicos) de hormonas tiroideas. La mayor sensibilidad diagnóstica de la TSH refleja la relación logarítmica / lineal que existe entre TSH y T4L, y la gran sensibilidad de la hipófisis para detectar las anormalidades de T4L en relación con el nivel genéticamente determinado para cada individuo.*Pacientes con estado tiroideo inestable: La determinación de T4L es un indicador más confiable del estado tiroideo que la TSH cuando el estado tiroideo es inestable, como por ejemplo durante los 2 ó 3 primeros meses de tratamiento para el hipo o el hipertiroidismo. Los pacientes con hipotiroidismo severo crónico pueden desarrollar hiperplasia del tirotrofo hipofisario que quizás simule un adenoma hipofisario, pero que se resuelve después de varios meses de tratamiento con L-T4. En pacientes hipotiroideos en los que se sospecha falta de cumplimiento con la terapia de reemplazo con L-T4, el seguimiento se debería realizar con ambas determinaciones: SH y T4L, ya que estos pacientes pueden presentar valores discordantes de TSH y de T4L (TSH elevada / T4L elevada) debido a un desequilibrio persistente entre ambas. |
| Recomendación Nº 3. Ensayos para evaluar la función tiroidea en niños |
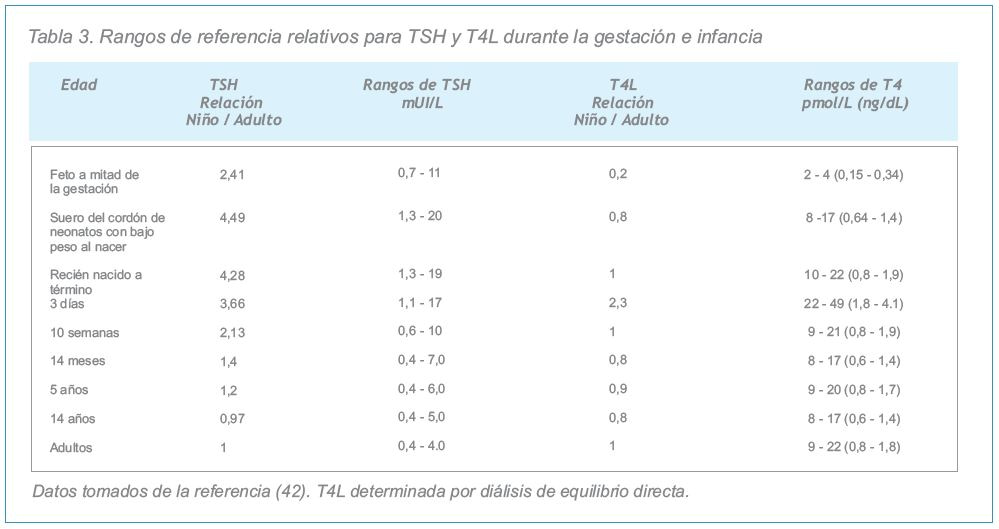
| El eje hipotálamo-hipófiso-tiroideo madura durante la infancia hasta el final de la pubertad.*Las concentraciones de TSH y T4L son más altas en niños, especialmente en la primera semana de vida y durante el primer año. No reconocer esto podría provocar la pérdida del diagnóstico o el subtratamiento de casos de hipotiroidismo congénito.*Deberían usarse valores de referencia ajustados por edad para todos los ensayos. (Ver tabla 3). |
2.Efectos de la edad cronológica sobre los rangos de referencia de los ensayos tiroideos
(a) Adultos
A pesar de que ciertos estudios muestran diferencias leves entre individuos jóvenes y de mayor edad, no es necesario desarrollar rangos de referencia ajustados por edad en adultos, para hormonas tiroideas ni para TSH. Con respecto a los individuos añosos eutiroideos, el valor medio de TSH aumenta cada década, lo mismo que la prevalencia de concentraciones bajas y altas, en comparación con individuos más jóvenes (18, 34, 35). A pesar de la amplia variabilidad de TSH sérica observada a su vez en individuos de mayor edad, tampoco parece justificarse el uso de un rango de referencia más amplio ni ajustado por edad en estos individuos (31, 32). Este enfoque conservador se justifica en base a estudios que sostienen que la TSH sérica ligeramente suprimida o elevada se asocia con un aumento en la morbilidad y mortalidad cardiovasculares. (36, 37).
(b) Neonatos, infantes y niños
En los niños, el eje hipotálamo-hipófiso-tiroideo sufre una maduración y un cambio progresivos. Específicamente, hay una continua disminución en la relación TSH/T4L desde la mitad de la gestación hasta que se completa la pubertad (38-43). Como resultado, en los niños habitualmente se observan concentraciones más altas de TSH (44). Este proceso de maduración determina el uso en pediatría de límites de referencia específicos para cada edad. Sin embargo, existen diferencias significativas entre las determinaciones de T4L y de TSH en función de los métodos empleados.
Debido a que la mayoría de los fabricantes de equipos de reactivos no ha establecido intervalos de referencia específicos para cada edad, estos pueden ser calculados para los diferentes ensayos ajustando los límites superior e inferior del rango de referencia adulto por medio de la relación entre los valores de niños vs adultos, como se indica en la Tabla 3.
Durante el período neonatal, la deprivación calórica y en las personas añosas, se observa una disminución en la T3 sérica total y libre (determinadas por la mayoría de los métodos). En el último trimestre del embarazo la T3 libre también se encuentra disminuida (15). Además, es típico observar concentraciones más elevadas de T3 total y libre en niños eutiroideos. Esto sugiere que el límite superior de T3 para pacientes jóvenes (menores de 20 años) debería establecerse como un gradiente: entre 6,7pmol/L (4,4 pg/mL) para los adultos y 8,3 pmol/L (5,4 pg/mL) para los niños menores de 3 años de edad (45).
3. Embarazo
Durante el embarazo, la producción de estrógenos aumenta progresivamente, elevando la concentración de TBG. Los valores de TBG aumentan al doble o triple de los niveles previos al embarazo, y alcanzan un plateau hacia las 20 semanas de gestación (46, 47). Este aumento de TBG provoca un cambio en los rangos de referencia de T4T y T3T, hacia las 16 semanas de gestación, de aproximadamente 1,5 veces con respecto a los niveles de no embarazadas. (48-50). Estos cambios se asocian con una disminución en la TSH sérica durante el primer trimestre, de modo que es posible observar valores subnormales de TSH en aproximadamente el 20% de los embarazos normales (46, 47, 51). Esta disminución en la TSH se atribuye a la actividad estimulante de la tiroides de la gonadotropina coriónica humana (hCG), que tiene homología estructural con la TSH (52, 53). El pico de hCG y el nadir de TSH se producen simultáneamente alrededor de las 10 a 12 semanas de gestación. En aproximadamente el 10% de esos casos (es decir, en el 2% de todos los embarazos), el aumento de T4 libre alcanza valores supranormales, que cuando se prolongan, pueden provocar un síndrome denominado “tirotoxicosis gestacional transitoria” (TGT) caracterizado por síntomas y signos más o menos pronunciados de tirotoxicosis (52-54). Esta condición se asocia con frecuencia con hiperemesis en el primer trimestre del embarazo (55, 56).
La disminución de TSH durante el primer trimestre del embarazo se asocia con un modesto aumento de T4L (46, 47, 51). A partir de entonces, en el segundo y tercer trimestres se ha consensuado una disminución de T4L y T3L de aproximadamente entre el 20 y el 40 por ciento por debajo de la media normal, disminución que se intensifica cuando el estado nutricional de la madre con respecto al yodo está restringido o es deficiente. (46, 47, 51). En algunos casos, la T4L puede caer por debajo del límite inferior de referencia para pacientes no embarazadas (51, 57-60). La frecuencia de concentraciones de T4L subnormales es dependiente del método utilizado para la determinación. (57, 59, 60). Las pacientes que reciben terapia de reemplazo con L-T4 y quedan embarazadas pueden necesitar un aumento en la dosis para mantener los niveles de TSH normales (61, 62). El estado tiroideo de dichas pacientes se debería controlar con TSH + T4L en cada trimestre. La dosis de L-T4 se debería ajustar para mantener normales las concentraciones de TSH y de T4L Las concentraciones séricas de Tg. En general aumentan durante el embarazo normal (46). Las pacientes con carcinoma diferenciado de tiroides (CDT) con tejido tiroideo remanente, muestran un incremento característico de dos veces en la Tg sérica, que vuelve al nivel basal hacia las 6 a 8 semanas después del parto.
La disminución en la disponibilidad de hormonas tiroideas maternas puede ser un factor crítico que dañe el desarrollo neurológico del feto en las etapas iniciales de gestación, antes de que la glándula tiroides fetal se active. Varios estudios recientes informan aumento de pérdida fetal y déficit del coeficiente intelectual en los infantes nacidos de madres con hipotiroidismo no diagnosticado, T4L baja o TPOAb positivos (63-65). Sin embargo, un estudio sugiere que el diagnóstico y tratamiento precoces del hipotiroidismo leve pueden evitar los efectos a largo plazo de los niveles bajos de hormonas tiroideas sobre los sistemas sicomotor y auditivo de los neonatos (66).
| Recomendación Nº 4. Ensayos para evaluar la función tiroidea en pacientes embarazadas |
| *Es cada vez mayor la evidencia que sugiere que el hipotiroidismo durante los primeros meses de embarazo tiene un efecto perjudicial sobre el feto (pérdida fetal) y sobre el infante (menor coeficiente intelectual).*Es importante realizar un screening para disfunción tiroidea determinando TSH y TPOAb antes del embarazo o durante el primer trimestre, tanto para detectar insuficiencia tiroidea leve (TSH > 2,5 mUI/L) como para evaluar el riesgo de tiroiditis post parto (TPOAb elevados).*Debería considerarse un tratamiento con levotiroxina (L-T4) si el nivel de TSH sérica es >2,5mUI/L en el primer trimestre de embarazo.*Una concentración elevada de TPOAb durante el primer trimestre es un factor de riesgo para tiroiditis post parto. La TSH debería utilizarse para evaluar el estado tiroideo durante cada trimestre cuando las embarazadas reciben tratamiento con L-T4, con determinaciones más frecuentes si se cambia la dosis.*Deberían utilizarse intervalos de referencia específicos para cada trimestre en los ensayos para embarazadas.*Las determinaciones de T4T y T3T pueden resultar útiles durante el embarazo si no se dispone de determinaciones confiables de T4L, siempre que los rangos de referencia se aumenten 1,5 veces en relación con los rangos de no embarazadas.*Los rangos de referencia de T3L y T4L durante el embarazo son dependientes del método empleado y deberían establecerse para cada uno de ellos.*Deberían evitarse las determinaciones de tiroglobulina sérica (Tg) en los pacientes con CDT durante el embarazo. La Tg sérica se eleva durante el embarazo normal y vuelve a los niveles basales después del parto. Este aumento también se observa en las pacientes con CDT, con tiroides normal remanente o con tejido tumoral presente, y esto no debe ser necesariamente una causa de alarma. |
B. Variables patológicas
1. Medicamentos
Los medicamentos pueden provocar efectos tanto in vivo como in vitro en los ensayos tiroideos. Esto puede generar una interpretación errónea de los resultados de laboratorio, diagnósticos inadecuados, pruebas adicionales innecesarias y aumento en los costos de salud (67, 68).
(a) Efectos in vivo
En general, los medicamentos afectan más las concentraciones de hormonas tiroideas que las de TSH (Tabla 1). Por ejemplo, el aumento de TBG inducido por estrógenos incrementa los niveles de T4T pero no afecta la concentración de TSH, porque la secreción hipofisaria de TSH es controlada por la T4L independientemente de los efectos de las proteínas transportadoras.
Los glucocorticoides en dosis elevadas pueden disminuir el nivel de T3 sérica e inhibir la secreción de TSH (69, 70). También la dopamina inhibe la secreción de TSH e incluso puede enmascarar el aumento del nivel de TSH del hipotiroidismo primario en pacientes enfermos hospitalizados (71). El propranolol, a veces utilizado para tratar las manifestaciones de tirotoxicosis tiene un efecto inhibitorio de la conversión de T4 a T3, y administrado en dosis altas a individuos sin enfermedad tiroidea, puede provocar una elevación de TSH como resultado de esta conversión alterada (72).
El yodo, contenido en las soluciones desinfectantes de la piel, en los medios de contraste radiopacos usados en las coronariografías y en las tomografías computadas, puede provocar hiper e hipotiroidismo en individuos predispuestos (73). Además, la amiodarona (medicamento antiarrítmico que contiene yodo) utilizado para el tratamiento de las cardiopatías tiene efectos complejos sobre la función tiroidea y puede producir tanto hipo como hipertiroidismo en individuos predispuestos, con TPOAb positivos (74-78). Los
pacientes tratados con L-T4 que toman amiodarona pueden tener niveles de TSH anormalmente elevados en relación con su concentración de T4L (75). Dos tipos de hipertiroidismo inducido por amiodarona (HIA), pueden desarrollarse durante el tratamiento, aunque se observan formas mixtas en el 20% de los casos. A veces es difícil distinguir entre los dos tipos. Un flujo sanguíneo reducido en el examen por Doppler Color y el aumento de interleuquina-6 sugieren el Tipo II (79, 80). Si la etiología es incierta, se debe orientar el tratamiento hacia los tipos I y II.
_ Tipo I: El HIA parece inducido en las glándulas tiroides anormales por el exceso de yodo que contiene el medicamento. Se ha utilizado una combinación de tionamidas y perclorato de potasio para tratar estos casos.
_ Tipo II: El HIA parece resultar de una tiroiditis destructiva que generalmente se trata con prednisona y tionamidas. Algunos estudios informan niveles elevados de IL-6 en el Tipo II (79). La T3 sérica (libre y total) es típicamente baja durante el tratamiento. Un valor de T3 paradójicamente normal o elevado es útil para reforzar el diagnóstico de hipertiroidismo inducido por amiodarona.
| Recomendación Nº 5. Ensayos para evaluar la función tiroidea en pacientes tratados con amiodarona. |
| El tratamiento con amiodarona puede inducir el desarrollo de hipo-o hipertiroidismo entre el 14 y el 18% de los pacientes con glándula tiroides aparentemente normal o con anormalidades preexistentes.*Antes de instaurar el tratamiento. Examen físico completo de tiroides y determinaciones de TSH y TPOAb basales. Las determinaciones de T4L y de T3L sólo son necesarias si la TSH es anormal. Los TPOAb positivos son un factor de riesgo para el desarrollo de disfunción tiroidea durante el tratamiento.*Primeros 6 meses. Se pueden observar pruebas de laboratorio anormales en los primeros seis meses de iniciada la terapia. TSH puede ser discordante con las hormonas tiroideas (TSH elevada/ T4 elevada / T3 baja), y generalmente se normaliza durante el curso de un tratamiento a largo plazo si los pacientes permanecen eutiroideos.*Seguimiento a largo plazo. Controlar el estado tiroideo cada 6 meses con TSH. La TSH es el indicador más confiable del estado tiroideo durante el tratamiento.*Hipotiroidismo. Una tiroiditis de Hashimoto preexistente y/ o un valor positivo de TPOAb es un factor de riesgo para el desarrollo de hipotiroidismo en cualquier momento del tratamiento.*Hipertiroidismo. Un valor bajo de TSH sugiere hipertiroidismo. La T3 (total y libre) generalmente permanece baja durante el tratamiento pero puede ser normal. Una T3 alta sugiere hipertiroidismo. Durante el tratamiento, es posible que se desarrollen dos tipos de hipertiroidismo inducido por amiodarona, si bien es frecuente observar formas mixtas (en el 20% de los casos). La distinción entre los dos tipos, con frecuencia es difícil. Un flujo sanguíneo reducido en el examen por Doppler Color y la elevación de interleuquina-6 sugieren el Tipo II. Si la etiología es incierta dirigir el tratamiento a los dos tipos, I y II.•• Tipo I = Inducido por yodo. El tratamiento recomendado es la administración simultánea de tionamidas y perclorato de potasio (si está disponible). Algunos recomiendan ácido iopanoico antes de la tiroidectomía.La mayoría de los grupos recomienda la interrupción de la amiodarona. El tipo I se observa con mayor frecuencia en zonas de baja ingesta de yodo. Sin embargo, en áreas donde el aporte de yodo es suficiente, las captaciones de yodo radiactivo pueden ser bajas excluyendo al radioyodo como opción terapéutica. En regiones con deficiencia de yodo, las captaciones pueden ser normales o elevadas.- Tipo Ia: Bocio nodular. Más frecuente en zonas geográficas con deficiencia de yodo, por ejemplo en Europa.- Tipo Ib: Enfermedad de Graves. Más frecuente en zonas geográficas suficientes en yodo, por ejemplo en Estados Unidos.•• Tipo II = tiroiditis destructiva inducida por amiodarona, enfermedad auto limitada. Tratamiento recomendado: glucocor-ticoides y/o betabloqueantes si el estado cardíaco lo permite.Cuando el hipertiroidismo es severo, se puede considerar la cirugía con pre-tratamiento con ácido iopanoico. La captación de yodo radiactivo es típicamente baja o inhibida. El Tipo II se observa con mayor frecuencia en áreas suficientes en yodo. |
El tratamiento con Litio puede causar hipo o hipertiroidismo en por lo menos el 10% de los pacientes, especialmente en aquellos con TPOAb detectables. (81-83). Algunos agentes terapéuticos y diagnósticos (por ejemplo, Fenitoína, Carbamazepina o Furosemida) pueden inhibir competitivamente la unión de la hormona tiroidea a las proteínas transportadoras en la muestra, y provocar un aumento agudo de T4L que resulta en una disminución de T4T por un mecanismo de retroalimentación (disminución de TSH) y de una mayor eliminación de T4.
(b) Efectos in vitro
La administración de Heparina por vía intravenosa, puede liberar ácidos grasos libres (FFA), por la estimulación in-vitro de la lipoproteína lipasa, que inhiben la unión de la T4 a las proteínas séricas, y elevan artificialmente la T4L . En ciertas condiciones patológicas como la insuficiencia renal, elementos séricos anormales como el ácido indol acético, se pueden acumular e interferir con la unión de las hormonas tiroideas (85). Los métodos de ensayos tiroideos que utilizan señales fluorescentes pueden ser sensibles a la presencia en la muestra de agentes fluorósforos terapéuticos o de diagnóstico (86).
2. Enfermedades no tiroideas (NTI)
Los pacientes en estado grave a menudo presentan anormalidades en sus pruebas de laboratorio tiroideas pero normalmente no tienen disfunción tiroidea (87, 88). Estas anormalidades se observan en las enfermedades críticas tanto agudas como crónicas, y se consideran el resultado de una inhibición central “desadaptada” de las hormonas liberadoras del hipotálamo, incluido el TRH (89, 90). Para describir este subgrupo de pacientes a menudo se utilizan los términos “enfermedad no tiroidea”, (nonthyroidal illness o NTI) así como también “enfermo eutiroideo” y “síndrome de T3 baja” (91). Como se muestra en la Figura 3, el espectro de cambios en los ensayos tiroideos se relaciona tanto con la severidad como con la etapa de la enfermedad, así como con factores técnicos que afectan los métodos y en ciertos casos, con los medicamentos administrados a estos pacientes.
Se ha demostrado que las determinaciones de T4L y de TSH tienen una especificidad reducida para detectar disfunción tiroidea en los pacientes que tienen NTI severas, en comparación con los pacientes ambulatorios (20, 92, 93). Generalmente se recomienda que la evaluación de la función tiroidea en pacientes hospitalizados se limite a los que tienen síntomas clínicos o antecedentes de disfunción tiroidea (93). Las razones que explican la especificidad reducida de los ensayos tiroideos en estas circunstancias son multifactoriales.
Muchos de estos pacientes reciben medicamentos tales como dopaminérgicos, glucocorticoides, furosemida o heparina que inhiben directamente la secreción hipofisaria de TSH o indirectamente la unión de T4 a proteínas, como se describió anteriormente.
Además, se ha demostrado que en ciertas condiciones patológicas, las afinidades de las proteínas transportadoras están reducidas, posiblemente por la presencia de inhibidores endógenos circulantes (60, 85, 94-96).
La mayoría de los pacientes hospitalizados tienen T3T y T3L bajas, determinadas por la mayoría de los métodos (14, 97). A medida que aumenta la severidad de la enfermedad, generalmente cae también la T4T debido a una ruptura de las afinidades de las proteínas transportadoras, causada probablemente por los inhibidores de la unión de T4 presentes en la circulación. (91, 98, 99). Cabe observar que los valores subnormales de T4T sólo se manifiestan cuando la gravedad de la enfermedad es crítica (generalmente en las sepsis). Este tipo de pacientes habitualmente está en la UTI (unidad de terapia intensiva). Si una T4T baja no se asocia con una TSH alta (>20mUI/L) y el paciente no está gravemente enfermo, se debería considerar un diagnóstico de hipotiroidismo central secundario a una deficiencia hipofisaria o hipotalámica. Las estimaciones de los valores de T4L y de T3L dependen del método utilizado, y pueden estar falsamente elevados o disminuidos en función de los principios metodológicos en los que se basa el ensayo. Por ejemplo, los ensayos de T4L no son confiables si el método es sensible a la liberación de ácidos grasos libres generados in vitro después de la inyección de heparina intravenosa ver Sección-3 B3 c vii, o a los artefactos de dilución (84, 94, 97, 98, 100, 101).
Los métodos de T4L como la diálisis de equilibrio y la ultrafiltración que separan físicamente la hormona libre de la unida a proteínas, habitualmente generan valores normales o elevados en pacientes en estado crítico. Los valores elevados, a menudo representan los efectos de la heparina administrada por vía intravenosa (101).
Las concentraciones de TSH sérica permanecen dentro de los límites normales en la mayoría de los pacientes con NTI, siempre que no se les administre dopamina ni glucocorticoides (87, 93). Sin embargo, en las NTI agudas, puede haber una disminución leve y transitoria de TSH en el rango de 0,02-0,3 mIU/L, seguido de un rebote a valores ligeramente elevados durante la fase de recuperación (103). En el ambiente hospitalario, es fundamental usar un ensayo de TSH con sensibilidad funcional óptima:
| Recomendación Nº 6.Ensayos para evaluar la función tiroidea en pacientes hospitalizados con enfermedad no tiroidea (NTI) |
| *Las enfermedades no tiroideas agudas o crónicas tienen efectos complejos sobre los resultados de los ensayos de la función tiroidea. Siempre que sea posible, las pruebas diagnósticas deberían postergarse hasta la resolución de la enfermedad, excepto cuando los antecedentes del paciente o su cuadro clínico sugieran la presencia de disfunción tiroidea.*Los médicos deberían reconocer que ciertos ensayos tiroideos son fundamentalmente no interpretables en pacientes gravemente enfermos o a quienes se están administrando numerosos medicamentos.*La TSH en ausencia de la administración de dopamina o de glucocorticoides, es la determinación más confiable en pacientes con NTI.*Las estimaciones de T4 libre o las determinaciones de T4 total en presencia de una NTI deberían interpretarse con cuidado, y en conjunción con la TSH sérica. Las determinaciones combinadas de + TSH constituyen el modo más confiable de distinguir una verdadera disfunción tiroidea primaria (anormalidades concordantes T4/TSH) de las anormalidades transitorias resultantes de las NTI per se (anormalidades discordantes T4/TSH).*Un ensayo de T4L anormal en presencia de una enfermedad somática severa no es confiable, ya que los métodos de T4L utilizados por los laboratorios clínicos carecen de especificidad diagnóstica para evaluar este tipo de pacientes.*Un resultado de T4L anormal en un paciente hospitalizado se debería confirmar con una T4T «refleja». Es posible que exista patología tiroidea si los valores de T4T y T4L son anormales (en el mismo sentido). Si hay discordancia entre los valores de T4T y T4L, es probable que la anormalidad en la T4L no se deba a una disfunción tiroidea sino que sea consecuencia de la enfermedad, de los medicamentos administrados o de un artefacto del método.*Las anormalidades de T4T deberían ser interpretadas en relación con la severidad de la enfermedad, ya que una T4T baja en presencia de NTI generalmente sólo se ve en pacientes severamente enfermos con una alta tasa de mortalidad. Una T4T baja en un paciente que no está en la unidad de cuidados intensivos indica sospecha de hipotiroidismo.*Un aumento de T3 total o libre es un indicador útil de hipertiroidismo en un paciente hospitalizado, pero una T3 normal o baja no lo descarta.*La determinación de T3 reversa (r-T3) rara vez es útil en el ambiente hospitalario, porque valores paradójicamente normales o bajos pueden resultar de un daño en la función renal o de las concentraciones bajas de proteínas transportadoras. Además, el ensayo no está directamente disponible en la mayoría de los laboratorios. |
Es claro que el diagnóstico y tratamiento de la disfunción tiroidea en presencia de una NTI severa no es simple y que requiere la intervención de un especialista endocrinólogo.
El tratamiento empírico del estado de T4T baja en las NTI no ha producido mejoras (en la supervivencia por ejemplo), y aún se lo considera experimental (104-106). Para evaluar a estos pacientes, los ensayos de T4T pueden resultar más útiles que los inmunoensayos de T4L actualmente disponibles, los cuales presentan una importante variabilidad en la eficiencia diagnóstica, siempre que los valores de T4T sean interpretados en relación con la gravedad de la enfermedad. Por ejemplo, un valor bajo de T4T en las NTI se observa fundamentalmente en los pacientes graves, en general en la unidad de cuidados intensivos (71). Valores bajos de T4T en pacientes hospitalizados que no se encuentran gravemente enfermos deberían instar a la búsqueda de un hipotiroidismo. Aunque la especificidad diagnóstica de la TSH se reduce en presencia de enfermedades somáticas, un valor detectable en el rango de 0,02-20 mUI/L, obtenido con un ensayo con sensibilidad funcional
C. Variables de las muestras
1. Estabilidad
Pocos estudios han examinado los efectos de la conservación de las muestras de sangre sobre las concentraciones de las hormonas tiroideas séricas totales y libres, de TSH y de Tg (107). En general, estos estudios sugieren que las hormonas tiroideas son relativamente estables si la muestra es conservada a temperatura ambiente, refrigerada o congelada. Ciertos estudios han mostrado que la T4 sérica es estable durante meses a +4ºC o durante años a –10ºC (108, 109). La TSH y T4T de las gotas secas de sangre total utilizadas en el screening del hipotiroidismo neonatal también son estables durante meses si se las conserva con un desecante. Se ha informado que la TSH sérica es ligeramente más estable que la T4 (110). No obstante, es importante destacar, como se discutió anteriormente, que las muestras no congeladas de pacientes que reciben heparina pueden generar in vitro ácidos grasos libres, que pueden provocar una falsa elevación de T4L cuando es determinada por ciertas técnicas (84).
2. Constituyentes del suero
En general, la hemólisis, lipemia e hiperbilirrubinemia no provocan una interferencia significativa en los inmunoensayos. Sin embargo, los ácidos grasos libres pueden desplazar a la T4 de las proteínas de transporte séricas, lo cual explicaría parcialmente los valores de T4T bajos que se observan con frecuencia en las NTI (100).
3. Anticuerpos heterófilos (HAMA)
El suero de los pacientes puede contener anticuerpos heterófilos que pueden ser de dos clases. (111). Algunos son anticuerpos débilmente reactivos, multiespecíficos y polirreactivos que frecuentemente corresponden a un factor reumatoideo (de tipo IgM), y, otros, pueden ser muy reactivos, inducidos por infecciones o exposición a tratamientos con anticuerpos monoclonales (112, 114). Este segundo grupo recibe a veces el nombre de anticuerpos humanos anti-ratón (HAMA). Alternativamente estos anticuerpos pueden corresponderan inmunoglobulinas humanas específicas anti-animal (HAAA) producidas contra antígenos específicos bien definidos luego de una exposición a un agente terapéutico que contenga antígenos de origen animal (por ejemplo anticuerpos murinos) o por una inmunización ocasional ocurrida por exposición en el lugar de trabajo (por ejemplo, trabajadores que manipulan animales) (115).
Tanto los HAMA como los HAAA afectan a los ensayos inmunométricos (IMA) más que a los inmunoensayos competitivos, al formar un puente entre los anticuerpos de captura y de señal, y generar una falsa señal que provoca un valor inapropiadamente alto del analito. (116, 117). El resultado erróneo puede no ser necesariamente anormal, sino que puede ser también inapropiadamente normal. En la actualidad, los fabricantes de reactivos están empleando diversos procedimientos para abordar el problema de los HAMA y neutralizar sus efectos sobre los métodos, con resultados variables, que incluyen por ejemplo el uso de combinaciones quiméricas de anticuerpos y de agentes bloqueantes (118).
4. Recolección y procesamiento de la muestra
La mayoría de los fabricantes recomienda utilizar suero preferentemente a plasma obtenido con heparina o EDTA. Para resultados óptimos y un máximo rendimiento del suero, se recomienda que las muestras de sangre total se dejen coagular por lo menos durante 30 minutos antes de centrifugarlas y separarlas. El suero se puede conservar entre 4 y 8 ºC hasta una semana. Si el ensayo se realiza después de una semana, se recomienda conservar el suero a –20ºC. La obtención del suero en tubos con barrera de gel puede afectar los resultados de algunos ensayos tiroideos.
5. Parámetros de rendimiento de los ensayos tiroideos
(a) Variación biológica
Los niveles séricos de las hormonas tiroideas como de su proteína precursora, la tiroglobulina (Tg) son bastante estables dentro de un mismo individuo en el período de 1 a 4 años de edad (Tabla 4) (22, 119). Todos los analitos tiroideos muestran una mayor variabilidad interindividual que intraindividual (Tabla 4) (33, 119, 120). La estabilidad de las concentraciones intraindividuales de T4 sérica refleja la vida media larga (7 días) de la tiroxina y el nivel individual de T4L genéticamente determinado (21). La estabilidad intraindividual de las concentraciones de T3 refleja la autorregulación del grado de conversión de T4 a T3 (121). La variabilidad interindividual es particularmente importante para las concentraciones de Tg sérica, porque los individuos de una población presentan diferencias en cuanto a la masa tiroidea, el nivel de TSH, y pueden tener patologías asociadas con lesión tiroidea (por ejemplo tiroiditis), condiciones que influyen en las concentraciones de Tg (122). Los valores séricos de TSH también muestran gran variabilidad, tanto en el mismo individuo como entre un individuo y otro (22). Esto refleja básicamente la vida media de la TSH (~60 minutos) junto con sus variaciones circadianas y diurnas. Los niveles alcanzan un pico durante la noche y un nadir aproximadamente entre las 10.00 y las 16.00 horas (123, 124). La amplitud de la variabilidad diurna de TSH a lo largo de un período de 24 horas es aproximadamente del doble (123, 124). Sin embargo, como este cambio cae dentro del rango de referencia normal de TSH para el conjunto de la población (~0,4 a 4,0 mIU/L), no compromete la utilidad de un valor individual de TSH para diagnosticar disfunción tiroidea. Además, la TSH se determina habitualmente durante el día en los pacientes ambulatorios cuando su variabilidad es menor.
| Recomendación Nº 7. Evaluación de resultados discordantes en los ensayos tiroideos |
| Los resultados discordantes en los ensayos tiroideos pueden deberse a interferencia técnica o a condiciones clínicas raras*Interferencias técnicas: A veces una interferencia técnica puede ser detectada realizando la determinación por otro método, ya que la magnitud de la mayoría de las interferencias depende del método utilizado. Alternativamente la no linealidad en las diluciones de la muestra pueda indicar una interferencia técnica en las determinaciones de T4T, T3T o TSH. Nota: Una dilución 1 en 100 de un suero «normal» teóricamente produce una reducción insignificante ( recomienda hacer diluciones de las muestras en los ensayos de T4L y T3L utilizados de rutina por los laboratorios clínicos, porque esos ensayos están influidos por la concentración de las proteínas de transporte y no dan respuestas lineales a las diluciones.*Condiciones clínicas raras: Es posible observar valores anormales o discordantes en los ensayos tiroideos en ciertas patologías inusuales pero clínicamente significativas como el hipotiroidismo central, los tumores hipofisarios secretantes de TSH, la resistencia a las hormonas tiroideas, la presencia de anticuerpos heterófilos (HAMA) o de autoanticuerpos anti-hormonas tiroideas (T4 y/o T3). |
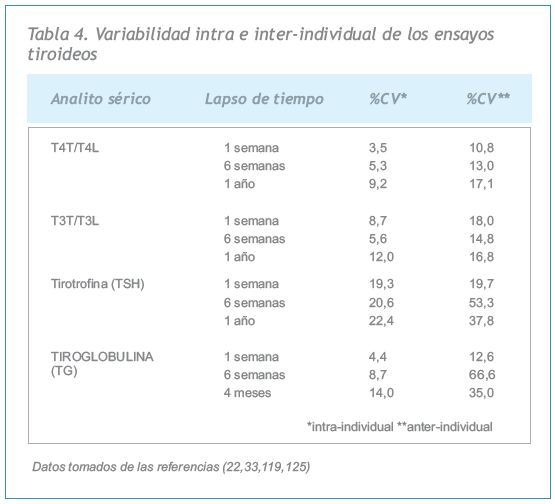
El comportamiento de un ensayo de laboratorio se puede evaluar biológica y analíticamente. La Tabla 4 muestra la variación biológica de diversos analitos tiroideos en suero, expresada en términos de variabilidad inter-individual e intra-individual, a lo largo de diferentes períodos de tiempo (22, 33, 119, 120, 125). El comportamiento analítico se evalúa típicamente en el laboratorio mediante los siguientes parámetros:
- Precisión intra- e inter-ensayo evaluada a diferentes concentraciones del analito
- Límite de detección (sensibilidad analítica) (126, 127)
- Sensibilidad funcional (definida como la mínima concentración del analito que puede determinarse con un dado CV% interensayo, el cual está relacionado con la variabilidad metodológica y con la variabilidad biológica específica para ese analito.
- Linealidad de las mediciones a lo largo del rango reportable de trabajo.
- Recuperación del analito agregado a la matriz del estándar
- Intervalo normal de referencia (media +/-2 desvíos estándar de los valores) para una cohorte de individuos sanos
Correlación con un método de referencia Aunque los parámetros analíticos de comportamiento son el fundamento de los controles de calidad de la mayoría de los laboratorios y de los programas de aseguramiento de calidad, es ampliamente aceptado que los comportamientos analíticos ideales deberían establecerse sobre la base de principios biológicos (variación intra e inter-individuos) y en función de las necesidades clínicas (33). Se ha propuesto que el error analítico total debería ser idealmente menor que la mitad del coeficiente de variación biológica (% CV) intraindividual (33, 125, 128-130).
Para fines diagnósticos, los resultados de los ensayos tiroideos se informan junto con un rango de referencia “normal” que refleja la variabilidad inter-individual. Este rango provee un punto de referencia para detectar casos anormales. No obstante, los rangos de referencia no se pueden utilizar para determinar si las diferencias existentes entre los resultados de dos ensayos consecutivos realizados durante el seguimiento del tratamiento del paciente, constituyen un cambio clínicamente significativo, o simplemente reflejan la variabilidad técnica (imprecisión inter-ensayo) o biológica (variabilidad intraindividual) de la determinación (131). El intervalo “normal” de referencia generalmente carece de importancia durante el manejo clínico post-quirúrgico cuando se utilizan marcadores tumorales como la Tg (132). Claramente el desvío del método y la precisión requerida no deben ser tan estrictos cuando se utiliza el ensayo para diagnóstico como cuando se lo utiliza en determinaciones seriadas para el seguimiento de pacientes. Si bien el intervalo de referencia “normal” que aparece en el informe habitual de laboratorio ayuda al médico a establecer un primer diagnóstico, no ofrece información relevante para ayudarlo a evaluar el significado de los cambios resultantes del tratamiento.
La Tabla 5 muestra los desvíos y las precisiones ideales para los principales ensayos tiroideos utilizados tanto para diagnóstico como para seguimiento. Los valores que se muestran se calcularon a partir de estudios de las estimaciones de precisión intra- e inter-individuales y se basan en conceptos bien establecidos (22, 33, 119, 120, 130, 133, 134).
La Tabla 5 y la Recomendación Nº 8 muestran la magnitud del cambio en dos resultados consecutivos (que estén aproximadamente en la concentración media del rango normal del analito) que es clínicamente significativa para cada ensayo (22, 120). Estos patrones de referencia deberían ayudar al médico a juzgar la importancia clínica de los cambios observados durante el seguimiento seriado en el tratamiento de pacientes con problemas tiroideos.
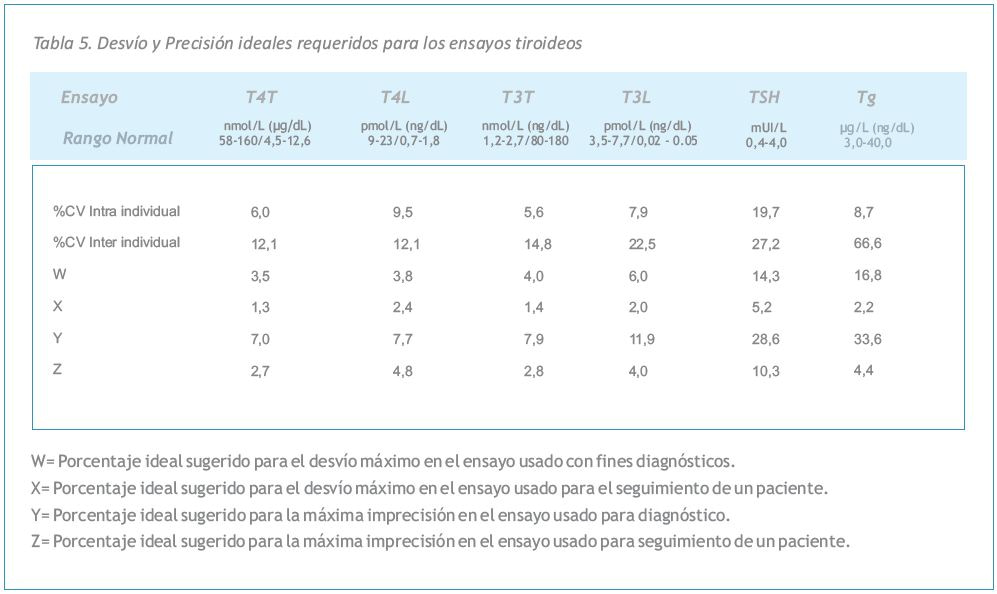
| Recomendación N° 8. Recomendaciones para la interpretación de los resultados de ensayos tiroideos |
| *Para los ensayos tiroideos con fines diagnósticos (búsqueda de casos anormales), los resultados típicamente se informan junto con un intervalo de referencia «normal» que refleja la variabilidad entre individuos.*El intervalo de referencia «normal» no indica la magnitud de la diferencia que debe existir entre los resultados de dos ensayos en un paciente individual para considerar en él un cambio clínicamente significativo. La variabilidad analítica junto con las estimaciones de la variabilidad biológica inter- e intra-individuales sugieren que las magnitudes de las diferencias entre dos resultados de ensayos tiroideos que sean clínicamente significativas, cuando se miento son:T4T = 28 (2,2) nmol/L (ug/dL) T4L = 6 (0,5) pmol/L (ng/dL) T3T = 0,55 (35) nmol/L (ng/dL) T3L = 1,5 (0,1) pmol/L (ng/dL) TSH = 0,75 mUI/L Tg = 1,5 ug/L (ng/mL) |











