Evaluación del rendimiento de 1,3-Beta-dglucano como apoyo diagnóstico de infecciones invasoras por Candida spp. en pacientes críticos adultos
Laboratorio Clínico
Liliana Donato1, Tamara González3, Marilena Canales3, Paulette Legarraga2 3, Patricia García2 3, Ricardo Rabagliati1
1Departamento de Enfermedades infecciosas del Adulto. Facultad de Medicina. Pontificia Universidad Católica de Chile. Santiago, Chile
2Departamento de Laboratorios Clínicos. Pontificia Universidad Católica de Chile. Santiago, Chile
3Servicio de Laboratorios Clínicos. Red de Salud UC-CHRISTUS
Revista chilena de infectología – versión impresa ISSN 0716-1018
Rev. chil. infectol. vol.34 no.4 Santiago ago. 2017 – http://dx.doi.org/10.4067/s0716-10182017000400340
Revista chilena de infectología – versión impresa ISSN 0716-1018
Rev. chil. infectol. vol.34 no.4 Santiago ago. 2017 – http://dx.doi.org/10.4067/s0716-10182017000400340
Correspondencia: Ricardo Rabagliati rabagli@med.puc.cl
Bernanda Morín #488, 2° Piso, Providencia – Santiago – Chile
no/Fax: (56-2) 23413539 – revinf@sochinf.cl
Resumen
Introducción: La enfermedad fúngica invasora (EFI) se reconoce como causa importante de morbi-mortalidad en pacientes críticos. La mayoría de estas infecciones son provocadas por Candida spp. para cuyo diagnóstico existen importantes limitaciones.
Objetivo: Realizar una evaluación inicial de la utilidad de la medición del 1,3-β-D- glucano (BDG) como herramienta diagnóstica de apoyo de las infecciones invasoras por Candida spp. en pacientes críticos.
Pacientes y Método: Estudio prospectivo de pacientes mayores de 18 años hospitalizados en unidades de pacientes críticos por más de cinco días, con fiebre sin foco claro y dos o más factores de riesgo para EFI por Candida spp. Se obtuvieron muestras para BDG en dos días consecutivos. Los resultados se confrontaron con el diagnóstico definitivo de candidemia/candidiasis invasora (C/CI) demostrado según cultivos.
Resultados: El valor promedio de BDG en los pacientes con diagnóstico de C/CI fue 224,3 ± 213,7 pg/mL y en aquellos sin C/CI 63,8 ± 76,7 pg/mL (p: 0,02). La sensibilidad y especificidad de BDG para diagnóstico de C/ CI fue 60 y 92%, respectivamente. El valor predictor positivo fue 60% y el valor predictor negativo de 92%. Conclusión: BDG puede considerarse como un examen de apoyo en el diagnóstico de C/CI en pacientes críticos con factores de riesgo.
Palabras clave: Enfermedad fúngica invasora; Candida spp.; candidiasis invasora; 1-3-β-D-glucano; paciente crítico.
Abstract
Background: Invasive fungal infections are important causes of morbimortality in critical patients. Most of these infections are caused by Candida spp. which diagnosis has important limitations.
Aim: Initial evaluation of the utility of 1,3-β-D-glucan (BDG) as a diagnostic tool for invasive candida infections in critical patients.
Patients and Methods: Adult patients over 18 years old, hospitalized in intensive care units for more than five days, with fever > 38 °C of unclear origin and two or more risk factors for invasive Candida spp. infection were included. Samples for BDG were obtained on two consecutive days. The results were compared with definitive diagnosis of candidemia/invasive candidiasis (C/IC) confirmed by cultures.
Results: Median value of BDG in patients with C/IC was 224.3 ± 213.7 pg/mL and in patients without C/IC was 63.8 ± 76.7 pg/mL (p: 0.02). Sensitivity and specificity for the diagnosis of C/IC were 60 and 92%, respectively. Positive predictive value was 60% and negative predictive value as 92%.
Conclusion: BDG could be considered as a complementary diagnostic tool for the diagnosis of C/IC in critical patients with risk factors.
Keywords: Invasive fungal disease; Candida spp.; invasive candidiasis; 1,3-β-D-glucano; critical patient.
Introducción
La enfermedad fúngica invasora (EFI) se reconoce como causa importante de morbimortalidad en pacientes críticos. La mayoría de estas infecciones son provocadas por Candida spp.1–3. Menos frecuentemente se describen infecciones por Aspergillus spp. u otros hongos filamentosos como agentes de mucormicosis o Fusarium spp., las que suelen presentarse en individuos inmunocomprometidos por patologías hematoncológicas
o receptores de trasplantes2,4,5.
Durante los últimos años se han desarrollado diferentes test serológicos para complementar el estudio de pacientes con sospecha de candidemia6– 8. Entre ellos, se ha estudiado el rol la determinación de (1g3) β-D-glucano (BDG) para el diagnóstico de EFI incluyendo candidemia8– 16. BDG es un polisacárido que forma parte de la pared de varias especies de hongos exceptuando agentes de mucormicosis y Cryptococcus spp., pudiendo detectarse en sangre o plasma de los pacientes durante una EFI mediante un método colorimétrico. Este test es específico para infecciones fúngicas ya que otros microorganismos patógenos no poseen BDG, por lo que el aumento de las concentraciones medibles traduce con mayor probabilidad la existencia de una infección fúngica en curso. En pacientes hemato-oncológicos con neutropenia febril, los estudios han demostrado la utilidad de su medición para el diagnóstico temprano de EFI. Así, se ha reportado su positivización precoz antes del inicio de los síntomas o de los signos radiológicos de EFI9–12. Este test también se ha evaluado en pacientes cursando una infección por Pneumocystis jiroveci donde se observan concentraciones elevadas de BDG, con alta sensibilidad y buen valor predictor positivo17,18.
Existen pocos datos sobre el rendimiento de la medición del BDG en pacientes críticos. Estudios observacionales han mostrado que pacientes con EFI, en su mayoría por Candida spp., presentan valores elevados de BDG en mayor proporción que pacientes sin infección14,15 sugiriendo que su incorporación en protocolos asistenciales permitiría diagnosticar de manera más precoz pacientes con candidemia y/o candidiasis invasora (C/CI).
El objetivo de este estudio fue realizar una evaluación inicial sobre la utilidad de la medición del BDG como herramienta diagnóstica de apoyo en las infecciones invasoras por Candida spp. en pacientes adultos críticamente enfermos con factores de riesgo para C/CI.
Pacientes y métodos
Estudio prospectivo realizado en pacientes adultos internados entre mayo de 2011 y mayo de 2012 en el Hospital Clínico y Clínica UC de la Red de Salud UC-CHRISTUS, centro universitario de nivel terciario, localizado en la ciudad de Santiago, que cuenta con 468 camas, de las cuales 94 (20%) son destinadas al cuidado de paciente crítico adulto (UPC), incluyendo unidades de cuidados intensivos e intermedios, cuya incidencia global de C en adultos es de 0,4 casos por 1.000 egresos19.
Criterios de inclusión
Edad mayor de 18 años, estadía en UPC por al menos cinco días, fiebre ≥ 38°C de inicio reciente (menos de 24 h) sin detección ni documentación de infección bacteriana, o fiebre de más de 48 h de duración a pesar de tratamiento antibacteriano y que presentasen dos o más factores de riesgo para EFI (Tabla 1).
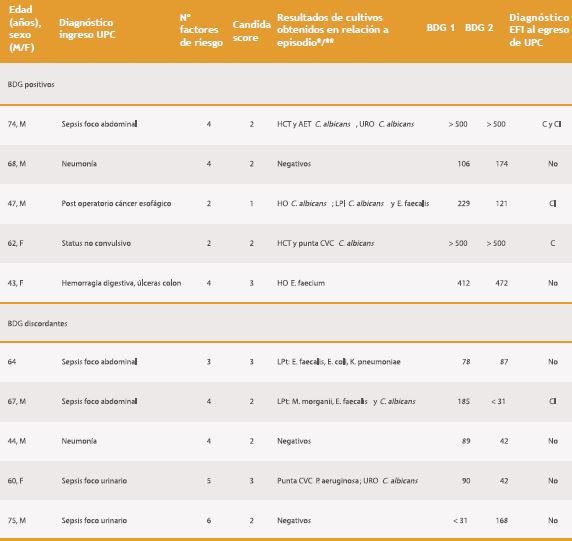
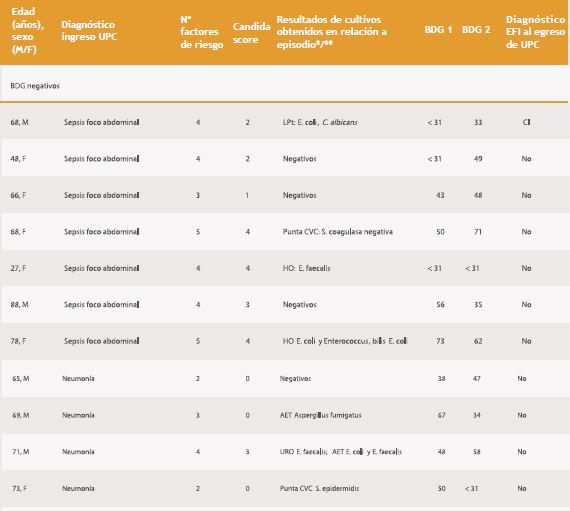
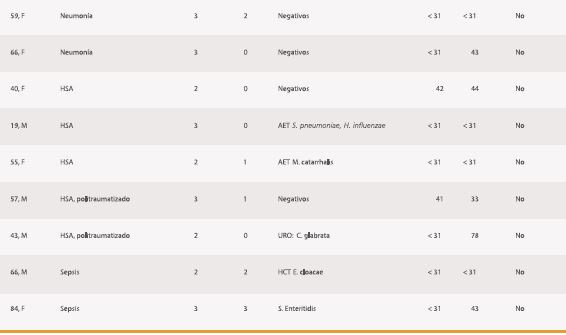
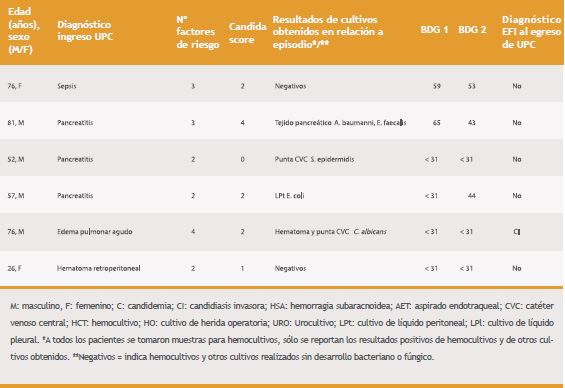
Tabla 1. Características de los 36 pacientes según resultado de BDG, su interpretación y el diagnóstico de EFI al egreso.
Criterios de exclusión
Condiciones que pudiesen alterar los resultados del BDG (uso de amoxicilina/ácido clavulánico, hemodiálisis con filtros de celulosa, infección por Pseudomonas spp., tratamiento con inmunoglobulina o albúmina). De igual manera fueron excluidos aquellos pacientes que estuviesen cursando una infección por P. jiroveci, uso de antifúngicos previo a la toma de las concentraciones de BDG o neutropenia < 500 céls/mm3.
Para los pacientes que cumplieron los criterios de inclusión y que él o su representante aceptaron participar (firma del consentimiento informado), se registraron datos demográficos y clínicos como edad, sexo, co-morbilidades, tratamiento antimicrobiano, enfermedad que motivó el ingreso a unidad de mayor complejidad, antecedentes de cirugía, resultado de exámenes de laboratorio, cultivos e imagenología, uso de fármacos inmunosupresores y antifúngicos, uso de nutrición parenteral total central, puntaje APACHE-II y “Candida-score”20.
Se obtuvieron muestras para BDG en dos días consecutivos, recolectadas en tubos estériles sin anticoagulante y libres de BDG. No se tomaron decisiones clínicas basadas en los niveles de BDG obtenidos. Los pacientes fueron manejados según los criterios del equipo tratante.
Definiciones
Candidemia: aislamiento de Candida spp. en uno o más hemocultivos.
Candidiasis invasora: aislamiento de Candida spp. en una muestra de líquido o tejido corporal estéril (por ejemplo: líquido pleural, pericárdico) o la documentación histológica de la presencia de levaduras en tejido.
Para evaluar el rendimiento del test se utilizaron estas definiciones de C y CI como estándar de oro, que corresponden a la categoría de EFI demostrada según los criterios vigentes publicados por EORTC/MSG21.
Para la medición del BDG se utilizó el test colorimétrico Fungitell® (Associates of Cape Cod, USA). El suero se separó en tubos libres de BDG y fue congelado a −80°C hasta la realización del test, en duplicado, siguiendo las instrucciones del fabricante. Brevemente, se incubaron a 37°C por 10 min, 5 μL de muestra con 20 μL de reactivo alcalino de pre-tratamiento. En una placa de microtitulación, se agregó 25 μL de cada punto de la curva de calibración, de control negativo y de las muestras pretratadas. Por último, 100 μL de reactivo Fungitell® fueron agregados a cada pocillo de reacción. Las muestras fueron leídas durante 40 min a 37°C en lector MULSTISKAN FC, hermo SCIENTIFIC®. Se consideró 80 pg/mL como punto de corte para informe de positividad.
De acuerdo a los resultados de los exámenes obtenidos durante la estadía en la UPC, los pacientes se clasificaron en dos grupos: con C/CI o sin infección fúngica invasora. Posteriormente se correlacionó el resultado de BDG con las categorías diagnósticas.
La significación estadística se calculó con test de χ2 o Fisher en caso de valores < a 5 para variables categóricas y con Mann Whitney para variables continuas, considerándose una diferencia estadísticamente significativa un valor p < 0,05.
Este estudio fue aprobado por el Comité de Ética de Investigación de la Facultad de Medicina de la Pontificia Universidad Católica de Chile, solicitándose el consentimiento informado a cada paciente seleccionado o su representante previo a su participación (proyecto 11-047. Aprobado el 19 de mayo 2011).
Resultados
Durante el período de estudio se hospitalizaron en UPC un total de 3.850 pacientes adultos, de ellos 43 (1,1%) cumplieron los criterios de inclusión. Sin embargo, siete pacientes se excluyeron: tres pacientes por lograr toma sólo de una muestra de BDG, dos casos porque el foco de infección se identificó con posterioridad a las 48 h, en un caso por plasma ictérico y uno por plasma lipídico, con lo que finalmente un total de 36 pacientes fueron incluidos.
Características de los pacientes
El promedio de edad fue de 59 años (rango: 19 a 88 años); 20 (56%) correspondieron a individuos de sexo masculino y 32 (88%) se incluyeron por fiebre prolongada, sin respuesta al uso de antimicrobianos de amplio espectro. Treinta y un pacientes (86%) tenía alguna comorbilidad, siendo la más frecuente hipertensión arterial (60%), seguido por enfermedad pulmonar obstructiva crónica (17%), diabetes mellitus y/o dislipidemia (11%). Los diagnósticos de ingreso a UPC fueron sepsis (n: 15; 41,7%), neumonía (n: 8; 22,2%), hemorragia subaracnoidea (n: 5; 13,9%), pancreatitis (n: 3; 8,3%), hemorragia digestiva baja (n: 1; 2,8%), status no convulsivo (n: 1; 2,8%), post-operatorio de cáncer esofágico (n: 1; 2,8%) hematoma retroperitoneal (n: 1; 2,8%) y edema pulmonar agudo (n: 1; 2,8%). El promedio de estadía en UPC previo a la inclusión fue de 9 días (rango: 7 a 39 días).
Los factores de riesgo identificados de EFI por Candida spp. fueron: uso de antimicrobianos de amplio espectro (100%), presencia de catéter venoso central (64%), post-operatorio < 30 días de cualquier causa (42%), sepsis grave o shock séptico (36%), nutrición parenteral total central (30%), APACHE-II > 20 (16,6%), colonización por Candida spp. y hemodiálisis en dos pacientes cada uno (5%).
Resultados de BDG
En cinco pacientes resultó positivo (≥ 80 pg/mL) en ambas muestras, con un valor promedio ± SD de 351,4 ± 172 pg/mL. En cinco casos se obtuvo valores discordantes (una muestra positiva y otra negativa) con un valor de 84,3 ± 54,3 pg/mL (p: 0,001 respecto grupo BDG positivo) y en 26 casos el resultado fue negativo en ambas muestras con un promedio de 41,6 ± 13,2 pg/mL (p < 0,0001 respecto grupo BDG positivo).
Resultados microbiológicos
En seis casos se documentó EFI por Candida spp. (dos casos de candidemia, dos casos de peritonitis, un caso de empiema pleural y un caso con cultivo positivo tanto de punta de CVC como hematoma de muslo) y en 30 casos no se documentó EFI: 27 casos con cultivos negativos y tres casos con cultivos positivos interpretados como colonización o contaminación, dos casos con Candida spp. (2 de orina) y un caso con Aspergillus fumigatus (en aspirado endotraqueal, caso en que el galactomanano en sangre fue negativo y no recibió tratamiento específico).
Correlación entre resultados de BDG y microbiológicos E
En la Tabla 1 se presentan los datos de los casos, agrupados por resultado de BDG, incluyendo edad, sexo, diagnóstico al ingreso, factores de riesgo, Candida-score, resultado de cultivos y diagnóstico de EFI al egreso de UPC, si correspondían a C/CI o no.
En el grupo de pacientes con BDG positivo, destaca que en aquellos casos en que se documentó candidemia el valor fue consistentemente > 500 pg/mL; en otro caso los hemocultivos fueron negativos, pero tuvo aislamiento de Candida de dos sitios, evolucionó favorablemente con uso de antifúngicos egresando de UPC con diagnóstico de EFI. Por el contrario, hubo dos casos sin identificación de Candida spp. en cultivos; uno de ellos, por el diagnóstico de úlceras colónicas recibió antifúngicos sin poder confirmarse C/CI; en cambio, el otro paciente evolucionó favorablemente sólo con terapia antibacteriana por lo que la impresión clínica fue que no presentó EFI.
En los cinco casos con valores discordantes entre las dos muestras de suero obtenidas, no hubo identificación de Candida en hemocultivos; en tres pasos el valor positivo de BDG fue escasamente elevado sobre el punto de corte y tampoco hubo identificación de Candida en los otros cultivos. En cambio, en los otros dos casos el valor positivo fue al menos el doble del punto de corte más algún cultivo positivo con Candida, pero sólo en uno se diagnosticó EFI; en el otro caso con cultivo positivo en orina se consideró contaminación.
Finalmente, en el grupo de pacientes con BDG negativos, no hubo casos de C, sólo dos se catalogaron de CI: uno en el contexto de una peritonitis donde hubo identificación de Candida en líquido peritoneal y el otro en que hubo identificación de C. albicans, tanto en la punta de catéter como en un hematoma de muslo.
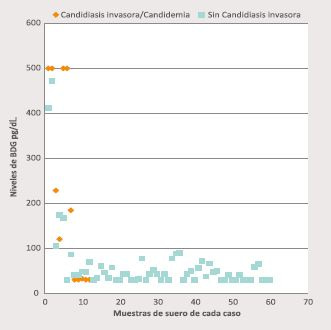
En la Figura 1 se grafica la distribución de los valores obtenidos de cada paciente según categoría diagnóstica, con o sin EFI por Candida spp. Las muestras de los casos catalogados con C o CI evidencian valores más elevados comparados con aquellas muestras de pacientes sin estas dos condiciones. El valor promedio de BDG en los pacientes con diagnóstico de C/CI fue de 224,3 ± 213,7 pg/mL y en aquellos sin C/CI fue de 63,8 ± 76,7 pg/mL (p: 0,02).
Figura 1. Distribución de los resultados de valores de BDG obtenidos diferenciados según categoría diagnóstica: con o sin candidiasis invasora/candidemia. Cada punto representa el resultado obtenido de cada muestra, los valores BDG > 500 pg/mL se grafican como 500 pg/mL y los < 31 pg/mL como 31 pg/mL.
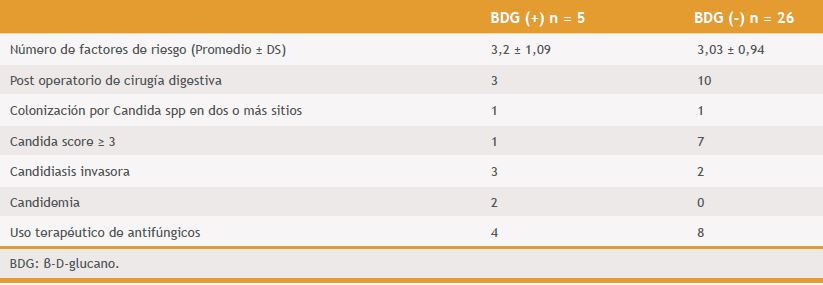
Al comparar los pacientes con resultado de BDG positivo vs negativo, se destaca la similitud en el promedio de factores de riesgo 3,2 ± 1,09 vs 3,03 ± 0,94; mayor frecuencia relativa de pacientes que cursaban post-operatorio de cirugía digestiva; mayor frecuencia de CI y de C, respectivamente (Tabla 2).
Tabla 2. Tabla comparativa de características clínicas de pacientes con resultados de BDG positivos y negativos (no se incluyen los datos de pacientes con resultados discordantes).
La sensibilidad y especificidad de BDG para diagnóstico de C/CI con dos muestras consecutivas concordantes, fue de 60 y 92%, respectivamente. El valor predictor positivo (VPP) fue de 60% y el valor predictor negativo (VPN) de 92%.
Discusión
El diagnóstico de C/CI es un desafío clínico mayor. Es conocido que el inicio oportuno del tratamiento antifúngico está limitado por el rendimiento de las pruebas diagnósticas habituales y se ha demostrado que esta brecha de tiempo se asocia a aumento de mortalidad22. Los signos clínicos de infección son inespecíficos, la confirmación por hemocultivos requiere tiempos de incubación prolongados y su sensibilidad no supera el 50%5,23,24. En cuanto a otras candidiasis invasoras, los cultivos de diferentes muestras, aunque resulten positivos, conllevan en algunos casos la dificultad de diferenciar si constituyen infección o colonización. La evaluación de los factores de riesgo2,4,23, colonización25, el uso de sistema de puntaje como Candida-score20,26, o las reglas predictoras27,28 sirven de orientación para focalizar la sospecha clínica en grupos de pacientes, pero el problema diagnóstico persiste. En este contexto, la incorporación de bio-marcadores significa una oportunidad de mejorar la capacidad diagnóstica y en consecuencia el inicio de la terapia antifúngica en ausencia de confirmación microbiológica.
En el presente estudio exploratorio del aporte de BDG en nuestro medio, que incluye pacientes en UPC de alto riesgo de infecciones invasoras por Candida spp., en un contexto clínico en que se plantea frecuentemente esta posibilidad etiológica, los resultados sugieren que efectivamente BDG parece ser una herramienta útil en el apoyo diagnóstico de C/CI.
El promedio de BDG fue significativamente más elevado en pacientes con C/CI que en los pacientes sin infección fúngica demostrada. Un estudio conducido por Del Bono y cols., demostró que a mayores valores aumenta la especificidad y el VPP, con una especificidad de 98% y VPP de 98,5% con valores mayores a 160 pg/mL16.
En la presente experiencia se evidencia que aquellos valores positivos de BDG identifican pacientes con documentación de EFI y mayor frecuencia de algunos factores de riesgo. Al comparar los cinco pacientes con ambas muestras de BDG positivas vs aquellos con BDG negativos, se observó significativa mayor frecuencia de C, más casos con diagnósticos de CI, así como una mayor frecuencia de post operatorio de cirugía digestiva, colonización y de uso de antifúngicos, aunque las diferencias no fueron estadísticamente significativas, probablemente por bajo número de pacientes.
No se observó diferencias en días de estadía en UPC, Candida-score en número de factores de riesgo para candidiasis invasora. De los cinco pacientes, hubo dos en quienes no se pudo demostrar una infección fúngica por cultivos (casos 2 y 5, Tabla 1). De estos dos pacientes, uno recibió tratamiento antifúngico empírico por sus antecedentes clínicos de hemorragia digestiva y úlceras colónicas (caso 5) y el otro no recibió antifúngicos evolucionando favorablemente con tratamiento antibacteriano (caso 2). Es plausible que el caso 5 haya presentado C intermitente o con muy baja carga fúngica de origen abdominal que no fuera detectada a través de los hemocultivos, pero las concentraciones consistentemente tan elevadas de BDG sugieren fuertemente que existía C/CI aunque no se haya podido certificar microbiológicamente. En cambio, en el caso 2 no fue posible interpretar el resultado, no se puede descartar un falso positivo favorecido por la presencia de algún factor no descrito.
Treinta por ciento de los pacientes con resultados de BDG negativo recibió antifungicos por sus antecedentes clínicos. En ninguno de estos pacientes tratados se pudo demostrar infección o colonización fúngica. La evolución fue favorable en los pacientes con y sin tratamiento
antifúngico.
Hubo cinco pacientes con valores de BDG discordantes, con un valor positivo y otro negativo. No se evidenciaron causas conocida de falsos positivos de BDG en el caso de los cuatro pacientes considerados sin EFI y en ninguno de ellos se indicó antifúngicos cursando con buena evolución clínica. En los pacientes con BDG discordante no se observó una tendencia al alza en los valores de BDG en los días consecutivos, ya que no en todos los casos la primera muestra fue la de menor valor. Se debe explorar en nuevos estudios el comportamiento en el tiempo, a través de muestras sucesivas, la tendencia de los resultados para catalogar mejor la posibilidad de una EFI apoyando el inicio o no de antifúngicos.
En general, se observó una baja frecuencia de colonización por Candida spp. en dos o más sitios en ambos grupos, sin diferencias entre los pacientes con BDG positivo vs negativo, pero se debe aclarar que en nuestro centro no es una práctica rutinaria realizar estudios de colonización; para efectos de este estudio, se registró colonización en muestras que fueron interpretadas de este modo durante el cuidado del paciente por lo que podría existir una subvaloración del rol de la colonización en la evaluación de estos pacientes.
Si bien es cierto que nuestra experiencia fue limitada por el bajo número de pacientes reclutados y la baja frecuencia de casos de infección por Candida spp. demostrada por cultivos, los valores de sensibilidad, especificidad y VPN obtenidos son similares a los encontrados en otros estudios que evalúan el rendimiento diagnóstico de esta prueba diagnóstica9,12,13,15 incluyendo pacientes críticos post-cirugía29.
Por lo tanto, podemos plantear que, en la práctica clínica, el resultado positivo de dos muestras consecutivas permite identificar a un grupo de pacientes críticos con mayor posibilidad de estar cursando una C/CI, lo que justifica el inicio precoz de antifúngicos. En este sentido, un estudio piloto, randomizado, en pacientes en unidades críticas realizado por Hanson KE y cols., investigó el rol de BDG ≥ 60 pg/mL como herramienta para decidir inicio de tratamiento antifúngico comparado con el inicio de tratamiento empírico según criterios clínicos; si bien no hubo diferencias en el número de EFI probadas o probables entre ambos grupos ni en la frecuencia de uso de antifúngicos, los autores destacaron la diferencia significativa en los valores promedio de BDG entre ambos grupos (117 pg/mL vs 28 pg/ mL grupo manejado en base a BDG vs empírico), el VPN 100% de la prueba y el aumento de la especificidad con valores secuenciales positivos, dejando planteado que con un umbral de positividad del BDG ≥ 80 pg/mL en dos muestras consecutivas se habría logrado la reducción de la indicación de antifúngicos en 50% sin perder casos de EFI vs el grupo empírico30.
En un estudio reciente de Pang YK y cols., para evaluar la vigilancia con BDG a los pacientes de unidades críticas e inicio precoz de antifúngicos según su resultado versus el enfoque estándar, demostraron el beneficio de costoefectividad de la vigilancia activa y que, si bien existe un costo al incluir la prueba diagnóstica, el beneficio fue significativo en disminuir la mortalidad por C y la disminución de pérdida de años ajustados a calidad de vida (del inglés QALY)31. Este resultado es un argumento a favor de incluir en rutina pruebas diagnósticas que permitan decidir incluir precozmente antifúngicos en la terapia de los pacientes críticos.
Otra utilización de la prueba de BDG es como herramienta adicional para definir la suspensión de tratamientos antifúngicos empíricos en pacientes de alto riesgo con cultivos negativos para hongos y BDG negativo dado su alto VPN. De hecho, recientemente Nucci y cols., publicaron una serie en que pacientes críticos en riesgo de EFI por Candida que habían iniciado empíricamente equinocandinas, en caso de obtener hemocultivos y BDG negativos en muestras sucesivas, suspendieron el antifúngico sin deterioro clínico de los pacientes ni evidencias posteriores de candidemia32. También se ha evaluado asociar la medición de BDG a otros marcadores, como el anticuerpo al tubo germinativo de C. albicans que con su alta correlación permitiría suspender antifúngicos empíricos al obtenerse resultados negativos33.
Asimismo, BDG podría ser una herramienta para diferenciar colonización vs infección en cultivos de líquido peritoneal positivos para Candida spp. obtenidos durante cirugía abdominal y en casos de urocultivo positivo en pacientes de riesgo en cuyos casos valores negativos o discordantes en muestras consecutivas podría traducir colonización. Estas dos posibilidades de uso de BDG no han sido evaluadas en pacientes críticos por lo que son interesantes áreas de estudio a futuro.
Quedan otros aspectos por conocer mejor, por ejemplo, cómo avanzar en el diagnóstico de pacientes con valores discordantes o su uso como seguimiento del tratamiento de candidiasis invasoras documentadas, por lo que es importante seguir construyendo la experiencia en su uso en pacientes críticos.
En conclusión, la evaluación inicial del desempeño de BDG sugiere que es posible considerar su utilización en rutina como un examen de apoyo en el diagnóstico de C/CI en pacientes críticos con factores de riesgo; su uso a mayor escala en otros escenarios clínicos de pacientes en riesgo de EFI requiere evaluaciones adicionales, idealmente incorporando otros centros, e incluyendo análisis de costo efectividad.
Financiamiento: Pfizer aportó los reactivos para medición de BDG pero no participó en el diseño ni el análisis de los resultados.
Referencias Bibliográficas
1.- Vincent J L, Rello J, Marshall L, Silva E, Anzueto A, Martin C D, et al; EPIC II Group of Investigators. International study of the prevalence and outcomes of infection in intensive care units. J AMA 2009; 302: 2323-9.
2.- Rüping M J, Vehreschild J J, Cornely O A. Patients at high risk of invasive fungal infections: when and how to treat. Drugs 2008; 68: 1941- 62.
3.- Bouza E, Muñoz P. Epidemiology of candidemia in intensive care units. Int J Antimicrob Agents 2008; 32 Suppl. 2: S87-S91.
4.- Pfaller M A, Diekema D J. Epidemiology of invasive candidiasis: A persistent public health problem. Clin Microbiol Rev 2007; 20: 133-63.
5.- Marr K A, Carter R A, Crippa F, Wald A, Corey L. Epidemiology and outcome of mould infections in hematopoietic stem cell transplant recipients. Clin Infect Dis 2002; 34: 909-17
6.- Prella M, Bille J, Pugnale M, Duvoisin B, Cavassini M, Calandra T, et al. Early diagnosis of invasive candidiasis with mannan antigenemia and antimannan antibodies. Diagn Microbiol Infect Dis 2005; 51: 95-101.
7.- Walsh T J, Merz W G, Lee J W, Schaufele R, Sein T, Whitcomb P O, et al. Diagnosis and therapeutic monitoring of invasive candidiasis by rapid enzymatic detection of serum D-arabinitol. Am J Med 1995; 99: 164-72.
8.- Alam F F, Mustafa A S, Khan Z U. Comparative evaluation of (1, 3)-beta- D-glucan, mannan and anti-mannan antibodies, and Candida species- specific SnPCR in patients with candidemia. BMC Infect Dis 2007; 7: 103.
9.- Senn L, Robinson J O, Schmidt S, Knaup M, Asahi N, Satomura S, et al. 1,3-Beta-D-glucan antigenemia for early diagnosis of invasive fungal infections in neutropenic patients with acute leukemia. Clin Infect Dis 20 08; 46: 878-85.
10.- Odabasi Z, Mattiuzzi G, Estey E, Kantarjian H, Saeki F, Ridge R J, et al. Beta-D-glucan as a diagnostis adjunct for invasive fungal infections: validation, cutoff development, and performance in patients with acute myelogenous leukemia and myelodysplastic syndrome. Clin Infect Dis 2004; 39: 1 99-205.
11.- Hachem R Y, Kontoyiannis D P, Chemaly R F, Jiang Y, Reitzel R, Raad I. Utility of galactomannan enzyme immunoassay and (1,3) Beta-D-glucan in diagnosis of invasive fungal infections: low sensitivity for Aspergillus fumigatus Infection in hematologic malignancy patients. J Clin Microbiol 2009; 47: 129-33.
12.- Ellis M, Al-Ramadi B, Finkelman M, Hedstrom U, Kristensen J, Ali-Zadeh H, et al. Assessment of the clinical utility of serial beta-D-glucan concentrations in patients with persistent neutropenic fever. J Med Microbiol 2008; 57: 287-95.
13.- Karageorgopoulos D, Vouloumanou E K, Ntziora F, Michalopoulos A, Rafailidis P I, Falagas M E. B-D-glucan assay for the diagnosis of invasive fungal infections: A meta-analysis. Clin Inf Dis 2011; 52: 750-70.
14.- Presterl E, Parschalk B, Bauer E, Lassnigg A, Hajdu S, Graninger W, et al. Invasive fungal infections and (1,3)-Beta-D-glucan serum concentrations in long term intensive care patients. Int J Infect Dis 2009; 13: 707-12
15.- Ostrosky-Zeichner L, Alexander B D, Kett D H, Vázquez J, Pappas P G, Saeki F, et al. Multicenter clinical evaluation of the (1→3) B-D-glucan assay as an aid t o diagnosis of fungal infections in humans. Clin Infect Dis 20 05; 41: 654-9.
16.- Del Bono V, Delfino E, Furfaro E, Mikulska M, Nicco E, Bruzzi P, et al. Clinical performance of the (1,3)-B-D-glucan in early diagnosis of nosocomial candida bloodstream infections. Clin Vacc Immunol 2011; 18: 2113-7.
17.- Desmet S, Van Wijngaerden E, Maertens J, Verhaegen J, Verbeken E, De Munter P, et al. Serum (1-3)-Beta-D-glucan as a tool for diagnosis of Pneumocystis jirovecii pneumonia in patients with human immunodeficiency virus infection or hematological malignancy. J Clin Microbiol 2009; 47: 3871-4.
18.- Acosta J, Catalan M, Del Palacio-Pérez-Medel A, Lora D, Montejo J C, Cuetara M S, et al. A Prospective comparison of galactomannan in bronchoalveolar lavage fluid for the diagnosis of pulmonary invasive aspergillosis in medical patients under intensive care: comparison with the diagnostic performance of galactomannan and of (1→3) – B – D-glucan chromogenic assay in serum samples. Clin Microbiol Infect 2011; 17: 1053- 60.
19.- Siri L, Legarraga, P, García P, González T, Rabagliati R. Cambios clínicos y epidemiológicos de candidemias en pacientes adultos desde 2000 a 2013. Rev Chilena Infectol 2017; 34, 19-26.
20.- León C, Ruiz-Santana S, Saavedra P, Almirante B, Nolla-Salas J, Alvarez- Lerma F, et al. A bedside scoring system (“Candida score”) for early antifungal treatment in nonneutropenic critically ill patients with Candida colonization. Crit Care Med. 2006; 34: 730-7.
21.- De Pauw B, Walsh T J, Donnelly J P, Stevens D A, Edwards J E, Calandra T, et al. Revised definitions of invasive fungal disease from the european Organization for Research and Treatment of Cancer/Invasive Fungal Infections Cooperative Group and the National Institute of Allergy and Infectious Diseases Mycoses Study Group (EORTC/MSG) Consensus Group. Clin Infect Dis 2008; 46: 1813-21.
22.- Garey K W, Rege M, Pai M P, Mingo D E, Suda K J, Turpin R S, et al. Time to initiation of fluconazole therapy impacts mortality in patients with candidemia: a multi-institutional study. Clin Infect Dis 2006; 43: 25-31.
23.- Gullo A. Invasive fungal infections. The challenge continues. Drugs 2009; 69 Suppl. 1: 65-73.
24.- Pemán J, Almirante B. Advances in the diagnosis and treatment of yeast infections: role of the new antifungal agents. Enferm Infecc Microbiol Clin 2008; Suppl. 13: 38-46.
25.- Pittet D, Monod M, Suter P M, Frenk E, Auckenthaler R. Candida colonization and subsequent infections in critically ill surgical patients. Ann Surg 1994; 220: 751-8.
26.- León C, Ruiz-Santana S, Saavedra P, Galván B, Blanco A, Castro C, et al. Cava Study Group. Usefulness of the “Candida Score” for discriminating between candida colonization and invasive candidiasis in non-neutropenic critically ill patients: A prospective multicenter study. Crit Care Med 2009; 37: 1624-33.
27.- Ostrosky-Zeichner L, Sable C, Sobel J, Alexander B D, Donowitz G, Kan V, et al. Multicenter retrospective development and validation of a clinical prediction rule for nosocomial invasive candidiasis in the intensive care setting. Eur J Clin Microbiol Infect Dis 2007; 26: 271-6.
28.- Guillamet C V, Vázquez R, Micek S T, Ursu O, Kollef M. Development and validation of a clinical prediction rule for candidemia in hospitalized patients with severe sepsis and septic shock. J Crit Care. 2015; 30: 715-20.
29.- Prattes J, Hoenigl M, Rabensteiner J, Raggam RB, Prueller F, Zollner-Schwetz I, et al. Serum 1,3-beta-D-glucan for antifungal treatment stratification at the intensive care unit and the influence of surgery. Mycoses 2014; 57: 679-86.
30.- Hanson K E, Pfeiffer C D, Lease E D, Balch A H, Perfect J R, Alexander B D. B-D-glucan surveillance with preemptive anidulafungin for invasive candidiasis in intensive care units: a randomized pilot study. Plos One 2012; 7: e42282.
31.- Pang Y K, Ip M, You J H. Potential clinical and economic outcomes of active beta-D-glucan surveillance with preemptive therapy for invasive candidiasis at intensive care units: a decision model analysis. Eur J Clin Microbiol Infect Dis 2016 Sep 29. doi:10.1007/s10096-016-2796-4.
32.- Nucci M, Nouér S A, Esteves P, Guimarães T, Breda G, de Miranda B G, et al. Discontinuation of empirical antifungal therapy in ICU patients using 1,3-β-D-glucan. J Antimicrob Chemother 2016; 71: 2628-33.
33.- Martínez-Jiménez M C, Muñoz P, Valerio M, Vena A, Guinea J, Bouza E. Combination of Candida biomarkers in patients receiving empirical antifungal therapy in a Spanish tertiary hospital: a potential role in reducing the duration of treatment. J Antimicrob Chemother 2015; 70: 3107-15.
Los autores declaran ausencia de conflictos de interés This is an Open Access article distributed under the terms of the Creative Commons ttribution Non-Commercial License, which permits unrestricted non-commercial use, distribution, and reproduction in any medium, provided the original work is properly cited.






