El laboratorio en Trombofilia
Bioq. M. Gabriela Alegre
Product Team Wiener
NotiWiener N° 163- Abril 2014
http://notiwiener.com.ar/2014/03/el-laboratorio-en-trombofilia/
Correspondencia: malegre@wiener-lab.com.ar
¿Cómo definimos la trombofilia?
Las trombofilias son un grupo heterogéneo de condiciones asociadas a un mayor riesgo de aparición de trombosis arteriales, venosas o ambas.
Se clasifican en hereditarias, adquiridas o circunstanciales (Figura 1 ver a la derecha). Se producen debido a una alteración funcional de algún factor relacionado con el proceso de coagulación que aumenta la predisposición a la formación de trombosis. El estado de hipercoagulabilidad se favorece por la alteración, tanto de los sistemas anticoagulantes como procoagulantes.
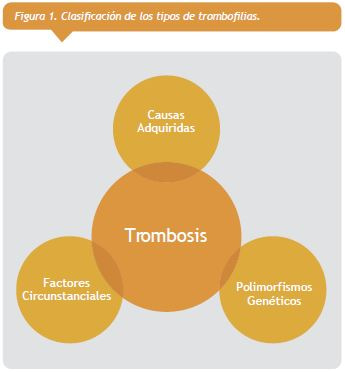
En muchos casos, no basta la presencia de un solo factor, sino que la suma de los factores de riesgo llega a traspasar un umbral que finalmente determina la formación del coágulo. generalmente, esta suma equivale a una asociación de circunstancias externas y una predisposición heredada o adquirida del sujeto a la trombosis. Sólo un 30-40% pareciera ser espontáneos. De esto se infiere que el hecho de ser portador de un defecto congénito protrombótico no es una causa, sino un factor de riesgo más para el desarrollo de trombosis. Por ello, existe convicción en la actualidad que el fenómeno tromboembólico es una enfermedad multicausal.
Panorama del origen multicausal
Polimorfismos genéticos
En el caso de las alteraciones genéticas, la trombofilia puede producirse a causa de una pérdida o ganancia de funciones (Tabla 1 ver a la derecha). La proteína C (PC), la proteína S (PS) y la antitrombina III (AT) son conocidas como anticoagulantes naturales.
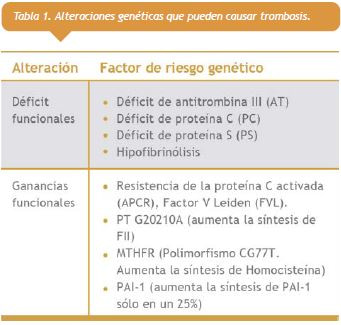
La proteína C, junto con la proteína S que actúa como cofactor, inhiben los factores V y VIII activados. El déficit congénito de cualquiera de los anticoagulantes naturales establece un desequilibrio y predispone a la enfermedad tromboembólica venosa (ETEV).
Factor V Leiden (FVL) es la causa hereditaria más común de trombosis venosa. Es causada por una sola sustitución de nucleótidos que sin sentido R506Q, resultante en la resistencia del factor V a la proteína C activada (APC). Los portadores de FVL tienen una mayor susceptibilidad a la trombosis venosa.
La hiperhomocisteinemia por MTHFR, se diferencia de otras trombofilias heredadas en que no se asocia a un defecto genético de las proteínas de la cascada de la coagulación. De hecho, la homocisteína es tóxica para las células endoteliales, incitando a una reacción trombótica y aterosclerótica, tanto en el territorio arterial. La Homocisteína es un aminoácido, intermediario del metabolismo de la metionina. Es convertido de vuelta a metionina por la metilenetetrahidrofolato reductasa (MTHFR) o por la homocisteína metiltransferasa.
Cuando se produce un defecto de cualquiera de estas vías se produce un aumento de los niveles de homocisteína.
Se debe sospechar el estado de hipercoagulabilidad primaria o trombofilia heredada cuando está presente al menos una de las siguientes características: ETEV a edad temprana (menos de 50 años), episodios trombóticos repetidos, ocurrencia en sitios anatómicos inusuales o historia familiar positiva de trombosis.
Alteraciones adquiridas
• Síndrome antifosfolípidos (SAF): es una enfermedad autoinmune que ocurre en pacientes con trombosis vascular, complicaciones gestacionales o ambas.
• Hiperhomocisteinemia (HHcys) adquirida: Deficiencias de vitaminas B6, B12 y folato, que son cofactores necesarios para la metilación, pueden resultan en niveles elevados de homocisteína.
• Resistencia a la Proteína C Activada sin Factor V Leiden (APCR sin FVL): la APCR también se describe en pacientes sin FVL (APCR adquirida) asociada a la presencia de anticoagulante lúpico, embarazo y neoplasias.
Alteraciones circunstanciales
En el caso de las alteraciones circunstanciales, la trombofilia puede deberse a factores como Embarazo, Inmovilidad (prolongada o por viajes largos), Trauma, Postoperatorio, Anticonceptivos orales, estrógenos, Síndrome antifosfolípidos y otros (malignidad, síndrome nefrótico, síndrome mieloproliferativo, hemoglobinuria paroxística nocturna).
Frecuencia de las causas
Las causas de trombofilia poseen distintas frecuencias (Tabla 2). En las ATIII, PC y PS si bien la prevalencia es baja, el riesgo relativo de trombosis es alto, llegando a un 35-50% para la ATII.

¿En qué pacientes se estudia?
No todo paciente que ha tenido un evento trombótico agudo debe ser estudiado. La investigación de trombofilia se realiza fundamentalmente para tomar conductas profilácticas y/o terapéuticas importantes ante situaciones predisponentes en aquellos portadores de la alteración (pacientes o familiares). En la decisión de realizar el estudio, además, deben primar las características:
• Trombosis espontánea
• Pérdida de embarazo principalmente, tardíamente.
• Personas jóvenes (menores a 45 años)
• Recurrencia intra tratamiento
• Eventos Venosos: en sitios infrecuentes y de presentación espontánea
• Eventos Arteriales: sin factores de riesgo previos
• Historia Familiar
• También las siguientes situaciones clínicas son de elección para estudiar trombofilia: púrpura fulminante del neonato, necrosis de piel inducida por el inicio de terapia anticoagulante oral, trombosis recurrente y asociación de trombosis venosa y arterial y de trombosis con pérdidas fetales recurrentes.
Recomendaciones para el estudio de laboratorio e interpretación
El estudio de trombofilia no tiene carácter de urgencia y no debe ser realizado en el momento agudo. El episodio trombótico agudo es considerado un estado inflamatorio en el que muchas proteínas del sistema hemostático se modifican. Por ejemplo, el factor VIII y el fibrinógeno se incrementan por ser reactantes de fase aguda y pueden alterar las pruebas de coagulación. De allí que se recomiende estudiar la trombofilia en un período de al menos 3 meses alejado del episodio agudo. En los casos en que aun estando en la etapa aguda de la trombosis es inevitable realizar el estudio de la trombofilia, se recomienda realizar una nueva determinación después de discontinuar el tratamiento anticoagulante. Las determinaciones de biología molecular no se encuentran alteradas por estas circunstancias.
A la hora del laboratorio en Trombofilia:
1. Realizar un interrogatorio en el momento de la extracción de sangre para conocer historia clínica personal y familiar, uso de anticonceptivos, tratamientos antitrombóticos, etc.
2. La toma de muestras debe hacerse con 8 horas de ayuno. Horario por la mañana.
3. Para la evaluación de homocisteína, el ayuno debe ser de 10-12 horas y la muestra debe ser mantenida en hielo hasta la centrifugación y separación del plasma.
4. Siempre realizar un estudio básico (PT-APTT-TT) para evaluar la acción de anticoagulantes orales o de heparina no fraccionada que influencian la evaluación de proteína C y proteína S, o la determinación de inhibidor lúpico, respectivamente.
5. El basal de PT y APTT, junto con los análisis de rutina del paciente pueden orientar sobre la presencia de hepatopatías que influirá en los niveles bajos de antitrombina III, proteína C y proteína S, entre otras proteínas de síntesis hepática, o la presencia de un síndrome nefrótico en el que disminuye de AT.
6. La proteína S en su fracción libre (40% de proteína S total) es la que tiene el rol de cofactor en la inactivación de FVa, el resto se une a C4BP. Los ensayos coagulantes funcionales presentan problemas de reproducibilidad. Los ensayos inmunológicos (ELISA o inmunoturbidimétricos) son e elección para proteína S.
7. Los pacientes recibiendo anticoagulación no deben ser estudiados. La antitrombina III disminuye durante el tratamiento de la Heparina No Fraccionada (HNF) y las Heparinas de Bajo Peso Molecular (HBPM) interfieren con ciertas pruebas de inhibidor lúpico como el tiempo de veneno de víbora de Russel diluido (dRVVT).
8. Si se estudia un paciente recibiendo heparina cada 12 horas, la muestra de sangre debe ser tomada a la mañana siguiente de haber suspendido la dosis de la noche. Si se recibe heparina en infusión continua, se debe cerrar el goteo por lo menos durante 4 horas antes de la toma de muestra y verificar que el Tiempo de Trombina de la muestra resulte normal.
9. Para pacientes con trombosis recurrentes, se recomienda cambiar de anticoagulantes orales a heparina subcutánea durante por lo menos 10 días y tomar la muestra luego de suspender la última dosis. Esto es debido a que las proteína S y proteína C son proteínas V itamina K dependientes.
10. Los ensayos funcionales deben ser usados para evaluar proteína C y antitrombina III.
11. Los Ensayos cromogénicos para proteína C son más confiables y reproducibles que los de coagulación.
12. Si el ensayo de APCR es usado para tratar de identificar el FVL, debe utilizarse el ensayo con predilución del plasma en plasma deficiente en factor V.
13. En casos de APCR alterado debe evaluarse el FVL por ensayos genéticos.
14. En todo paciente con disminución de AT, PC o PS se debe confirmar la alteración en nueva muestra.
15. Realizar control de calidad interno y externo de las determinaciones utilizadas en trombofilia.











