Diagnóstico de infecciones genitales bajas no virales en pacientes procedentes de la consulta de ginecología infantojuvenil
ARTÍCULO ORIGINAL
Rafael Abreu Duarte1*, Maida López Pérez2, Enma Truffin Truffin2, Noira Durán Morera2, Anisbel Ruíz Ramos3
1Centro Provincial de Higiene, Epidemiología y Microbiología, Santa Clara, Villa Clara, Cuba 2Hospital Provincial Ginecoobstétrico Universitario “Mariana Grajales”, Santa Clara, Villa Clara, Cuba 3Hospital Provincial Pediátrico Universitario “José Luis Miranda”, Santa Clara, Villa Clara, Cuba *Rafael Abreu Duarte. rabreud@nauta.cu
Acta Médica del Centro / Vol. 17 No. 1 Enero-Marzo 2023
Resumen
Introducción: las infecciones genitales bajas no virales constituyen uno de los motivos más frecuentes de consulta médica en Ginecología. La juventud constituye un período vulnerable para el padecimiento de este tipo de infecciones. El diagnóstico microbiológico por las variadas técnicas existentes garantiza precisar la etiología específica que causa la infección genital.
Objetivo: caracterizar las infecciones genitales bajas no virales en jóvenes femeninas procedentes de la Consulta de Ginecología infantojuvenil.
Métodos: se realizó una investigación descriptiva longitudinal prospectiva en el Laboratorio de Microbiología del Hospital “Mariana Grajales” en el período de enero a diciembre de 2019. La muestra quedó constituida por las 91 pacientes que cumplieron con los requisitos de inclusión. Su diagnóstico se realizó según el algoritmo establecido en la sección de infección del tracto reproductor.
Resultados: la vulvovaginitis estuvo presente en el 41,8% de las pacientes, en el 63,2% de las jóvenes con vulvovaginitis se aisló Candida spp., se diagnosticó Ureaplasma spp. en el 22% de los casos, en el 76,9% de las pacientes no se aislaron bacterias patógenas y en el estuche diagnóstico de reacción de la cadena polimerasa el microorganismo más detectado fue el Mycoplasma genitalium en el 16,5% de los casos.
Conclusiones: la vulvovaginitis por Candida spp. fue la forma clínica más frecuente de presentación de las infecciones genitales bajas no virales entre las jóvenes. Ureaplasma spp. fue el microorganismo más detectado mediante el estuche comercial Myco Well D One. En la mayoría de las pacientes no se aislaron bacterias patógenas. El microorganismo más detectado por reacción de la cadena polimerasa fue Mycoplasma genitalium.
Palabras clave: infecciones genitales bajas no virales, jóvenes femeninas, diagnósticas microbiológicas.
ABSTRACT
Introduction: non-viral lower genital infections are one of the most frequent reasons for medical consultation in Gynecology. Youth is a vulnerable period for the development of this type of infections. The microbiological diagnosis by the various existing techniques guarantees to determine the specific etiology causing the genital infection.
Objective: to characterize non-viral lower genital infections in young females from the infantile and juvenile Gynecology Clinic.
Methods: a prospective longitudinal descriptive research was carried out in the Microbiology Laboratory of the “Mariana Grajales” Hospital from January to December 2019. The sample consisted of 91 patients who met the inclusion requirements. Their diagnosis was made according to the algorithm established in the reproductive tract infection section.
Results: vulvovaginitis was present in 41.8% of patients, Candida spp. was isolated in 63.2% of young women with vulvovaginitis, Ureaplasma spp. was diagnosed in 22% of cases, pathogenic bacteria were not isolated in 76.9% of patients and in the polymerase chain reaction diagnostic kit the most detected microorganism was Mycoplasma genitalium in 16.5% of cases.
Conclusions: vulvovaginitis due to Candida spp. was the most frequent clinical presentation of non-viral lower genital infections among young women. Ureaplasma spp. was the most frequently detected microorganism using the Myco Well D One commercial kit. No pathogenic bacteria were isolated in the majority of patients. The most detected microorganism by polymerase chain reaction was Mycoplasma genitalium.
Key words: non-viral lower genital infections; young females; microbiological diagnostics
Introducción
Las infecciones genitales bajas no virales constituyen uno de los motivos más frecuentes de consulta médica en Ginecología y es una importante causa de morbilidad, entre ellas las infecciones de cérvix, vagina, vulva y sus glándulas anexas. Entre los microorganismos más frecuentes de etiología no viral se encuentran Candida spp., causantes de la vaginosis bacteriana, Trichomonas vaginalis, Neisseria gonorrhoeae y Chlamydia trachomatis y algunas especies de Mycoplasma.(1)
La juventud es el período en el que se consolidan los caracteres psicológicos, sociales y biológicos de cada persona; es una etapa de la vida en que se carece de los conocimientos necesarios para la realización de prácticas sexuales organizadas, además se desarrollan los caracteres sexuales en ambos sexos, lo que les hace sentir la necesidad de experimentar nuevas formas de relacionarse. Estas condiciones hacen de esta etapa un período vulnerable para el contagio y el padecimiento de las infecciones genitales.(2) Según la Organización Mundial de la Salud en 2016 cada día más de un millón de personas contraen una infección de transmisión sexual (ITS). Se estima que, anualmente, unos 376 millones de personas contraen alguna de las cuatro siguientes: clamidiasis (127 millones), gonorrea (87 millones), sífilis (seis millones) o tricomoniasis (156 millones).(3)
La infección por Chlamydia trachomatis es la segunda infección genital más frecuente en el mundo y la más común en mujeres jóvenes.(4)
En Cuba se notifican, anualmente, aproximadamente 50 000 casos de ITS, con una tendencia ascendente en los últimos años. Entre las más frecuentes se encuentran la blenorragia, la sífilis, la uretritis no gonocócica, el condiloma acuminado, la tricomoniasis, el herpes simple genital y el virus de inmunodeficiencia humana (VIH).(2)
No existen en Cuba, ni en la Provincia de Villa Clara, estudios precedentes que aborden esta temática de forma específica en este grupo de edades, solo se refiere el estudio realizado en Villa Clara por López Pérez y colaboradores en mujeres atendidas en la Consulta externa de Ginecología, en el que se analizan 222 pacientes: en el 18,9% se observaron células levaduriformes, el 16,2% presentaban vaginosis bacteriana y cuatro pacientes tuvieron diagnóstico de Trichomonas vaginalis.(4)
Las infecciones genitales en la Provincia de Villa Clara representan un problema de salud por la alta incidencia con que se informan, por la cantidad de recursos que se emplean en su diagnóstico y su tratamiento y por la repercusión que tienen en la salud sexual y reproductiva de las jóvenes que las padecen.
Las jóvenes constituyen un grupo sensible por la inmadurez psicológica y biológica en este período de la vida, a su vez también constituye una etapa en la que el diagnóstico adecuado, así como el tratamiento oportuno, pueden dar un giro en la evolución de la enfermedad. Conocer cuáles son las principales características clínicas y microbiológicas de las infecciones genitales en las jóvenes de la provincia constituye una herramienta valiosa para un mejor abordaje diagnóstico, terapéutico y en la prevención de futuras complicaciones. Este trabajo caracteriza las infecciones genitales bajas no virales en jóvenes femeninas procedentes de la Consulta de Ginecología infantojuvenil.
Métodos
Se realizó una investigación descriptiva longitudinal prospectiva en el Laboratorio de Microbiología del Hospital Provincial Ginecoobstétrico Universitario “Mariana Grajales” de la Ciudad de Santa Clara, Provincia de Villa Clara, en el período de enero a diciembre de 2019.
La muestra se seleccionó mediante un muestreo no probabilístico intencional por criterios y quedó constituida por las 91 pacientes que cumplieron con los criterios de inclusión:
- Tener entre 12 y 20 años de edad
- Diagnóstico clínico de infecciones genitales bajas no virales
- Mantener relaciones sexuales
- Aceptar ser incluidas en el estudio.
Las pacientes con sospecha de infecciones genitales bajas referidas desde la Consulta de Ginecología infantojuvenil, una vez confirmado el diagnóstico clínico, fueron remitidas al Laboratorio de Microbiología para la toma de muestras. Estas fueron recogidas, conservadas y procesadas según el algoritmo diagnóstico establecido en la sección de infecciones del tracto reproductor del Laboratorio: se les realizó exudado vaginal para evaluar criterios de Amsel (leucorrea mal oliente, presencia de células guía en el exudado vaginal, prueba de aminas positivo y pH mayor de 4,5), que permitió el diagnóstico de vaginosis bacteriana; cultivo vaginal bacteriológico en Agar Sangre y Agar Mac Conkey, empleado para diagnóstico de otras bacterias patógenas; cultivo micológico en Agar Dextrosa Saboureaud para diagnóstico de especies de Candida; exudado endocervical para emplear el estuche comercial Myco Well D One en el diagnóstico de Mycoplasma hominis, Mycoplasma spp. y Ureaplasma spp. y, por último, se utilizó el exudado vaginal autorecolectable coleccionado junto con 20 ml de orina, muestra que se empleó para realizar reacción de la cadena polimerasa con reverso transcripción (RT-PCR, por sus siglas en inglés, reverse transcriptionpolymerase chain reaction) múltiple en el Laboratorio de Biología Molecular del Centro Provincial de Higiene, Epidemiología y Microbiología de Villa Clara para diagnóstico de Chlamydia trachomatis, Neisseria gonorrhoeae, Mycoplasma genitalium y Trichomonas vaginalis.
Se confeccionó una Guía de observación para la recolección de los datos necesarios en el estudio a partir de la solicitud de examen microbiológico y del Libro de registro del Laboratorio. La información obtenida fue llevada a una base de datos.
Las variables empleadas en la investigación fueron las formas clínicas de presentación (vulvovaginitis, vaginosis, cervicitis y cervicovaginitis) y el diagnóstico de Candida spp., de vaginosis bacteriana, de Mycoplasmas urogenitales, de otras bacterias patógenas y de infecciones genitales por RTPCR múltiple.
Los datos correspondientes a las variables de estudio fueron llevados a ficheros y procesados a través de los programas Microsoft Excel 2016 y SPSS versión 22.
Se hizo uso de la estadística descriptiva como medida de resumen para variables cualitativas, frecuencias absolutas y relativas (números y por ciento).
Se aplicó la prueba de independencia basada en la distribución Chi cuadrado; por limitaciones en esta se tomó el resultado de la prueba exacta de Fisher. Los resultados fueron presentados en tablas.
Se tuvieron presente las normas éticas establecidas en el contexto y los principios bioéticos de autonomía, beneficencia, no maleficencia y justicia. Se obtuvo por escrito el consentimiento informado de las pacientes o en casos de menores de 18 años de sus tutores legales.
Resultados
La vulvovaginitis se diagnosticó en 38 pacientes (41,8%), seguida de la cervicitis (24, 26,3%) y de la vaginosis (17, 18,7%). Solo en 12 (13,2%) de los casos estudiados se realizó diagnóstico clínico de cervicovaginitis.
Al evaluar los resultados de los diferentes diagnósticos aplicados se observó que el 37,4% de las pacientes tuvo Candida spp., la vaginosis bacteriana se diagnosticó en el 24,2%, los Micoplasmas urogenitales en el 25,3% y otras bacterias patógenas en el 23,1% de los casos. También se detectó un 39,6% de positividad mediante la técnica de PCR-multiplex en tiempo real para infecciones genitales.
En la Tabla 1 se reflejó el diagnóstico de Candida spp. con las formas clínicas de presentación y se encontró que, de forma significativa, existe una relación de dependencia entre estas dos variables, y se apreció que el 63,2% de las pacientes con vulvovaginitis tenía diagnóstico de Candida spp.; este microorganismo también se aisló en el 33,3% de las pacientes con cervicovaginitis y, en menor proporción, entre las pacientes con cervicitis y vaginosis.
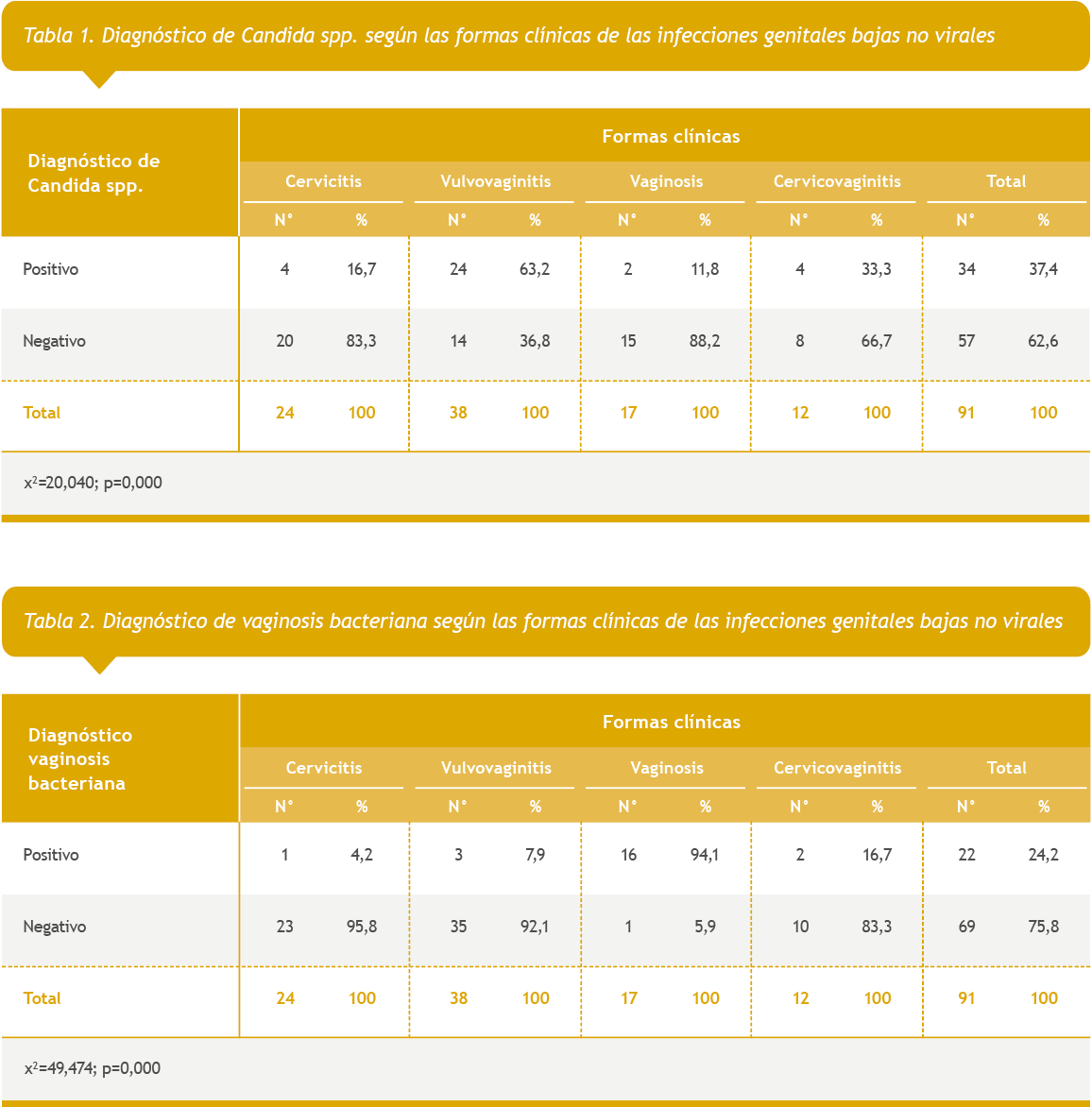
El diagnóstico de vaginosis bacteriana según las formas clínicas de presentación de las infecciones genitales bajas aparece en la Tabla 2. Se apreció, significativamente, que el 94,1% de las pacientes con síntomas de vaginosis tuvieron diagnóstico de vaginosis bacteriana basado en los criterios de Amsel.
La Tabla 3 mostró la relación entre el diagnóstico de Mycoplasmas urogenitales y las formas clínicas de presentación y se observó que la especie que se detectó con más frecuencia fue Ureaplasma spp., presente en el 33,3% de los casos, seguida de Mycoplasma hominis y de solo un caso diagnosticado con Mycoplasma spp. No hubo una relación significativa entre las formas clínicas de las infecciones genitales bajas y la detección de estos microorganismos.
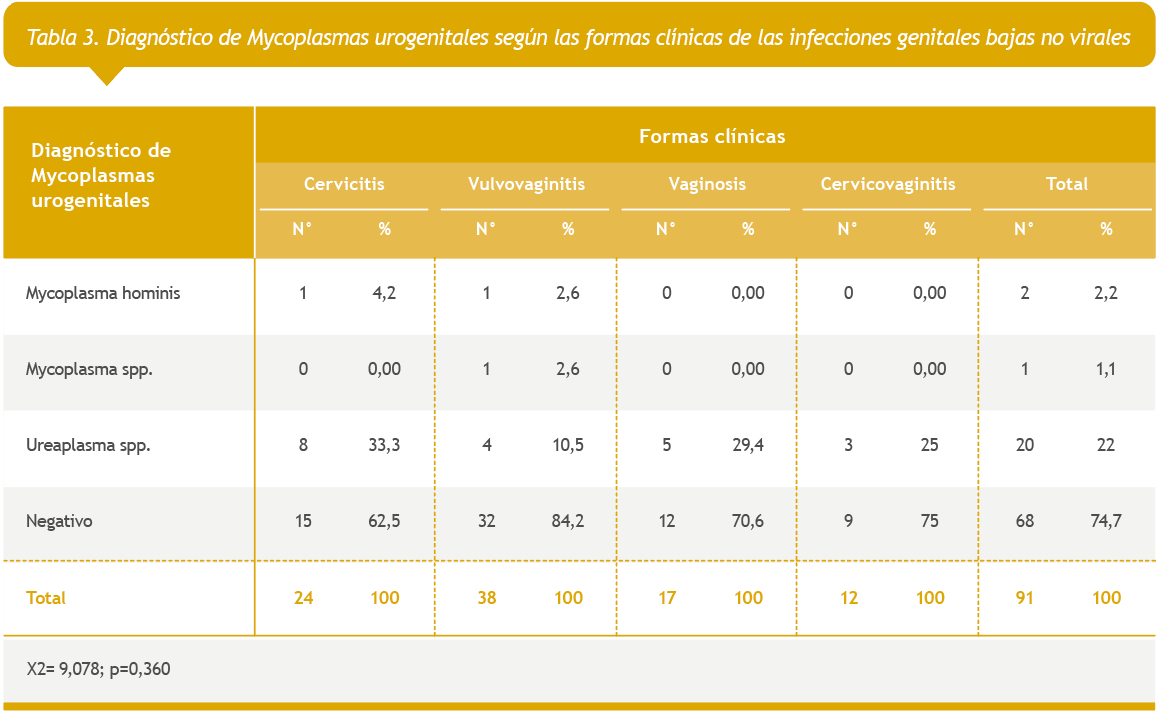
El diagnóstico de otras bacterias patógenas relacionado con las formas clínicas de presentación se mostró en la Tabla 4, en la que se apreció que en el 76,9% de las pacientes no se aíslan bacterias patógenas. No existe relación significativa entre estos aislamientos y las formas clínicas de presentación. A pesar de esto, del total de casos positivos el primer tipo de bacteria, en orden de frecuencia, fueron las enterobacterias, seguidas de los cocos grampositivos y de solo dos casos en los que se aislaron bacilos gramnegativos no fermentadores.
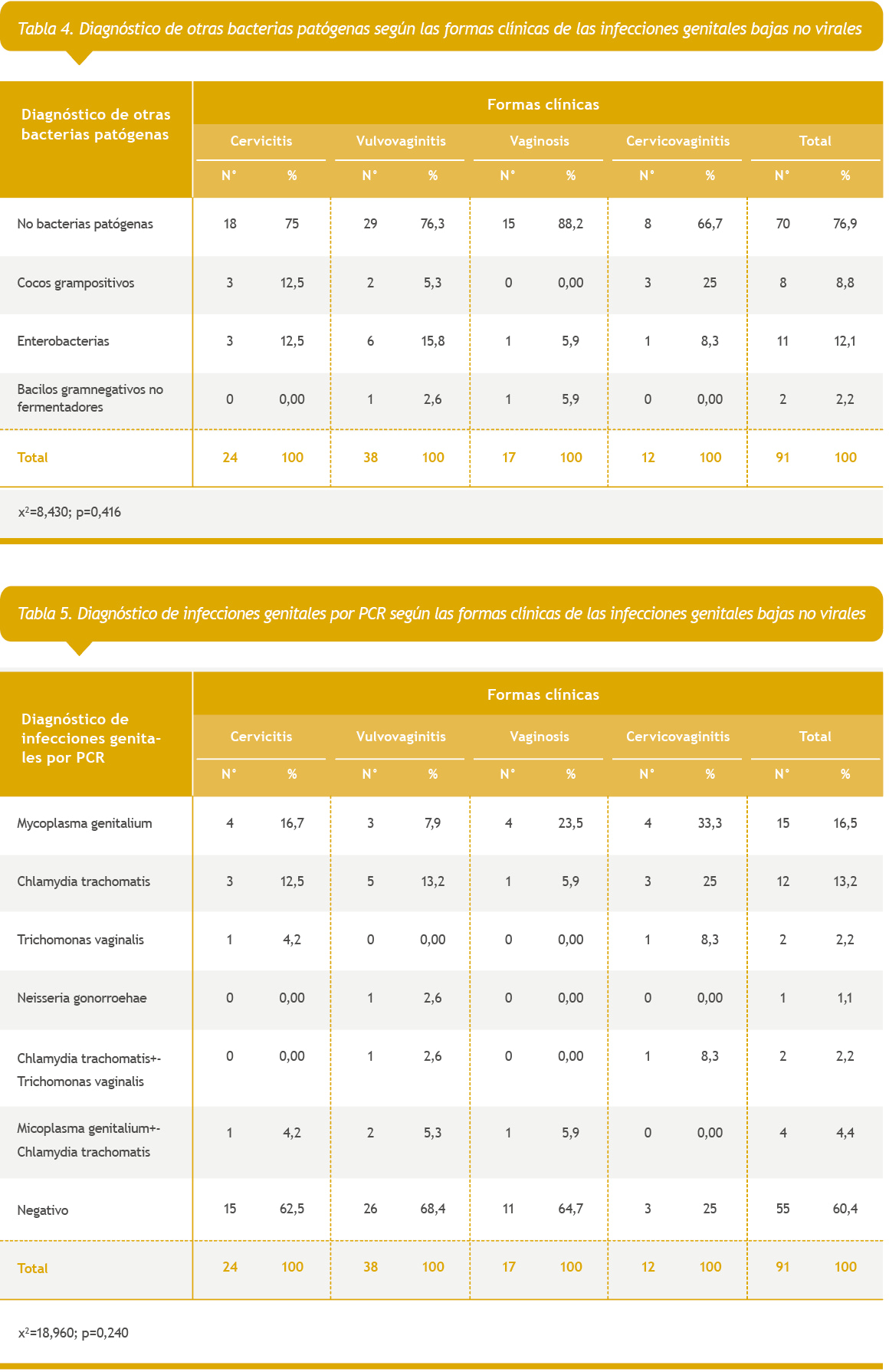
La Tabla 5 mostró la relación entre las formas clínicas de presentación y el diagnóstico de infecciones genitales por RT-PCR múltiple. Se observó que no existe una relación significativa entre estas dos variables; no obstante, el microorganismo más detectado fue el Mycoplasma genitalium (16,5%), seguido de Chlamydia trachomatis (13,2%) y de la coinfección de Mycoplasma genitalium-Chlamydia trachomatis.
Discusión
El diagnóstico de las infecciones genitales entre las jóvenes requiere de un análisis clínico y microbiológico que permita realizar un mejor abordaje terapéutico. Conocer las principales formas clínicas y los microorganismos que las producen representa una herramienta de gran valor en la práctica médica.
En la investigación se observó que la vulvovaginitis es la forma clínica más frecuente de presentación entre las jóvenes. Al realizar el diagnóstico microbiológico se pudo apreciar que la mayor positividad se obtuvo mediante la técnica de PCR múltiple para la detección de infecciones genitales, esta prueba diagnóstica presenta una elevada sensibilidad y permite la detección de Mycoplasma genitalium, Chlamydia trachomatis, Neisseria gonorrhoeae y Trichomona vaginalis; sin embargo, al particularizar en el diagnóstico de cada microorganismo por separado es realmente Candida spp. y la vaginosis bacteriana los que más frecuencia tienen en la población estudiada.
La vulvovaginitis por Candida spp. es la causa infecciosa más frecuente en la adolescencia y un problema común asociado a altos índices de morbilidad.(5,6) Estos resultados coinciden con los de la presente investigación en la que la Candida spp. se encontraba como microorganismo causante de vulvovaginitis en más de la mitad de las jóvenes.
Es válido aclarar que se puede aislar a Candida spp. en paciente con otras formas clínicas de presentación porque puede encontrarse asociada a otros microorganismos e, incluso, formar parte de la flora normal sin provocar los síntomas que comúnmente causan cuando está asociada a vulvovaginitis.
La vaginosis bacteriana también es una enfermedad frecuente en la mujer sexualmente activa, por lo que las jóvenes que ya mantienen relaciones sexuales no están exentas de ese grupo. En la presente investigación se realizó el diagnóstico de esta enfermedad basado en los criterios de Amsel, que relaciona diferentes aspectos clínicos, aunque la mayoría de ellos en la práctica se evalúan en el laboratorio.
La vaginosis bacteriana es la primera causa de infección genital en la mujer sexualmente activa,(7,8,9) lo que no coincide con los resultados de la presente investigación, en la que la vaginosis ocupa el segundo lugar en orden de frecuencia. Este estudio presenta resultados que demuestran la gran variabilidad que puede tener el diagnóstico de la vaginosis bacteriana a nivel mundial y refiere el problema de sobrediagnóstico por el empleo de los criterios de Amsel que, aunque presenta menor sensibilidad y especificidad que otros métodos utilizados para el diagnóstico de vaginosis bacteriana, constituye una herramienta útil a emplear por su bajo costo, su accesibilidad y su fácil implementación en los Laboratorios de Microbiología de las áreas de salud.
Mycoplasma hominis, Ureaplasma spp. y Mycoplasma genitalium se han asociado definitivamente con la enfermedad y con la potencial implicación en la enfermedad del tracto urogenital. La colonización del tracto urogenital por Mycoplasma hominis y Ureaplasma spp. plantea dificultades en la valoración de su aislamiento a partir de muestras procedentes del tracto genitourinario inferior, son necesarios el empleo de métodos de cultivo cuantitativos y el establecimiento de puntos de corte que permitan diferenciar colonización de infección.(10)
Para su diagnóstico se han creado un gran número de métodos basados en cultivos con medios selectivos para la detección de Mycoplasma genitales, como lo es el estuche diagnóstico Myco Well D One. Este estuche comercial permite la detección de Mycoplasma hominis, Ureaplasma spp. y Mycoplasma spp.
Tres estudios muestran que Ureaplasma spp. es el Mycoplasma más frecuentemente aislado en un 70%, un 56,4% y un 15,3% respectivamente de las pacientes estudiadas en cada uno, resultados que coinciden con los de la presente investigación.(4,10,11)
Existen otras bacterias patógenas específicas que presentan mayor valor en el caso de las niñas pre púber en las que la contaminación ocurre con mayor frecuencia por la cercanía del ano al introito vaginal y la contaminación, en muchos casos, con las secreciones respiratorias. En el caso de la presente investigación, en la que se estudian jóvenes y adolescentes, estos aislamientos deben ser interpretados como etiología de vulvovaginitis cuando el crecimiento es confluyente y está causado, generalmente, por aseo inadecuado de los genitales, desequilibrios de la microbiota normal de la vagina o ante algún procedimiento o intervención quirúrgica previa.
Según el artículo “Flora vaginal en pacientes que asisten a consulta ginecológica” los cocos grampositivos (Enterococcus sp, Streptococcus grupo B, Staphylococcus aureus y Staphylococcus coagulasa negativa) y Escherichia coli fueron los microorganismos aislados de las pacientes con vaginitis aeróbicas: de un total de 18 pacientes el 27,7% tuvo aislamiento de enterobacterias y el resto, un 72,2%, fueron cocos grampositivos,(12) lo que no coincide con los resultados de la presente investigación en la que, en orden de frecuencia, las enterobacterias ocupan el primer lugar, seguidas de los cocos grampositivos.
En un estudio de 440 mujeres se aislaron 75 pacientes con vaginitis por Escherichia coli, que representaron el 17% de las estudiadas.(13) Este resultado coincide con la presente investigación en las que las enterobacterias están en primer lugar entre este grupo de bacterias patógenas.
El estuche diagnóstico de PCR múltiple de infecciones genitales que se empleó en este estudio permite la detección de cuatro microorganismos (Mycoplasma genitalium, Chlamydia trachomatis, Trichomona vaginalis y Neisseria gonorrhoeae). Su utilización en las jóvenes y adolescentes constituye una herramienta valiosa porque permite la detección de cuatro de los microorganismos patógenos más importantes de transmisión sexual, con consecuencias muchas veces irreversibles en la salud sexual y reproductiva de la mujer. Mycoplasma genitalium, Chlamydia trachomatis y Neisseria gonorrhoeae se colocan actualmente como las principales causas de cervicitis, de enfermedad inflamatoria pélvica y de infertilidad.
Mycoplasma genitalium se asocia significativamente con la cervicitis y es detectada por PCR en el 25% de las mujeres con este diagnóstico, aunque son frecuentes las coinfecciones en un análisis de regresión logística.(14) Esta afirmación difiere, en parte, de la presente investigación en la que, a pesar de que la mayoría de los aislamientos de M. genitalium ocurrió en pacientes con cervicitis, no existe relación significativa entre el diagnóstico por PCR y las formas clínicas de presentación.
El 9% de las mujeres sexualmente activas menores de 25 años padecen Chlamydia trachomatis; el cribado con auto-toma de la muestra y la detección mediante amplificación de ácidos nucleicos son las formas más eficaces de control sanitario.(15) Coincide con la presente investigación en el empleo de la auto-toma de muestra para el diagnóstico de Chlamydia trachomatis por PCR, así como en la frecuencia de su detección, porque no dista mucho de la encontrada.
Conclusiones
La vulvovaginitis por Candida. spp es la forma clínica más frecuente de presentación de las infecciones genitales bajas no virales entre las jóvenes, seguida del diagnóstico de vaginosis bacteriana. Ureaplasma spp. fue el microorganismo más detectado mediante el estuche comercial Myco Well D One. En la mayoría de las pacientes no se aíslan bacterias patógenas. El microorganismo más detectado por PCR fue Mycoplasma genitalium, seguido de Chlamydia trachomatis, ambos de difícil diagnóstico y relacionados con afectación a la salud sexual y reproductiva de la joven.
Referencias Bibliográficas
Ashizawa, T., Dunne, C.J., Dubel, J.R., Perryman, M.B., Epstein, H.F., Boerwinkle, E. y Hejtmancik, J.F. (1992). Anticipation In Myotonic Dystrophy .1. Statistical Verification Based On Clinical and Haplotype Findings. Neurology, 42, 1871-77.?https://doi.org/10.1212/wnl.42.10.1871
Brenes, O., Barbieri, R., Vásquez, M., Vindas-Smith, R., Roig, J., Romero, A., … Morales, F. (2021). Functional and structural characterization of ClC-1 andNav1.4 channels resulting from CLCN1 and SCN4A mutations identified alone and coexisting in myotonic patients. Cells, 10(2), 374.?https://doi.org/10.3390/cells10020374
Brook, J.D., McCurrach, M.E., Harley, H.G., Buckler, A.J., Church, D., Aburatani, H., … Housman, D.E. (1992). Molecular basis of myotonic dystrophy: expansion of a trinucleotide (CTG) repeat at the-3 end of a transcript encoding a protein kinase family member. Cell, 68, 799-808.?https://doi.org/10.1016/0092-8674(92)90154-5
Cannon, S.C. (2015). Channelopathies of skeletal muscle excitability. Compr Physiol, 5(2), 761-90.?https://doi.org/10.1002/cphy.c140062
Cannon S.C. (2017) Sodium Channelopathies of Skeletal Muscle. In: Chahine M, editor. Voltage-gated Sodium Channels: Structure, Function and Channelopathies. Handbook of Experimental Pharmacology. Springer, Cham, p.309-330.?https://doi.org/10.1007/164_2017_52?
Corrales, E., Vásquez, M., Zhang, B., Santamaría-Ulloa, C., Cuenca, P., Krahe, R., … Morales, F. (2019). Analysis of mutational dynamics at the?DMPK?(CTG)n locus identifies saliva as a suitable DNA sample source for genetic analysis in myotonic dystrophy type 1. PLoS ONE, 14(5), e0216407.?https://doi.org/10.1371/journal.pone.0216407
Dupre, N., Chrestian, N. y Bouchard, J.P. (2009). Clinical, electrophysiologic, and genetic study of non-dystrophic myotonia in French-canadians.?NeuromusculDisord, 19, 330-34.?https://doi.org/10.1016/j.nmd.2008.01.007
Estevez, R., Schroeder, B., Accardi, A., Jentsch, T. y Pusch, M. (2003). Conservation of chloride channel structure revealed by an inhibitor binding site in ClC-1.?Neuron, 38, 47–59.?https://doi.org/10.1016/S0896-6273(03)00168-5?
Gomes-Pereira, M., Bidichandani, S.I. y Monckton, D.G. (2004). Analysis of unstable triplet repeats using small-pool polymerase chain reaction.?Methods Mol Biol, 277, 61-76.?https://doi.org/10.1385/1-59259-804-8:061
Harley, H.G., Rundle, S.A., MacMillan, J.C., Myring, J., Brook, J.D., Crow, S.,… Harper, P,S. (1993). Size of the unstable CTG repeat sequence in relation to phenotype and parental transmission in myotonic dystrophy.?Am J Hum Genet, 52, 1164-1174.
Harper, P.S. (1989). Myotonic Dystrophy. 2nd ed. London: WB Saunders Company.
Heatwole, C. y Moxley, R. (2007). The nondystrophic myotonias.?Neurotherapeutics, 4, 238-51.?https://doi.org/10.1016/j.nurt.2007.01.012.
Hecht, B.K., Donnelly, A., Gedeon, A.K., Byard, R.W., Haan, E.A. y Mulley, J.G. (1993). Direct molecular diagnosis of the myotonic dystrophy.?Clin Genet, 43, 276-85.?https://doi.org/10.1111/j.1399-0004.1993.tb03819.x?
Horga, A., Raja, R.D.L., Matthews, E., Sud, R., Fialho, D., Durran, S., … Hanna, M.G. (2013). Prevalence study of genetically defined skeletal muscle channelopathies in England.?Neurology, 80, 1472–75.?https://doi.org/10.1212/wnl.0b013e31828cf8d0?[?Links?]
Koch, M.C., Steinmeyer, K., Lorenz, C, Ricker, K., Wolf, F., Otto, M., … Jentsch, T.J. (1992).?The skeletal muscle chloride channel in dominant and recessive human myotonia.?Science, 257, 797-800.?https://doi.org/10.1126/science.1379744?[?Links?]
Koch, M.C., Ricker, K., Otto, M.,Wolf, F., Zoll, B., Lorenz, C., … Jentsch, T.J. (1993). Evidence for genetic homogeneity in autosomal recessive generalised myotonia (Becker).?Journal of Medical Genetics, 30, 914-917.?http://dx.doi.org/10.1136/jmg.30.11.914?
Lavedan, C., Hofmann-Radvanyi, H., Shelbourne, P., Rabes, J.P., Duros, C., Savoy, D., … Junien, C. (1993). Myotonic dystrophy: size and sex dependent dynamics of CTG meiotic instability, and somatic mosaicism.?Am J Hum Genet, 52, 875-83.
Lehmann-Horn, F., Mailänder, V., Heine, R. y George, A.L. (1995). Myotonia levior is a chloride channel disorder.?Hum Mol Genet, 4(8), 1397-1402.?https://doi.org/10.1093/hmg/4.8.1397?
Lehmann-Horn, F. y Jurkat-Rott, K. (1999). Voltage-gated ion channel and hereditary disease.?Physiol Rev, 79, 1317-72.?https://doi.org/10.1152/physrev.1999.79.4.1317?
Lehmann-Horn, R., Ruedel, K., y Jurkat-Rot,t K. (2004). Nondystrophic myotonias and periodic paralysis. In: Engel AG, Franzini-Armstrong C, editors. Myology (3rd ed.) New York: McGraw-Hill, p. 1257-300.
Liquori, C.L., Ricker, K., Moseley, M.L., Jacobsen, J.F., Kress, W. y Naylor, S.L. (2001). Myotonic dystrophy type 2 caused by a CCTG expansion in intron 1 of ZNF9.?Science, 293, 864-67.?https://doi.org/10.1126/science.1062125
Lorenz, C., Meyer-Kleine, C., Steinmeyer, K., Koch, M.C. y Jentsch, T.J. (1994). Genomic organization of the human muscle chloride channel CIC-1 and analysis of novel mutations leading to Becker-type myotonia.?Human Molecular Genetics, 3(6), 941–946.?https://doi.org/10.1093/hmg/3.6.941
Monckton, D.G., Wong, L.J., Ashizawa T. y Caskey, C.T. (1995). Somatic mosaicism, germline expansions, germline reversions and intergenerational reductions in myotonic dystrophy males: small pool PCR analyses.?Hum Mol Genet,4, 1–8.?https://doi.org/10.1093/hmg/4.1.1?
Morales, F., Cuenca, P., Brian, R., Sittenfeld, M y del Valle, G. (2001). Diagnóstico molecular de la distrofia miotónica en Costa Rica.?AMC, 43, 159-67.
Morales, F., Cuenca, P., del Valle, G., Brian, R., Sittenfeld, M., Montoya, O., … Keith, J. (2003).Miotonía congénita: caracterización clínica de una familia costarricense afectada por la enfermedad de Thomsen.?Neuroeje, 17, 82-86.
Morales, F., Cuenca, P., del Valle, G, Vásquez, M., Brian, R., Sittenfeld, M., … Ashizawa, T. (2008).Clinical and molecular diagnosis of a Costa Rican family with autosomal recessive myotonia congenita (Becker disease) carrying a new mutation in the?CLCN1?gene.?Rev Biol Trop, 56, 1-11.?https://doi.org/10.15517/rbt.v56i1.5505?
Morales, F., Couto, J., Highman, C., Hogg, G., Cuenca, P., Braida, C., … Monckton, D.G. (2012).Somatic instability of the expanded CTG triplet repeat in myotonic dystrophy type 1 is a heritable quantitative trait and modifier of disease severity.?Hum Mol Genet, 21(16), 3558-67.?https://doi.org/10.1093/hmg/dds185
Morales, F., Vásquez, M., Santamaría, C., Cuenca, P., Corrales, E. y Monckton, D.G. (2016). A polymorphism in the MSH3 mismatch repair gene is associated with the levels of somatic instability of the expanded CTG repeat in the blood DNA of myotonic dystrophy type 1 patients.?DNA rep, 40, 57-66.?https://doi.org/10.1016/j.dnarep.2016.01.001?
Morales, F., Vásquez, M., Corrales, E., Vindas-Smith, R., Santamaría-Ulloa, C., Zhang, B., … Monckton, D.G. (2020). Longitudinal increases in somatic mosaicism of the expanded CTG repeat in myotonic dystrophy type 1 are associated with variation in age-at-onset.?Human Mol Genet, 29(15), 2496-2507.?https://doi.org/10.1093/hmg/ddaa123?
Morales, F. y Push, M. (2020). An Up-to-Date Overview of the Complexity of Genotype-Phenotype Relationships in Myotonic Channelopathies.?Front Neurol, 10, 1404.?https://doi.org/10.3389/fneur.2019.01404?
Orita, M., Iwahana, H., Kanazawa, H., Hayashi, K. y Sekiya, T. (1989). Detection of polymorphisms of human DNA by gel electrophoresis as single-strand conformation polymorphisms.?Proc Natl Acad Sci USA, 86(8), 2766-70.?https://doi.org/10.1073/pnas.86.8.2766
Platt, D. y Griggs, R. (2009). Skeletal muscle channelopathies: new insights into the periodic paralyses and nondystrophic myotonias.?Curr Opin Neurol, 22, 524-31.?https://doi.org/10.1097/wco.0b013e32832efa8f?
Ptacek, L.J, Trimmer, J.S., Agnew, W.S., Roberts, J.W., Petajan, J.H., Leppert, M. (1991). Paramyotonia congenita and hyperkalemic periodic paralysis map to the same sodium-channel gene locus.?Am J Hum Genet, 49, 851–4.
Ptacek, L.J., Tawil, R., Griggs, R., Meola,. G, McManis, P., Barohn, R.J., … Leppert M.F. (1994). Sodium channel mutations in acetazolamide-responsive myotonia congenita, paramyotonia congenita, and hyperkalemic periodic paralysis.?Neurology, 44, 1500-503.?https://doi.org/10.1212/wnl.44.8.1500?
Raja Rayan, D.L., Haworth, A., Sud, R., Matthews, E., Fialho, D., Burge, J., … Hanna, M.G. (2012). A new explanation for recessive myotonia congenital. Exon deletions and duplications in CLCN1.?Neurology, 78, 1953-58.?https://doi.org/10.1212/wnl.0b013e318259e19c?
Redman, J.B., Fenwick, R.G., Fu, Y.H., Pizzuti, A. y Caskey, C.T. (1993). Relationship between parental trinucleotide GCT repeat length and severity of myotonic dystrophy in offspring.?JAMA, 269, 1960-65.?https://doi:10.1001/jama.1993.03500150072029
Sambrook, J. y Russel, l.D.W. (2001). Molecular Cloning: a laboratory manual. New York: Cold Spring Harbor Laboratory Press.
Shelbourne, P., Davies, J., Buxton, J., Anvret, M., Blennow, E., Bonduelle, M., … Johnson, K. (1993).Direct diagnosis of myotonic dystrophy with a disease-specific DNA marker.?N Engl J Med, 328(7), 471-75.?https://doi.org/10.1056/nejm199302183280704?
Stunnenberg, B.C., LoRusso, S., Arnold, W.D., Barohn R., Cannon, S.C., Fontaine B., … Statland, J.M. (2020). Guidelines on clinical presentation and management of nondystrophic myotonias.?Muscle Nerve, 62, 430– 444.?https://doi.org/10.1002/mus.26887
Vindas-Smith, R., Fiore, M., Vásquez, M., Cuenca, P., Del Valle, G., Lagostena, L., … Morales, F. (2016).Identification and functional characterization of CLCN1 mutations found in nondystrophic myotonia patients.?Hum Mutat, 37(1), 74-83.?https://doi.org/10.1002/humu.22916?
Wong, L.J., Ashizawa, T., Monckton, D.G., Caskey, C.T. y Richards, C.S. (1995). Somatic heterogeneity of the CTG repeat in myotonic dystrophy is age and size dependent.?Am J Hum Genet, 56(1), 114-22.
2022Población y Salud en Mesoamérica
Creative Commons License?Esta obra está bajo una Licencia Creative Commons Atribución-NoComercial 4.0 Internacional.