Desafíos en el diagnóstico del síndrome antifosfolípido: Más allá de los criterios convencionales
El síndrome antifosfolípido (SAF) es una enfermedad autoinmune sistémica que se caracteriza por la aparición de trombosis a repetición y/o morbilidad gestacional, en pacientes que presentan anticuerpos antifosfolípidos (AAF), un grupo heterogéneo de autoanticuerpos dirigidos contra fosfolípidos aniónicos, proteínas plasmáticas de unión a fosfolípidos o complejos proteína-fosfolípido1.
Muchos pacientes con SAF tienen características clínicas y de laboratorio comunes a otras enfermedades autoinmunes, particularmente al lupus eritematoso sistémico (LES). Dichos pacientes se definen como con SAF secundario para distinguirlos del resto (SAF primario). La distinción entre SAF primario y secundario es dificultosa, ya que ambas condiciones comparten manifestaciones como trombocitopenia, anemia y compromiso renal y del sistema nervioso central2.
En 1999 se estableció el primer consenso internacional para el diagnóstico de SAF. Este instauró como requisitos que el paciente haya sufrido al menos un episodio clínico (trombosis vascular o morbilidad gestacional) y además posea un resultado de laboratorio positivo para AAF: presencia persistente y en título medio/alto de anticuerpos anticardiolipina (aCL) IgG y/o IgM dependientes de β-2-glicoproteina-I; o presencia persistente de anticoagulante lúpico (AL), detectado de acuerdo con los lineamientos de la Sociedad Internacional de Trombosis y Hemostasia3. Posteriormente, en 2002, se propuso incluir a los anticuerpos anti-β-2-glicoproteina-I (aβ 2GP1) IgG e IgM en la lista de AAF para los criterios de SAF4, siendo finalmente incorporados en una posterior revisión5.
En 2022, el Colegio Americano de Reumatología y la Liga Europea contra el Reumatismo (ACR – EULAR) iniciaron el proceso de actualización de los criterios diagnósticos para el SAF. En esta oportunidad, de forma preliminar, se ratificó el criterio anterior y, además, se propuso la asignación de un puntaje para cada tipo de evento clínico y resultado de laboratorio, para obtener de esta forma un score que confirma o descarta la presencia de SAF. No se agregaron a las determinaciones de laboratorio otros AAF.
Sin embargo, existe evidencia de que la presencia de algunos AAF no convencionales podría contribuir al diagnóstico, especialmente en los casos en los que el criterio de laboratorio no se cumple, pero existen eventos clínicos. Ya en 2012, se recomendó la determinación del isotipo IgA de AAFs (especialmente IgA aβ2GP1) en los casos en los que los isotipos IgG e IgM fueran negativos y todavía se sospechara SAF6. Por otra parte, un estudio prospectivo a 5 años publicado en 2017 concluyó que la positividad aislada para IgA aB2GP1 en pacientes sin historial previo de características clínicas de SAF (portadores asintomáticos) sería un factor de riesgo independiente para desarrollar eventos de SAF7. Además, la presencia de IgA a β2GP1 en pacientes dializados previa al trasplante renal aumenta el riesgo de pérdida temprana del trasplante causada por trombosis y de retraso en la función del órgano trasplantado8,9, ocurriendo lo mismo con pacientes con trasplantes cardíacos10.
En adición a los marcadores biológicos que a la fecha se incluyen en los criterios clasificatorios (AL, aCL y aβ2GP1, IgG e IgM), otros marcadores de SAF, como los anticuerpos contra la fosfatidil-etanolamina y la fosfatidilserina/protrombina, podrían ser útiles en el diagnóstico de los llamados “SAF seronegativos”, un grupo de pacientes con manifestaciones clínicas de SAF, pero con anticuerpos AL, aCL y aβ 2GP1, IgG e IgM, persistentemente negativos11.
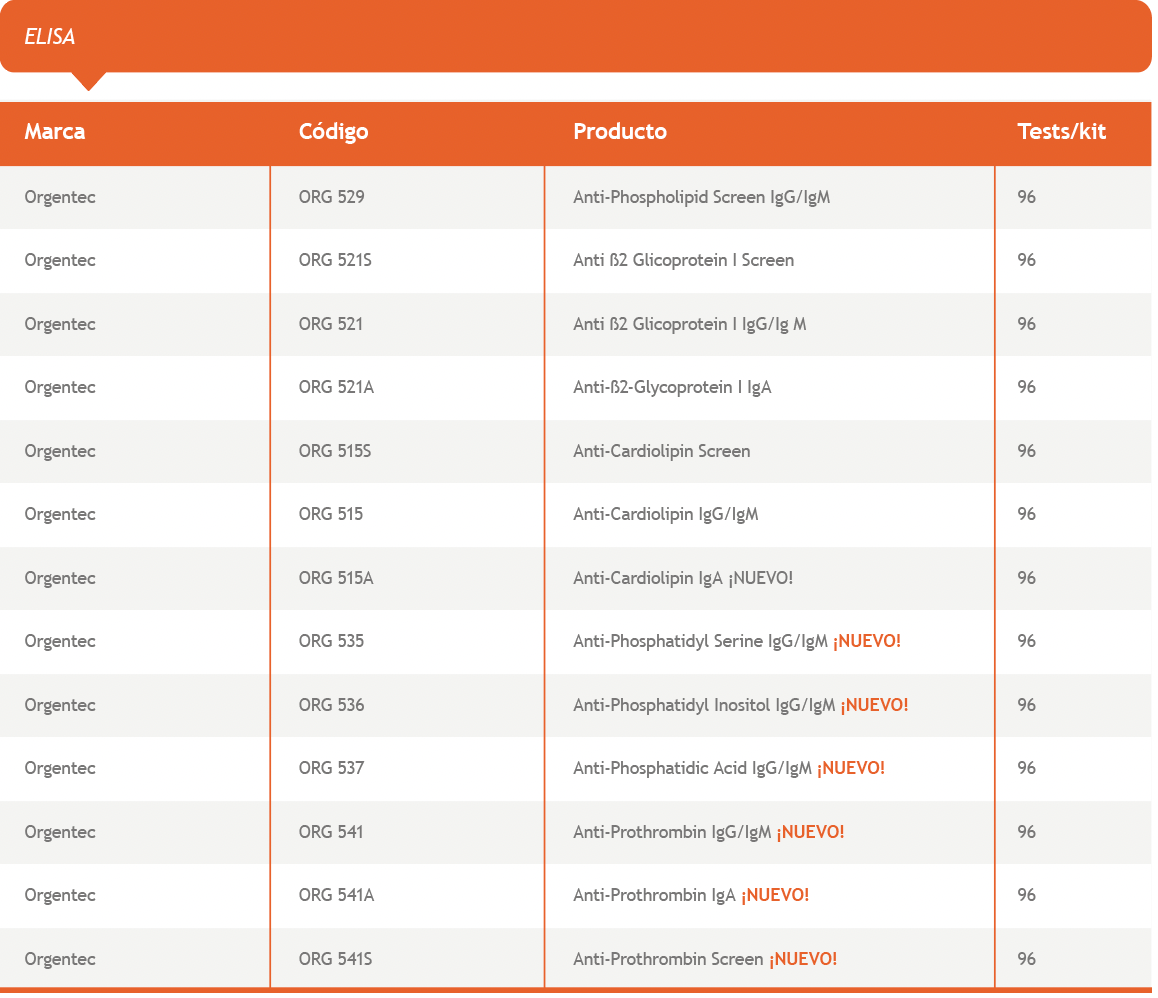
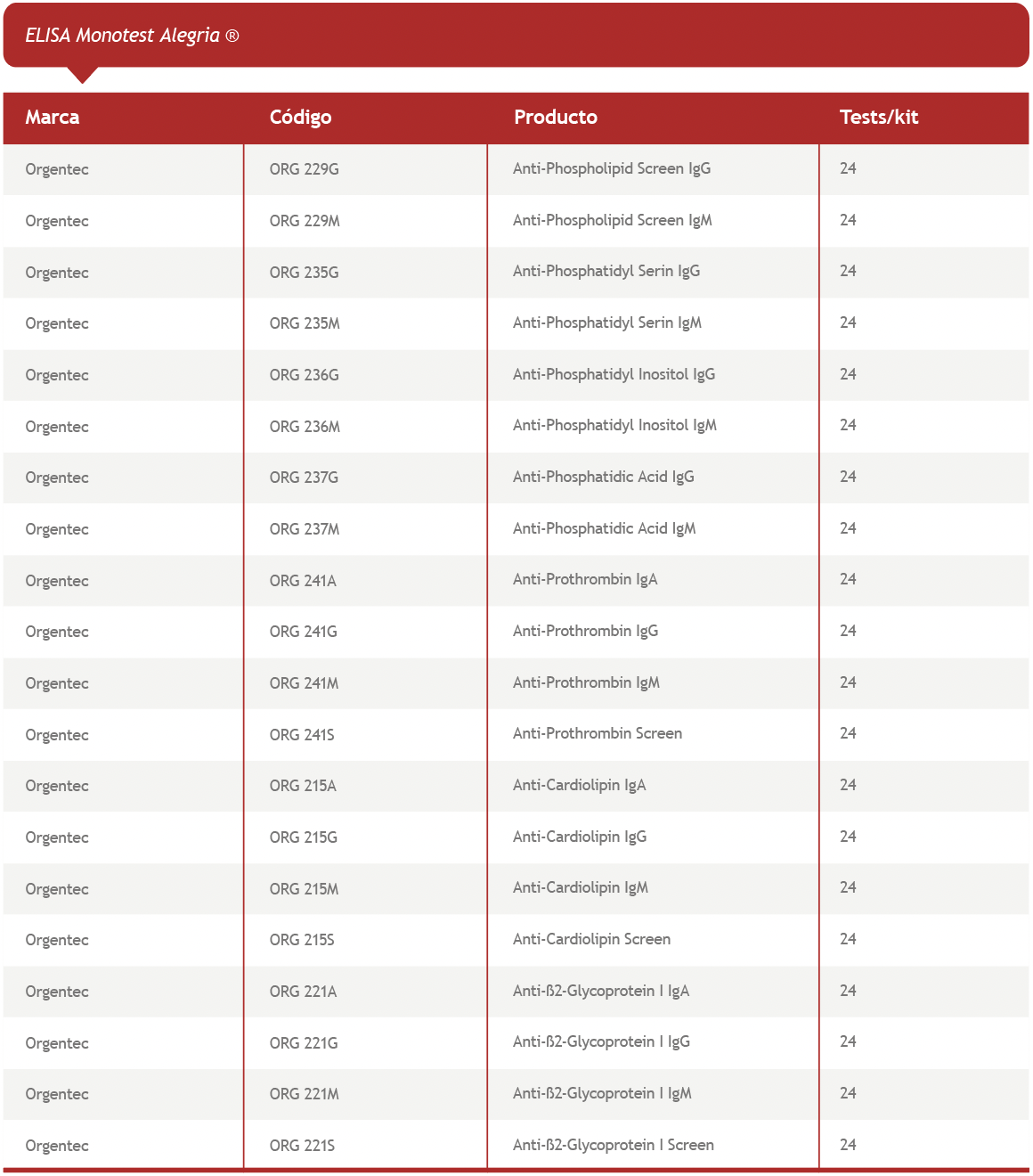
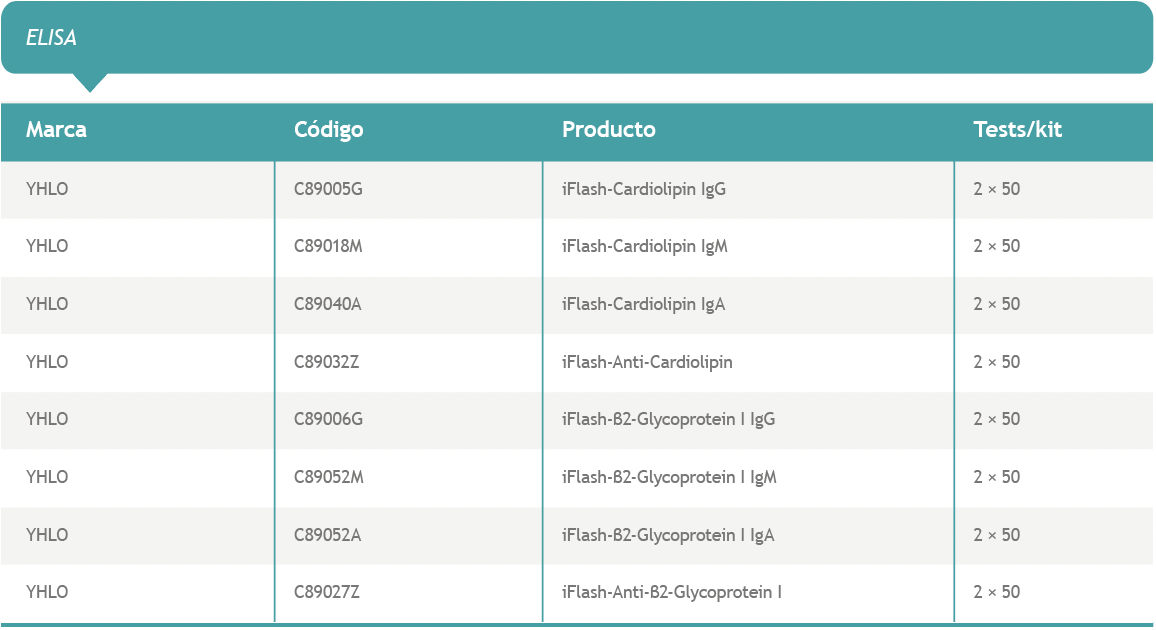
En vista de la evidencia expuesta en las publicaciones recientes, la determinación de AAF que complementen a los incluidos dentro de los criterios aceptados actualmente para la definición de SAF, puede ayudar a identificar pacientes que presenten manifestaciones clínicas cuyos resultados de laboratorio no cumplan con un criterio estricto, logrando de este modo un diagnóstico personalizado y más certero.
Bioars recientemente ha incorporado a su línea de productos registrados, los tests ELISA de Orgentec para determinación de anticuerpos antifosfolípidos, y Anti-ß2-Glycoprotein IgA, que completan el panel junto con los registrados anteriormente.
Disponemos, además, de las versiones automatizadas en Alegria® (ELISA-Orgentec) y en iFlash 1800 CLIA Analyzer (CLIA-YHLO)
¿Te interesa incorporar nuevos ensayos y nuevas tecnologías? Tenemos una opción para vos. Comunicate con nosotros para que podamos asesorarte en forma personalizada. Escribinos a rmkt@bioars.com.ar
Referencias Bibliográficas
1. Serrano, M. La Beta-2 Glicoproteína no es solamente un autoantígeno Médico especialista en Inmunología.
2. Bertolaccini, M. L., Khamashta, M. A. & Hughes, G. R. V. Diagnosis of antiphospholipid syndrome. Nature clinical practice. Rheumatology vol. 1 40–46 Preprint at https://doi.org/10.1038/ncprheum0017 (2005).
3. Wilson, W. A. et al. INTERNATIONAL CONSENSUS STATEMENT ON PRELIMINARY CLASSIFICATION CRITERIA FOR DEFINITE ANTIPHOSPHOLIPID SYNDROME Report of an International Workshop. ARTHRITIS & RHEUMATISM vol. 42 (1999).
4. Reber, G., Tincani, A., Sanmarco, M., de Moerloose, P. & Boffa, M. C. Proposals for the measurement of anti-β2-glycoprotein I antibodies. Standardization group of the European Forum on Antiphospholipid Antibodies [6]. Journal of Thrombosis and Haemostasis vol. 2 1860–1862 Preprint at https://doi.org/10.1111/j.1538-7836.2004.00910.x (2004).
5. Miyakis, S. et al. International consensus statement on an update of the classification criteria for definite antiphospholipid syndrome (APS). Journal of Thrombosis and Haemostasis 4, 295–306 (2006).
6. Lakos, G. et al. International consensus guidelines on anticardiolipin and anti-β 2-glycoprotein i testing: Report from the 13th International Congress on Antiphospholipid Antibodies. in Arthritis and Rheumatism vol. 64 1–10 (2012).
7. Tortosa, C. et al. Incidence of thromboembolic events in asymptomatic carriers of IgA anti ß2 glycoprotein-I antibodies. PLoS One 12, (2017).
8. Morales, J. M. et al. Association of early kidney allograft failure with preformed IgA antibodies to β2-glycoprotein I. Journal of the American Society of Nephrology 26, 735–745 (2015).
9. Morales, J. M. et al. Pretransplant IgA-anti-beta 2 glycoprotein I antibodies as a predictor of early graft thrombosis after renal transplantation in the clinical practice: A multicenter and prospective study. Front Immunol 9, (2018).
10. Delgado, J. F. et al. Early mortality after heart transplantation related to IgA anti–β2-glycoprotein I antibodies. Journal of Heart and Lung Transplantation 36, 1258–1265 (2017).
11. Litvinova, E. et al. Prevalence and Significance of Non-conventional Antiphospholipid Antibodies in Patients With Clinical APS Criteria. Front Immunol 9, (2018)








