Comparación entre metodologías para la detección de IgG Anti Toxoplasma gondii en suero
Artículo Original
Gribaudo,Lorena (1)
Saretti,Lorena (2)
Gallego,Fernando(3)
Miguez,Viviana (1)
1- Inmunología – Laboratorio LABICO – Córdoba – Argentina.
2- Inmunología – Laboratorio GEA – Córdoba – Argentina.
3- Laboratorio Central Hospital Rawson. Córdoba – Argentina.
Correspondencia: Lorena Gribaudo – Av. Colón 4782 – Córdoba – Teléfono (0351) 156568360
Mail: inmunología@labico.com.ar
Laboratorio Labico
Resumen
La toxoplasmosis es una enfermedad sistémica producida por toxoplasma gondii que afecta a hombres, mamíferos y aves. Suele no manifestarse clínicamente en pacientes con estado inmunológico competente. En condiciones normales la infección ocurre solo una vez en la vida dejando un estado de inmunidad celular y humoral permanente. En la mayoría de los casos la infección solo puede comprobarse mediante análisis serológico, con técnicas para la detección de anticuerpos IgG, IgM o totales. Los objetivos de este trabajo fueron: comparar diferentes test serológicos para detección de anticuerpos IgG anti toxoplasma gondii y establecer la concordancia entre ellos; proponer una guía para realizar equivalencias entre los resultados positivos obtenidos por las distintas técnicas. Los métodos evaluados fueron HAI (hemaglutinación indirecta), QM (quimioluminiscencia) e IFI (inmunofluorescencia indirecta). Se evaluaron 100 muestras de suero de pacientes adultos de ambos sexos que ingresaron al laboratorio con solicitud de serología para toxoplasmosis, a las cuales se les dosó IgG e IgM. Se descartó del análisis una muestra con resultado positivo para IgM anti toxoplasma gondii. Las restantes fueron analizadas por los 3 métodos a evaluar. Para determinar la concordancia metodológica se calculó el coeficiente Kappa. Los coeficientes de concordancia Kappa que se encontraron para los resultados globales (positivo/negativo) fueron para HAI vs QM: 0.802, HAI vs IFI: 0.774, QM vs IFI: 0.743, mostrando una excelente concordancia entre las técnicas HAI/QM, y buena concordancia entre HAI/IFI y QM/IFI. En cuanto a las equivalencias propuestas (estratificando resultados positivos) se obtuvieron los siguientes coeficientes: para HAI vs QM: 0.662, HAI vs IF: 0.569, QM vs IFI: 0.637, mostrando buenas concordancia entre HAI/QM y QM/IFI. Acorde a la bibliografía, los resultados encontrados demuestran la importancia de utilizar siempre el mismo método diagnóstico. Para los casos en donde los pacientes no tengan acceso a la misma metodología en el seguimiento clínico, se propone el uso de una tabla de relación entre resultados de distintas técnicas, a modo de facilitar la interpretación de los mismos.
Palabras clave: toxoplasma gondii, quimioluminiscencia, inmunofluorescencia indirecta, hemaglutinación indirecta.
Abreviaturas: HAI (hemaglutinación indirecta), QM (quimioluminiscencia), IFI (inmunofluorescencia indirecta), IgG (inmunoglobulinaG), IgM (inmunoglobulina M), FITC (isotiocianato de fluoresceína), PCR (reacción en cadena de la polimerasa), NIBSC (Instituto Nacionalde Estándares Biológicos). 3
Introducción
La toxoplasmosis es una zoonosis causada por toxoplasma gondii, un parásito intracelular obligado, de la familia Sarcocystidae, género toxoplasma, capaz de infectar a las células de humanos, mamíferos y aves. Los síntomas, el curso y las consecuencias de la infección dependen de la virulencia, el tamaño del inóculo, la genética y el estado inmunológico del huésped (1). Es una enfermedad sistémica, auto limitada y de muy bajo riesgo para las personas inmunocompetentes.
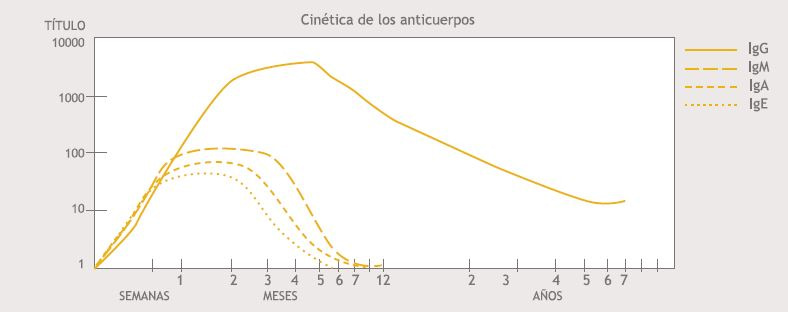
Clínicamente se manifiesta con linfoadenopatía asintomática acompañada en ocasiones por fiebre, dolor de garganta y erupción cutánea. También puede afectar diversos órganos como el hígado, el bazo, meninges, pulmón y corazón. En inmunocompetentes, la infección ocurre solo una vez dejando inmunidad celular (Th1) y humoral permanente (2). La cinética de los anticuerpos en la infección aguda sigue una curva de ascenso muy rápida y los niveles máximos se detectan en 6-12 semanas, según la metodología empleada (figura I) (3). El aporte del laboratorio serológico en esta enfermedad es fundamental tanto para la valoración inicial del paciente, como para el seguimiento.
Figura I: Cinética de Inmonoglobulinas durante la infección por toxoplasma gondii (3).
En pacientes inmunocomprometidos es fundamental realizar un diagnóstico temprano, tanto en infecciones agudas como en reactivaciones, ya que pueden causar daños irreversibles como toxoplasmosis cerebral, encefalitis, miocarditis y/o neumonitis. Estas infecciones agudas se confirman por la aparición de anticuerpos o por el aumento del valor obtenido en sueros extraídos a intervalos de 3 semanas. Es de fundamental importancia la detección serológica de primeras infecciones en pacientes embarazadas, ya que puede provocar aborto, daño neurológico, ocular y muerte fetal. La reactivación durante el embarazo no causa daños fetales (4).
El tamizaje de la toxoplasmosis puede realizarse por métodos biológicos, serológicos, histológicos y moleculares o por alguna combinación de los anteriores (5). En este trabajo se emplearon los métodos de hemaglutinación indirecta (HAI), inmunofluorescencia indirecta (IFI) y quimioluminiscencia (QM), por ser los más accesibles en nuestro medio. Estas metodologías presentan diferencias en sensibilidad, especificidad y blanco antigénico, por ello se consideró importante comparar resultados entre ellas, ya que muchas veces se realizan diferentes técnicas durante el seguimiento de un paciente. Esta situación suele darse ya sea por discrepancia en los pedidos médicos, exigencias de obras sociales o limitaciones en las metodologías disponibles en los laboratorios.
El objetivo de éste trabajo fue establecer la concordancia metodológica entre los test para la detección de anticuerpos IgG anti toxoplasma gondii en población general y proponer una guía para realizar equivalencias entre aquellos resultados que fueron positivos por las distintas técnicas, con el fin de facilitar la interpretación clínica.
Materiales y metodos
Estudio
Descriptivo retrospectivo.
Muestras
Se incluyeron 100 muestras de suero de pacientes adultos entre 20 y 70 años, de ambos sexos que ingresaron al servicio de inmunología de laboratorio LABICO con solicitud de anticuerpos IgG anti toxoplasma gondii. No presentaron lipemia ni hemólisis. Las determinaciones se realizaron el mismo día que arribaron al laboratorio. No se tuvo acceso a las historias clínicas de los pacientes. 5
Adicionalmente se dosó anticuerpos IgM anti toxoplasma gondii a aquellas muestras con resultados positivos de IgG anti toxoplasma gondii, excluyendo del análisis una muestra que arrojó valores positivos para IgM.
Las determinaciones se llevaron a cabo respetando las instrucciones estipuladas por los fabricantes de cada prueba empleada.
Metodologías Utilizadas
A continuación se detallan las 3 metodologías para detección de anticuerpos IgG anti toxoplasma gondii utilizadas en este trabajo:
Quimioluminiscencia: es un inmunoensayo tipo sándwich con captura de clases de inmunoglobulinas que utiliza tecnología de quimioluminiscencia directa. El anticuerpo monoclonal anti IgG humana está unido de forma covalente a partículas paramagnéticas de la fase sólida. En el reactivo lumínico, el antígeno purificado de toxoplasma gondii forma complejos con el anticuerpo monoclonal anti p-30 marcado con éster de acridinio. Si la muestra contiene IgG anti toxoplasma gondii se forman complejos antígeno-anticuerpo (Toxo G, Advia Centaur Siemens). El valor de corte del método de 10 IU/mL fue verificado a través de curvas receiver operator characteristics (ROC). Posee una sensibilidad de 96,5% y una especificidad de 98,6%, determinados por el fabricante. Los resultados obtenidos dentro de los valores estipulados por Siemens como zona gris (6,4-9,9 UI/mL) se clasificaron dentro de los negativos, ya que los métodos de IFI y HAI no cuentan con rangos similares.
Inmunofluorescencia Indirecta: Se utilizaron improntas comerciales que contienen el parasito fijado (IFI fluor parasitest toxoplasma, laboratorio IFI). La dilución de las muestras se realizaron a partir de 1/40 (título de corte) empleando un conjugado comercial IgG marcado con isotiocianato de fluoresceína (FITC, Orgentec) diluido en azul de Evans (Orgentec), a manera de mejorar el contraste para el observador. Posee una sensibilidad de 98,2% y una especificidad 98% determinada por el fabricante.
Hemaglutinación Indirecta: está basada en la capacidad que tienen los anticuerpos totales anti toxoplasma gondii para aglutinar en presencia de liofilizado de glóbulos rojos de carnero sensibilizados con antígenos citoplasmáticos y de membrana del parásito (Toxo test HAI-Wiener Lab). En este ensayo el suero del paciente es diluido seriadamente desde 1/2 a 1/2048 y posteriormente enfrentado a una suspensión antigénica de toxoplasma. Se tomó como título de corte 1/64, según la metodología de trabajo establecida por nuestro laboratorio, modificando el valor de corte de 1/16 sugerido por el fabricante. 6
Análisis estadístico
Para evaluar la concordancia estadística entre las técnicas empleadas se utilizó el coeficiente de concordancia Kappa, y las fuerzas de concordancia consideradas fueron: Kappa >0,8 excelente; Kappa entre 0,61 y 0,8 buena; y Kappa entre 0,41 y 0,6 moderada (6).
Resultados
Concordancia de los resultados entre las distintas metodologías
Evaluando los resultados cualitativos, sin tener en cuenta el título o concentración se obtuvieron los valores de las tablas 1, 2 y 3. De los 99 pacientes evaluados 19 fueron negativos por las tres técnicas, 10 fueron negativos por QM y positivos por HAI e IFI. Un paciente fue negativo por HAI y positivo por las otras 2 técnicas. Analizando los datos obtenidos, se observó una excelente concordancia entre las determinaciones por QM y HAI, y buenas concordancias entre HAI e IFI y QM e IFI
Tabla I. Número de casos positivos y negativos entre HAI e IFI (Kappa=0,774)

Tabla II. Número de casos positivos y negativos entre IFI y QM (Kappa=0,743)
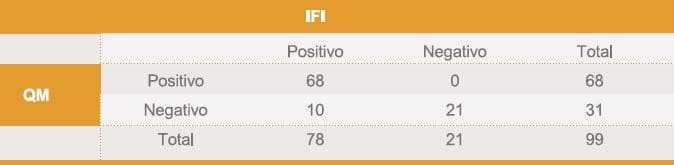
Tabla III. Número de casos positivos y negativos entre HAI y QM (Kappa=0,802)

Concordancia entre resultados positivos y negativos de las distintas metodologías con las equivalencias propuestas
Como el nivel de anticuerpos es de importancia para el paciente, se compararon los coeficientes de concordancia entre las distintas metodologías evaluadas acorde a su título o concentración. Los valores hallados se clasificaron del 0 al 6 para poder estratificar y comparar resultados similares. La relación de positividad propuesta se estableció en base a la experiencia del servicio de inmunología del laboratorio (Tabla 4).
Tabla IV. Relación de Positividad
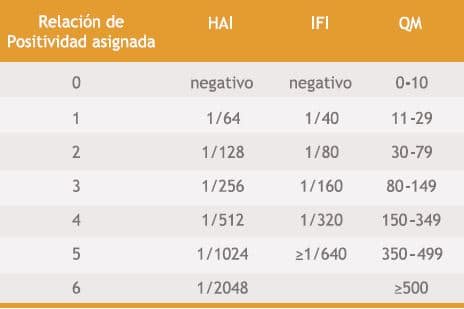
Los resultados obtenidos en este caso fueron una buena concordancia entre HAI y QM, al igual que entre QM e IFI, mientras que la concordancia fue moderada para HAI e IFI. En las Tablas 5, 6 y 7 se observan el número de muestras cuyos resultados son concordantes entre los distintos métodos, relacionados a la tabla 4 propuesta.
Tabla V. Niveles comparativos de anticuerpos entre HAI y QM (Kappa=0,662)

Tabla VI. Niveles comparativos de anticuerpos entre HAI y IFI (Kappa=0,569)

Tabla VII. Niveles comparativos de anticuerpos entre IFI y QM (Kappa=0,637)

Discusión
Una variedad de métodos han sido evaluados en diversos trabajos para realizar el diagnóstico de toxoplasmosis, algunos de ellos detectan antígenos de membrana, otros citoplasmáticos, pero no siempre son capaces de detectar una infección. Es fundamental seleccionar la metodología conveniente para la detección de toxoplasmosis acorde al contexto clínico del paciente, ya que además de las ventajas y desventajas de cada método, algunas muestras también presentan interferentes como factor reumatoideo, anticuerpos antinucleares o anticuerpos anti mitocondriales que generan resultados falsos positivos o falsos negativos complicando la interpretación de los datos (7). Muchas veces el testeo de las muestras en paralelo constituye la única forma certera para comparar títulos de anticuerpos entre dos muestras o detectar infecciones recientes a través de la seroconversión (8).
Las técnicas serológicas más usadas para detectar infección por toxoplasma gondii son QM, ELISA, HAI, IFI, reacción de la polimerasa en cadena (PCR) y avidez de IgG (9).
Es importante destacar que en casos donde se obtienen resultados discrepantes, ya sea porque fueron obtenidos por distintos métodos o laboratorios, o simplemente resultados que no muestran con claridad el estado infeccioso del paciente, es de gran ayuda realizar el test de avidez para IgG anti toxoplasma gondii. El porcentaje de avidez es de utilidad principalmente para diferenciar enfermedad crónica, donde los pacientes presentan un índice alto, de una primo infección donde el índice es bajo (7, 10,11). 10
Aunque el tamizaje serológico continúa siendo fundamental para el diagnóstico de la infección por toxoplasma gondii, las técnicas moleculares pueden usarse como metodologías complementarias.
El Western Blot es útil para discernir entre resultados discordantes de otras metodologías, como para diferenciar resultados negativos de positivos (12,13). Un test cualitativo útil para detectar la presencia de antígenos del parásito, fundamentalmente el de 30Kda, es el Inmunoblot (14).
Debido al compromiso del sistema inmune y la posible disminución de anticuerpos circulantes que esto implica (pacientes inmunosuprimidos), la metodología de elección es la PCR, útil para confirmar diagnóstico, pero no como método de screening (8, 15).
En este estudio se seleccionaron las metodologías de QM, HAI e IFI por ser las más accesibles y utilizadas en nuestro medio, los cuales mostraron a través del test estadístico Kappa buena correlación entre positivos y negativos, con una excelente concordancia entre QM y HAI; y buena entre QM e IFI y entre HAI e IFI, en relación a lo descripto en los trabajos realizados por Hamidinejat H. y colaboradores, y por Jean-Benjamin Murat y colaboradores (16,17).
Cada una de las metodologías empleadas posee ventajas o limitaciones incluyendo especificidad de conjugado (18,19), distintas fuentes antigénicas y en base a esto tendrán diferentes desempeños diagnósticos. IFI requiere de personal experimentado capaz de reconocer resultados positivos a bajas concentraciones o fenómenos de prozona a altas concentraciones. Acorde a lo demostrado en el trabajo de Rajaii M, Aliparasti MR y colaboradores, IFI podría ser capaz de detectar mayor cantidad de casos IgG positivos que ELISA (20), en concordancia con los resultados obtenidos en este trabajo que muestran más resultados positivos por IFI que por las metodologías de HAI y QM.
Si bien QM es un método sencillo de realizar, requiere de aparatología costosa sobre todo para realizar un screening de infección. HAI es accesible a realizarla en cualquier laboratorio, necesita de personal con entrenamiento mínimo, pero posee interferencias por anticuerpos heterófilos, al igual que QM, y no es útil para diagnósticos de primo infección. Por ello para un correcto diagnóstico de infección se recomienda el uso de los test para dosaje de IgG anti toxoplasma gondii de manera complementaria entre ellos, acompañados siempre por los antecedentes clínicos de cada paciente evitando de esta manera situaciones no deseables por diferencias en los resultados de laboratorio.
Los resultados cualitativos obtenidos, en este contexto, permiten que laboratorios que no dispongan de instrumental costoso puedan realizar el test de toxoplasmosis por HAI (16) y aproximar los resultados que se podrían obtener por metodologías como IFI y QM, cuando no se cuenta con la infraestructura o personal capacitado para realizar dichas técnicas. La 11 mejor correlación obtenida se encontró entre HAI y QM (Kappa: 0,802), similar a la lograda en el trabajo de Hamidinejat H. y colaboradores, quienes obtuvieron una correlación de 0,736(16).
Para evaluar la discordancia en los resultados obtenidos en este trabajo es adecuado considerar las diferencias de conjugado y principalmente la especificidad antigénica inherente a cada metodología empleada, además de posibles reacciones cruzadas generadas por factor reumatoideo, anticuerpos antinucleares (8) o de resultados falsamente negativos en muestras con bajos títulos de IgG anti toxoplasma gondii. Sin embargo no se cuentan con pruebas de estas interferencias que excedan a las técnicas utilizadas.
Si bien muchos trabajos de bibliografía se basan en los diagnósticos serológicos de infección por toxoplasmosis, la mayoría de ellos no establece un análisis comparativo entre los títulos de los anticuerpos.
Al comparar los títulos de los resultados positivos de las distintas metodologías con las equivalencias propuestas, se encontró que para la comparación entre HAI y QM (Kappa: 0,662), y entre QM e IFI (Kappa: 0,637) las concordancias fueron buenas, y para el caso de la comparación entre HAI e IFI (Kappa: 0,569) hubo una concordancia moderada.
D. Silva y colaboradores mostraron resultados similares en un estudio comparativo entre HAI e IFI (Kappa: 0,51). Sin embargo las valores obtenidos entre ELISA y HAI (Kappa: 0,81) son estadísticamente comparables y difieren de los presentados en este trabajo, evento que podría asociarse a las diferencias entre los test de ELISA y QM. El método de ELISA presentado por Silva y col. utiliza una preparación antigénica soluble que detecta anticuerpos de tipo IgG (21) difiriendo en sensibilidad y especificidad a QM, además de que el volumen de muestras evaluado es significativamente menor.
El desempeño diagnóstico no puede ser analizado en éste contexto ya que no se tuvo acceso a las historias clínicas de los pacientes.
Es frecuente que por distintos motivos el médico se encuentre con resultados de anticuerpos IgG anti toxoplasma gondii de un mismo paciente dosados por diferentes metodologías. Para estas situaciones o en situaciones donde no se puede realizar test complementarios, se plantea el uso de la tabla 4 de manera orientativa, ya que los resultados obtenidos resultan insuficientes para usarla como referencia, a modo de facilitar la interpretación en éstos casos, mediante una correlación de qué valores pueden esperarse al cambiar de técnica diagnóstica sin que se deba a cambios biológicos de los anticuerpos. Es decir, entre qué valores debería encontrarse el mismo resultado analizado por distintas técnicas, que le sugiera al profesional que la discrepancia es debida sólo al cambio en la metodología.
En relación a la evaluación estadística realizada al comparar títulos de anticuerpos y a los índices de concordancia obtenidos se reafirma, acorde a la bibliografía (22), la importancia de usar siempre el mismo método para el seguimiento de los resultados clínicos de un (12) paciente. Sería importante profundizar éste trabajo con un mayor número de pacientes adultos adecuadamente clasificados de acuerdo a un contexto clínico, para obtener valores más certeros y acotados, pudiendo confeccionar una tabla de equivalencias símil a la presentada para ser usada como referencia.
Conflicto de Intereses
Los autores no presentan conflicto de intereses.
Agradecimientos
Dra. Barzón, Silvia 13
Referencias Bibliográficas.
1. Hegazy S, Farid A, Rabae I, et al. Novel IMB-ELISA assay for rapid diagnosis of human toxoplasmosis using SAG1 antigens. Jpn J Infect Dis 2015; 68:474-80.
2. Yarovinsky F. Innate inmunity to Toxoplasma gondii infection. Nature Rev. Imm 2014; 14:109-21.
3. Toplikar E. Toxoplasmosis. En: https://notiwiener.net/2015/01/toxoplasmosis; consultado el 14/03/2016.
4. Mumcuoglu I, Toyran A, Cetin F, et al. Evaluation of the toxoplasmosis seroprevalence in pregnant women and creating a diagnostic algorithm.
Mikrobiyol Bul 2014; 48:283-91.
5. Hill D, Dubey JP. Toxoplasma gondii: transmission, diagnosis and prevention. Clin Microbiol Infect 2002; 8:634-40.
6. Landis J, Koch G. The measurement of observer agreement for categorical data. Biometrics 1977; 33:159-74.
7. Decoster A, Darcy F, Capron A. Recognition of toxoplasma gondii excreted and secreted antigens by human sera from acquired and congenital toxoplasmosis: identification of markers of acute and chronic infection. Clin Exp Inmunol 1998;73: 376-82.
8. Rosse N, Demarcario E, Fahey J, et al. Clinical microbiology En: Tietz, Norbert W. Clinical Guide to Laboratory, 3th ed. United States of America: Elsevier, 1995, p 1616-17.
9. Acosta ME, Guillen Y, Aria L, et al. Concordancia entre las pruebas de IgG avidez por ELISA desarrollado por el Instituto de Investigación en Ciencias de la Salud y un test de avidez comercial. Mem Inst Investig Cience Salud 2010; 8:39-43.
10. Besteiro S. Diagnóstico de toxoplasmosis aguda. Test de avidez. Anuario fundación Dr. J.R.Villavicencio. Instituto de Inv Microb y Clínicas 2008; 16:169-70.
11. Iddawela D, Ehambaram K, Kumarasiri PV, et al. Development and validation of an Enzyme Linked Immunosorbent Assay (ELISA) test for the diagnosis of toxoplasmosis in Sri Lanka. Ceylon Med Journal 2015; 60:82-86.
12. Khammari I, Saghrouni F, Yaacoub A, et al. IgG Western Blot for Confirmatory Diagnosis of Equivocal Cases of Toxoplasmosis by EIA-IgG and Fluorescent Antibody Test. Korean J Parasitol 2013; 51:485-88.
13. Al-Adhami BH, Gajadhar AA. A new multi-host species indirect ELISA using protein A/G conjugate for detection of anti-Toxoplasma gondii IgG antibodies with comparison to ELISA-IgG, agglutination assay and Western blot. Vet Parasitol 2014; 24: 66-73.
14. Mouri O, Kendjo E, Touafek F, et al. The impact of lowering the cutoff value on the sensitivity of the Platelia Elisa IgG (Bio-Rad) test for toxoplasmosis diagnosis. Parasite 2015; 22:22. 14
15. Ghoneim NH, Shalaby SI, Hassanain NA, et al. Comparative study between serological and molecular methods for diagnosis of toxoplasmosis in women and small ruminants in Egypt. Foodborne Pathog Dis 2010;7:17-22.
16. Hamidinejat H, Nabavi L, Mayahi M, et al. Comparison of three diagnostic methods for the detection of Toxoplasma gondii in free range chickens. Trop Biomed 2014;31: 507-13.
17. Murat JB, Dard C, Hidalgo H, el al. Comparison of the Vidas System and Two Recent Fully Automated Assays for Diagnosis and Follow-Up of Toxoplasmosis in Pregnant Women and Newborns. Clin Vaccine Immunol 2013; 20:1203-12.
18. Azab ME, El-Shenawy SF, El-Hady HM, et al. Comparative study of three tests (indirect haemagglutination, direct agglutination, and indirect immunofluorescence) for detection of antibodies to Toxoplasma gondii in pregnant women. J Egypt Soc Parasitol 1993; 23:471-76.
19. Gu Y, Wang Z, Cai Y, et al. Comparative study of Toxoplasma gondii seroprevalence in mink using a modified agglutination test, a Western blot, and enzyme-linked immunosorbent assays. J Vet Diagn Invest 2015; 27:616-20.
20. Rajaii M, Aliparasti MR, Nagilli B, et al. Comparison of immunofluorescence and enzyme-linked immunosorbent assay and immunoglobulin G avidity techniques for screening of anti: Toxoplasma antibodies among single serum sample pregnant women in Tabriz, Iran. Indian J Pathol Microbiol 2015;58:40-44.
21. Silva DA, Cabral DD, Bernardina BL, et al. Detection of Toxoplasma gondii-Specific Antibodies in Dogs. A Comparative Study of Immunoenzymatic, Immunofluorescent and Haemagglutination Titers. Mem Inst Oswaldo Cruz 1997; 92:785-89.
2. Leslé F, Touafek F, Fekkar A, et al. Discrepancies between a new highly sensitive Toxoplasma gondii ELISA assay and other reagents: interest of Toxo IgG Western blot. Eur J Clin Microbiol Infect Dis 2011; 30:1207-12.






