Caracterización de las Leucemias Agudas evaluadas mediante aspirado, biopsia y citometría de flujo en médula ósea durante los años 2012 – 2015, dinámica Ips. Medellín, Colombia
Artículo original
Jaramillo Patricia Elena(1,2,3), Durán Sandra Marcela(2), Vásquez Sara(2), Villa Laura(2)
(1) MS Hematología del Dinámica IPS. Medellín, Colombia.
(2) Microbiologas de la Escuela de Microbiología, Universidad de Antioquia. Medellín, Colombia.
(3) Docente U de A
Correspondencia: Patricia E. Jaramillo. Dirección: Cra 49 # 13 A sur 92 apto 1608 Medellín, Colombia. Teléfono: 3006012685 Email: patelen17@gmail.com
Resumen
Introducción: Las leucemias agudas son neoplasias caracterizadas por la expansión clonal en la médula ósea de células inmaduras. A pesar de su relevancia en la hematooncología, falta información sobre el comportamiento epidemiológico, clínico y diagnóstico en Colombia.
Objetivo: Caracterizar las leucemias agudas evaluadas mediante aspirado, biopsia e inmunofenotipo por citometría de flujo en médula ósea (MO) a partir de los criterios de la OMS y los aspectos demográficos de la población en estudio.
Materiales y métodos: Estudio descriptivo transversal. Se analizaron los datos de 65 pacientes mayores de 15 años y diagnosticados de novo entre los años 2012 y 2015.
Resultados: La razón hombre:mujer fue de 1,2:1. Las leucemias mieloides agudas (LMA) fueron las más frecuentes y el subtipo con mayor número de casos fue la LMA con maduración. Las leucemias linfoides agudas (LLA) representaron el 43,8% de los casos, de mayor frecuencia la LLAB. Se observó proporcionalidad entre el porcentaje de células inmaduras evaluadas por aspirado y citometría de flujo en MO. La mayoría de los pacientes presentaba aspirado y biopsia hipercelulares. La anemia y trombocitopenia se presentaron con alta frecuencia. Se observó la presencia de marcadores monoclonales aberrantes tanto en las LMA como en las LLA.
Conclusiones: Los datos obtenidos en este estudio muestran relación con investigaciones similares presentando algunas variaciones respecto a la frecuencia de presentación, edad, y expresión de marcadores monoclonales.
Palabras clave: Leucemia aguda (LA), leucemia mieloide aguda (LMA), leucemia linfoide aguda (LLA), aspirado, biopsia, citometría de flujo, medula ósea (MO).
Introducción
Las leucemias agudas (L.A) son un grupo heterogéneo de neoplasias clonales que se caracterizan por la proliferación de células inmaduras (1).
En Colombia, según el Instituto Nacional de Salud, entre los años 2007 al 2011, se presentaron 62.818 casos de cáncer de los cuales 2.473 correspondieron a leucemia (2). Para el año 2012, acorde a GLOBOCAN, se reportaron 2.628 y se espera que para el año 2020 el número ascienda a los 3.200 casos. Según el sexo, tanto en los hombres como en las mujeres,para el año 2012, las leucemias se encontraron entre los 10 primeros tipos de cáncer, ocupando el sexto y el noveno lugar respectivamente (3). En el departamento de Antioquia, en el periodo 2007-2011, se observó un comportamiento similar al evidenciado a nivel nacional, ocupando en los hombres el octavo y en las mujeres el onceavo lugar (2).
A pesar de la relevancia de las leucemias en el ejercicio de la hematooncología, en el país y en el departamento se han publicado pocas revisiones de los casos registrados de estas patologías en adultos, además los registros nacionales no establecen la incidencia de las leucemias agudas y, en consecuencia, no se cuenta con información actualizada sobre el comportamiento tanto clínico como epidemiológico de las mismas, lo que dificulta la identificación de grupos de riesgo, el diagnóstico temprano y el tratamiento oportuno.
Estudios publicados por el Hospital Pablo Tobón Uribe de Medellín en el año 2006 ratifican la necesidad de realizar una revisión más amplia y actualizada que involucre un mayor número de pacientes para así aportar conclusiones con mayor trascendencia sobre el comportamiento clínico y epidemiológico de las leucemias agudas en nuestra población colombiana (4).
Se pretende aportar datos epidemiológicos regionales de las leucemias agudas y establecer la relación entre las diferentes tecnologías usadas como apoyo diagnóstico.
Objetivo general
Caracterizar las leucemias agudas evaluadas mediante Aspirado, Biopsia e inmunofenotipo por Citometría de flujo en médula ósea a partir de los criterios de la OMS y los aspectos demográficos de la población en estudio.
Objetivos específicos
- Describir demográficamente los pacientes diagnosticados con leucemia aguda.
- Describir los resultados obtenidos a partir de las pruebas de laboratorio realizadas en la población de estudio.
- Analizar la morfología de las células inmaduras en el aspirado de médula ósea y los marcadores monoclonales de las células neoplásicas identificados en la citometría de flujo.
Referentes teóricos
Las leucemias agudas (L.A) son un grupo heterogéneo de neoplasias que se caracterizan por la presencia de células inmaduras (blastos) en la médula ósea, debido a su expansión clonal a partir de una célula madre hematopoyética que presenta mutación. Dicha proliferación origina la sustitución gradual del tejido hematopoyético normal, con descenso en los recuentros normales de las líneas celulares hematopoyéticas, paso de células inmaduras a sangre periféricae infiltración tisular. (1)
Para el diagnóstico de las L.A se hace mandatorio la realización de tres ayudas diagnósticas complementarias:
- El aspirado de médula ósea (AMO) el cual, acorde a lo descrito por Beléndez et al, es una herramienta imprescindible que proporciona información cualitativa y semicuantitativa de los precursores hematopoyéticos (5).
- La biopsia de médula ósea (BMO), que permite evaluar los cambios patológicos tisulares y la celularidad de forma semicuantitativa, siendo indispensable en pacientes con aspirado insuficiente y/o blastos escasos o ausentes en sangre periférica (6,7).
- La citometría de flujo (CF), considerada un complemento importante de las técnicas utilizadas tradicionalmente ya que permite determinar múltiples parámetros celulares importantes para cuantificar y clasificar las células hematopoyéticas clonales (8, 9,10).
Existen diferentes sistemas para clasificar las leucemias agudas. Tradicionalmente se han empleado los criterios propuestos entre los años 1976 y 1999 por el grupo de cooperación FAB (FrancoAmericanoBritánico) (11). Sin embargo, a partir del año 2001, la Organización Mundial de la Salud (OMS), (12) establece una nueva forma de clasificar las leucemias teniendo en cuenta no sólo las características clínicas, hematológicas e histológicas, sino también el inmunofenotipo por CF (9), la citogenética y las pruebas moleculares que, con la actualización realizada en el 2008, cobraron una gran importancia (11).
Para las leucemias mieloides agudas (LMA) se consideran los subgrupos: LMA con anormalidades genéticas recurrentes, LMA con cambios relacionados a mielodisplasia, neoplasia mieloide relacionada a terapia, LMA sin otras especificaciones (NOS), sarcoma mieloide, neoplasia mieloide relacionada a síndrome de Down y neoplasia de células dendríticas blásticas plasmocitoides. Uno de los antígenos de mayor expresión en las LMA es la mieloperoxidasa (MPO), en los casos en los que esta se encuentre negativa es necesario identificar más de dos antígenos mieloides positivos para confirmar el linaje, dentro de los que se incluyen el CD13, CD33 y CD117, algunos de inmadurez como CD34, CD38 y HLADR y, según sea la clasificación, antígenos de madurez como CD65 y CD15, monocíticos como CD14, CD4, CD11b, CD11c, CD64 y CD36, o dendríticos blásticos plasmocitoides como CD123 (13, 14,15).
Las leucemias linfoides agudas (LLA) se dividen en: leucemia/ linfoma linfoblástico B sin otras especificaciones, leucemia linfoblástica B con anormalidades genéticas recurrentes y leucemia/linfoma linfoblástico T. Así, en los casos de LLA B con o sin anormalidades se pueden expresar marcadores como CD19, cyCD79a, cyCD22, CD22, CD10, CD38, CD45, HLADR y TdT en algunos casos; mientras que para la LLA T son usuales los marcadores CD1a, CD2, CD3, cyCD3, CD4, CD5, CD7 y CD8, TdT, CD38, CD45 y CD10 en algunos casos (13,14, 16, 17).
En cuanto a las características epidemiológicas, el 80% de las leucemias del adulto son de linaje mieloide, con una tasa de incidencia que incrementa con la edad (18). En contraste las LLA se consideran la principal neoplasia en la edad pediátrica (19).
Materiales y Métodos
Estudio retrospectivo, descriptivo de corte transversal. Se analizaron los datos epidemiológicos y los resultados del estudio morfológico e inmunofenotípico de 65 pacientes mayores de 15 años, diagnosticados de novo con leucemia aguda mieloide (LMA) o linfoide (LLA) en Dinámica IPS, entre enero de 2012 y junio de 2015. Sólo fueron incluidos aquellos pacientes con el resultado de al menos dos de las tres pruebas de laboratorio (AMO, BMO y CF) y se excluyeron aquellos que se encontrabanen recaída, en tratamiento para una leucemia aguda previamente diagnosticada o aquellos con datos demográficos incompletos.
Pruebas de laboratorio
Las pruebas fueron procesadas según el protocolo institucional de Dinámica IPS. Para el análisis morfológico,se empleó la tinción de Wright en el AMO y Hematoxilinaeosina en la BMO. En el caso de la CF, se empleó panel de 8 colores (equipo FACSCanto II, BD), según las recomendaciones de EUROFLOW, con algunas variaciones.
Fuentes de información y recolección de los datos
Los datos demográficos y los hallazgos de laboratorio se tomaron a partir de las historias clínicas proporcionadas por Dinámica IPS. Toda la información obtenida se almacenó en una plantilla creada en Microsoft Excel en la cual se incluyeron las siguientes variables: edad, sexo, presencia de anemia, trombocitopenia, leucopenia, pancitopenia y/o leucocitosis, morfología celular, celularidad del aspirado y la biopsia, porcentaje de células inmaduras en el aspirado y la CF, inmunofenotipo y diagnóstico de cada una de las técnicas.
Para evitar los sesgos de información, todos los datos fueron recolectados por mínimo dos de las investigadoras, las cuales se capacitaron previamente en la interpretación y reporte de los resultados; estos fueron revisados y filtrados para eliminar casos repetidos.
Procesamiento de la información
Para la tabulación, procesamiento de información y generación de cuadros y gráficos de salida se usaron los programas Microsoft Excel® 2013 y SPSS® v.20.
Análisis Estadístico
Se aplicó la prueba de normalidad de Kolmogorov-Smirnov para las variables cuantitativas. En el análisis univariado, se calcularon medidas de tendencia central y dispersión (media, mediana, desviación estándar, valor mínimo y máximo) para las variables cuantitativas y para las cualitativas distribuciones de frecuencia y porcentajes.
Adicionalmente, en el análisis bivariado se usaron las pruebas estadísticas T de Student y Chi cuadrado para observar si existían diferencias estadísticamente significativas. Se consideró estadísticamente significativo un valor p < 0,05
Consideraciones éticas
Esta es una investigación sin riesgo, según la resolución 8430 de 1993 del Ministerio de salud de Colombia.
El acceso a las historias clínicas se solicitó por escrito al comité de ética e investigación de Dinámica IPS. Se garantiza la confidencialidad de la información obtenida, al identificar cada caso mediante un código, lo que permite proteger los datos personales de los participantes. El beneficio de esta investigación es aumentar el conocimiento científi co.
Resultados
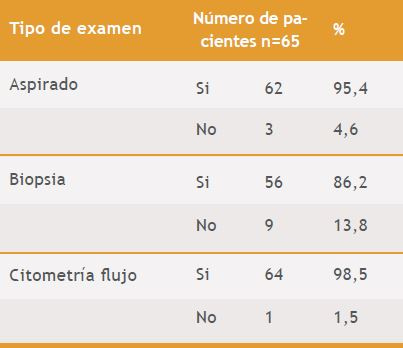
Se analizaron 65 pacientes, en la Tabla 1, se describe la prueba realizada y el número de pacientes a los que se realizó cada prueba. Sólo uno de los pacientes no presentaba el resultado de la CF, razón por la cual no fue incluido en los análisis en los que se cruzaron las variables demográficas (sexo y edad) con el diagnóstico de LLA o LMA, teniendo para estos análisis un total de 64 casos.
Tabla 1. Número de pacientes con el resultado de cada una de las pruebas.
Edad y sexo
De los 65 pacientes incluidos en el estudio, 35 (53,8%) eran hombres y 30 (46,2%) eran mujeres, observándose una razón hombre:mujer de 1,2:1 para el diagnóstico de L.A. El rango de edad estuvo entre los 16 y 80 años, con una mediana de 45 años y una media, en general, de 44,4 ± 17,5 años.
Edad y diagnóstico de LMA
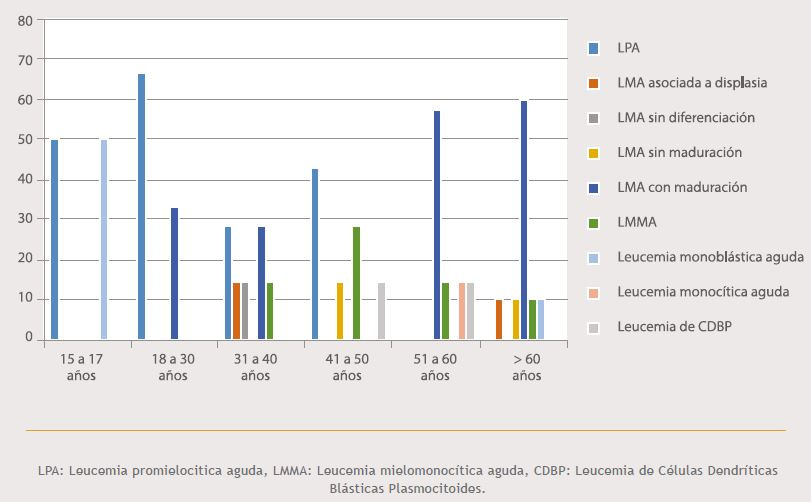
La distribución de los pacientes diagnosticados con LMA, según los rangos de edad establecidos, se ilustra en la Figura 1. Se obtuvo un total de 36 (56,3%) casos de LMA. La edad promedio de presentación fue de 48,8 ± 17,1 años. El grupo etario que predominó fue el de los adultos mayores de 60 años, con un 27,8% (10/36 casos). En contraste, el menor número de casos se presentó entre los 15 a 17 años, representando un 5,6% (2/36 casos). Vale la pena resaltar que, al sumar los casos incluidos entre los 31 a 60 años, se obtuvo un 58,2% de la totalidad de los casos. Se hallaron diferencias estadísticamente significativas entre la edad y el diagnóstico de LMA (p=0,000).
Figura 1. Distribución de los casos de LMA, según los grupos etarios.
Sexo y diagnóstico de LMA
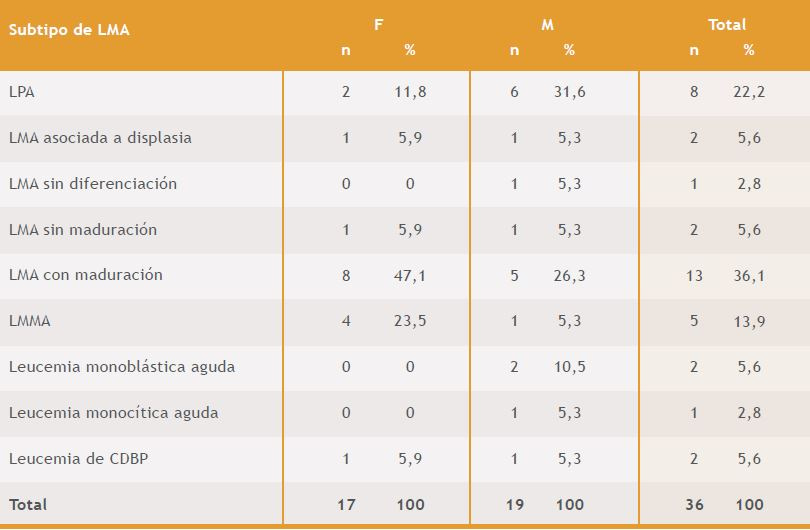
Del total de los casos de LMA, 19 correspondieron al sexo masculino y 17 al sexo femenino, para una razón 1,1:1. El subtipo que predominó fue la LMA con maduración (36,1%), seguido por la leucemia promielocitica aguda (LPA) (22,2%). (Tabla 2). En el sexo masculino, el subtipo mas frecuente fue la LPA, con un 31,6% (6/19 casos),a diferencia en el sexo femenino predominó la LMA con maduración, con un 47,1% (8/17 casos). No se encontraron diferencias estadísticamente significativas entre el sexo y el diagnóstico de LMA (p=0,3947).
Tabla 2. Clasificación de los pacientes con LMA según el sexo y el subtipo de LMA
Edad y diagnóstico de LLA
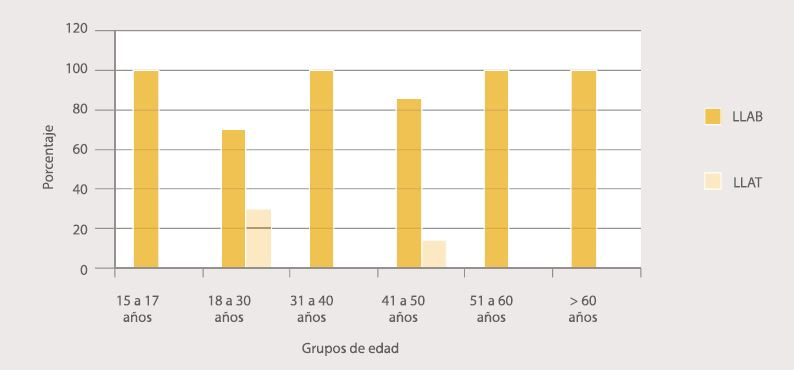
Se presentaron 28 (43,8%) casos de LLA. La edad promedio de presentación de LLA fue 37,4 años ± 16,6 años. El grupo etario con mayor número de casos fue el de 18 a 30 años con un 35,7% (10/28 casos). Entre los 15 a 18 años y en los mayores de 60 años se presentó el menor número de casos, cada uno con un 7,1% (2/28 casos respectivamente). La LLAB estuvo presente en todos los grupos etarios. La LLAT sólo se presentó en jóvenes de 18 a 30 años, con un 30% (3/10 casos) y entre los 41 a 50 años, en menor porcentaje 14,3% (1/7 casos). (Figura 2). No se hallaron diferencias estadísticamente significativas entre la edad y el diagnóstico de LLA (p=0,5712).
Figura 2. Distribución de los casos de LLA, según los grupos etarios
Sexo y diagnóstico de LLA
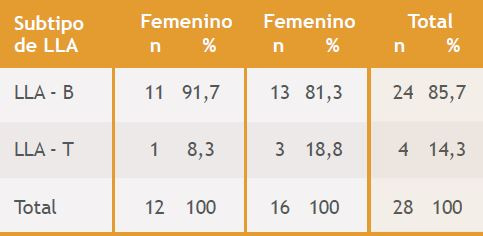
De los 28 casos de LLA, se observó un total de 16 pacientes del sexo masculino y 12 del sexo femenino, para una razón 1,3:1 (Tabla 3). Ambos sexos presentaron un mayor porcentaje de casos de LLAB, con un 81,3% (13/16 casos) en los hombres y 91,7% (11/12) en las mujeres. En cuanto a la LLAT, se evidenció un mayor número de casos del sexo masculino (3/4 casos), para una razón 3:1. No se hallaron diferencias estadísticamente significativas entre el sexo y el diagnóstico de LLA (p= 0,6132)
Tabla 3. Clasificación de los pacientes diagnosticados con LLA según el sexo y el subtipo de LLA.
Sospechas clínicas
En los paraclínicos evaluados se observó: trombocitopenia en un 81,5%, anemia en 72.3%, leucopenia en 49,2%, pancitopenia en 40% y leucocitosis en 32.3%. Igualmente se encontró la presencia de células inmaduras en sangre periférica en 13 pacientes (20%), sin embargo, el 66,2% de la población no incluía en la historia clínica información sobre estos datos ni sobre otros hallazgos como hepatoesplenomegalia (información sólo en el 4,6%), adenopatías (3,1%), equimosis (3,1%), petequias (1,5%) y esplenomegalia (1,5%).
Porcentaje de células inmaduras en el Aspirado vs. Porcentaje de células inmaduras en la Citometría de flujo
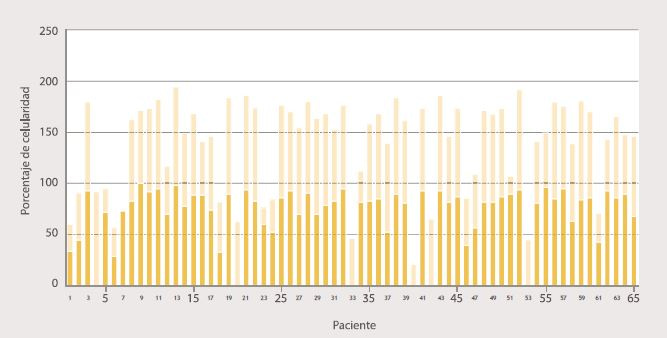
Se observó proporcionalidad entre el porcentaje de células inmaduras observado mediante el AMO (barra azul oscuro) y el obtenido por CF (barra azul claro) (Figura 4). Algunos casos, como previamente se mencionó, no presentaron resultado del aspirado (pacientes número 4, 40 y 42) o la CF (paciente número 7). A los pacientes 20, 33 y 53 a pesar de que se les realizó el aspirado, no presentaban el dato sobre el porcentaje de células inmaduras. Se observó que en 10 de los 65 casos hubo diferencias significativas en cuanto al porcentaje de células entre las dos técnicas, obteniéndose un recuento por CF menor al observado en el aspirado en 9 de ellos.
Figura 4. Comparación entre el porcentaje de células inmaduras observado en el aspirado de médula ósea y el porcentaje de células inmaduras obtenidas en la citometría de flujo.
Celularidad del Aspirado vs. Celularidad de la Biopsia
De los 65 pacientes, 62 les fue realizado aspirado donde el 92% fueron hipercelulares, 3,2% normocelulares y 4,8% tuvieron muestra diluida. 56 pacientes contaban con el resultado de la biopsia y todas concluyeron infiltración por leucemia aguda; el 92,8% fueron hipercelulares y 7,2% normocelulares para la edad. En los casos en los que la muestra del aspirado fue diluida, la biopsia concluyó hipercelularidad.
Expresión de marcadores aberrantes
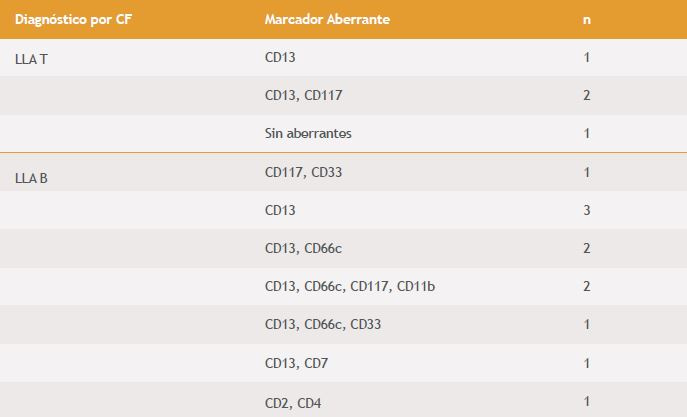
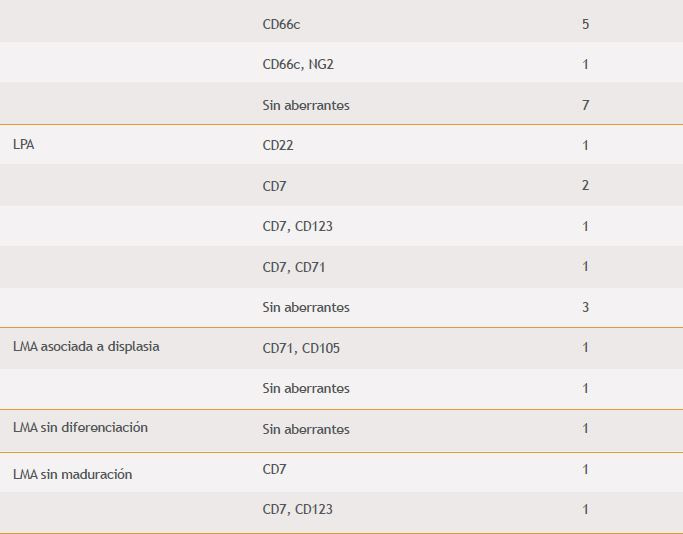
Todas las leucemias expresaron los antígenos inmunfenotipicos comunes de cada linaje indicados por la OMS. La presencia de fenotipos aberrantes se observó en el 58% de los pacientes evaluados, identificando hasta 4 expresiones aberrantes en algunos casos, con nivel de expresión bajo. El 75%de las LLA T expresaron marcadores mieloides, pero no de linfoides B. El 71% de las LLA B expresaron marcadores de linaje mieloide y linfoide T. El 47% de las LMA expresaron marcadores de linaje linfoide B, T, eritroide y dendrítico (en los casos que no era LMA CDBP) (Tabla 4)
Tabla 4. Número de pacientes por marcador aberrante según el subtipo de L.A

Discusión
En este estudio no se observó predominio de casos de leucemia aguda con respecto al sexo, lo que concuerda con lo hallado por Antoyo et al. y Gonzalez et al. en México, quienes reportaron una razón hombre: mujer de 1,1:1 similar a la encontrada en la presente investigación (19, 20).
La LMA predominó sobre la LLA, resultados similares a lo reportado por Dores et. al y Juliussonet al. en los Estados Unidos (21,22). En estos casos de LMA no se observó predominio con respecto al sexo, diferente a lo hallado en investigaciones realizadas a nivel nacional por Duque Sierra et al. y Díaz–Correa et al. en la ciudad de Medellín, quienes reportaron un ligero predominio de casos del sexo femenino (razón hombre:mujer 0,8:1 y 0,6:1 respectivamente), y por Martínez en la ciudad de Bogotá, quien reportó una razón 0,7:1 (19, 23, 24).
Investigaciones realizadas en Bolivia por Amaru et al. arrojaron resultados diferentes a lo hallado en el presente estudio con respecto al tipo de leucemia aguda más común en la población adulta, reportando la presencia de un mayor número de casos de LLA (54% y 52% del total de los casos), cifras que difieren al 20% de casos esperados de LLA en adultos, reportado en Bolivia (25, 26).
Es importante destacar que, aunque en la población de estudio predominó la LMA, la LLA representaron el 43,8% de los casos totales, cifra mayor a la esperada para la población adulta, pues según la literatura el 75% de los casos de las LLA se presentan en la población menor de 6 años (16).
En las LMA el subtipo que presentó el mayor número de casos fue la LMA con maduración, dato que está de acuerdo a lo descrito en la literatura (14,16), pero difiere de lo reportado en otros países latinoamericanos como Cuba y México donde la variante mielomonocítica fue la más común (18, 19, 20). En segundo lugar, se encuentra la LPA, con un importante porcentaje de casos (22,2%), similar a lo reportado en estudios realizados en población latinoamericana (frecuencia del 24%) (27,28). Estos hallazgos difieren de lo reportado a nivel nacional, en el año 2004, por Martínez O, quien halló una frecuencia significativamente menor (12,7%) (24).
El subtipo de LLA más frecuente fue la LLAB, como se esperaba según la literatura (14, 16). No se observó predominio de casos con respecto al sexo en las LLA, diferente a lo encontrado en estudios en Jordania y China, en los que se ha evidenciado un mayor número de casos de LLA en pacientes del sexo masculino (29, 30). En cuanto a la LLAT, se observó un predominio del sexo masculino en este estudio, lo cual está acorde con lo reportado en la literatura (21,14, 16, 30).
El grupo etario que predominó en la LLA fue el de los pacientes entre los 18 y 30 años, rango encontrado como el más frecuente en la población adulta boliviana (26).
El comportamiento de las leucemias según la edad, se ilustra en la Figura 5. En esta población se observó que las LMA presentan un evidente incremento de casos en la población adulta joven, que alcanza su pico máximo a partir de los 60 años. Este patrón es similar a lo reportado en individuos norteamericanos (21, 22, 31).
Figura 5. Comportamiento de las LMA y las LLA según el número de casos presentados en cada grupo etario.

Es importante tener en cuenta que el promedio de presentación de la LMA en este grupo de pacientes (48,8 años) es inferior al reportado en población norteamericana (67 años) (31, 32) y que el porcentaje de casos de los 31 a 60 años, es superior al observado en los mayores de 60 años, lo que podría indicar que en nuestra población (colombiana) se está presentando un importante número de casos de LMA en edades más tempranas.
El comportamiento de las LLA es totalmente distinto, mostrando una distribución bimodal, similar al observado en población brasilera, donde al igual que en este estudio, se evidenció la presencia de un segundo pico alrededor de los 50 años (33). La literatura sugiere una distribución de desplazamiento hacia la izquierda, situación que también se comprobó en los pacientes incluidos en este estudio (Figura 5) (30, 34, 35).
Según lo informado en las historias clínicas, los resultados de laboratorio que con mayor frecuencia se observaron fueron trombocitopenia y anemia, lo cual concuerda con lo reportado en la literatura, donde la anemia, trombocitopenia y/o leucopenia se mencionan como las manifestaciones clínicas más frecuentes en las L.A (25, 36, 37). Lo anterior puede explicarse en término de falla secundaria de la médula ósea por la infiltración de las células neoplásicas (37, 38).
El 92% de las médulas óseas de este estudio fueron hipercelulares, lo cual está descrito como una de las características de las neoplasias agudas (39).
En la revisión de la expresión de marcadores, el 58% de las leucemias agudas expresaron antígenos aberrantes, donde el más frecuente para el caso de las LMA fue el CD7 y para las LLAB y T el CD13. Estos resultados coincidieron con los encontrados por Piedras et al. y en otros estudios similares, en los que estos antígenos también fueron los más expresados (9, 40, 41, 42).
Las LLAB expresaron además antígenos de linaje linfoide T: CD2, CD4 y CD7 que han sido reportados en otros estudios, en casos aislados (13). En las LMA el antígeno de linaje linfoide B con mayor expresión fue CD22. Este resultado es similar al hallado por Pino et al. en Cuba (41). Sin embargo, hubo diferencia en lo descrito por Novoa et al. en Argentina, donde CD19 fue el antígeno linfoide B de mayor expresión (9).
Adicionalmente, en este estudio se encontró la expresión aberrante del antígeno eritroide CD71 y del dendrítico CD123 en las LMA, y del antígeno mieloide CD66c en las LLA, sin embargo, no se encontraron estudios que reportaran la expresión de estos antígenos como aberrantes.
La expresión de marcadores monoclonales aberrantes se relaciona con la presencia de algunas anormalidades genéticas recurrentes importantes para determinar el manejo pronóstico de los pacientes. Esta investigación tuvo como limitante la carencia de datos sobre las pruebas citogenéticas y moleculares, debido a las dificultades para acceder a dicha información.
Conclusiones
Los datos obtenidos en este estudio muestran relación con investigaciones similares, con algunas variaciones con respecto a la frecuencia de presentación, la edad y la expresión de marcadores monoclonales. Estos hallazgos posiblemente requieran ser confrontarlos en estudios con una mayor población.
La carencia de algunos datos en las historias clínicas pone en evidencia necesidad de contar con informes completos, teniendo en cuenta la importancia de estos como primer acercamiento al paciente orientación al diagnóstico y pronóstico.
Es importante reconocer y ratificar la importancia de utilizar en conjunto la morfología, la citometría de flujo, la citogenética y las pruebas moleculares como herramientas complementarias y fundamentales para establecer un diagnóstico preciso que represente mayores expectativas de vida para el paciente y la posibilidad de un adecuado tratamiento.
Finalmente, aportar datos epidemiológicos de la población colombiana ayudará no sólo a identificar la población en riesgo sino también a demostrar la necesidad de un sistema con mayor cobertura que incluya las herramientas necesarias para el diagnóstico de las leucemias agudas en el país, y que puedan llegar a ser incluidas en el Plan Obligatorio de Salud (POS).
Agradecimientos
A la Universidad de Antioquia y a Dinámica IPS, por ser los facilitadores del desarrollo de este estudio y por darnos las herramientas que permitieran la realización del mismo.
Conflicto de intereses
Las autoras declaran no tener conflicto de interés
Referencias Bibliográficas.
1. Díaz-Ruiz R, et al. Análisis de características clínico biológicas de leucemia aguda linfoblástica (LAL) del adulto. Gac Med Mex. 2015; 151:150-6.
2. Pardo C, Cendales R. Incidencia, mortalidad y prevalencia de cáncer en Colombia, 2007-2011. Primera edición. Bogotá. D.C. Instituto Nacional de Cancerología, 2015; 1, 148 p.
3. Ferlay J, Soerjomataram I, Ervik M, Dikshit R, Eser S, Mathers C et. al. GLOBOCAN 2012 v1.0, Cancer Inci-dence and Mortality Worldwide: IARC CancerBase No. 11 [Internet]. Lyon, France: International Agency for Re-search on Cancer; 2013. Available from: http://globocan.iarc.fr. [última con- sulta 19 de Junio de 2016].
4. Duque L, Restrepo C, Zapata A, Duque J, Donado J, Mejía G. Características morfológicas, citogenéticas e inmunofenotípicas de pacientes con leucemia mieloide aguda. Medellín, Colombia. CIMEL 2006; 11(2).
5. Beléndez C, Cela E, Galarón P.Punción-aspiración de médula ósea. An Pediatr Contin. 2007; 5: 52-4.
6. Pineda DKM, Rosas GG, Rosas GMI, Rosas UA. Biopsia de médula ósea: utilidad y limitaciones. Patol Rev Lati-noam 2008; 46(3):237-47.
7. Figueredo SJ. Diagnóstico citohistoquímico sistemático en biopsias de médula ósea y citologías hematológicas en el Paraguay. An. Fac. Cienc. Méd UNA 2005;38: 9 – 21.
8. Barrera LM, Drago ME, PÉREZ J, Zamora AC, Gómez F, Sainz TDR et al. Citometría de flujo: vínculo entre la investigación básica y la aplicación clínica. Rev Inst Nal Enf Resp Mex. 2004; 17: 42-55.
9. Novoa V, Nuñez NA, Carballo OG, Lessa CF. Inmunofenotipos aberrantes en leucemias agudas en una población hospitalaria de Buenos Aires. MEDICINA (Buenos Aires) 2013; 73: 9-16.
10. Soriano I, Vásquez E, Niquén S, Fernández M, Castañeda K, Fernández J et al. Caracterización inmunofenotípica de leucemias agudas diagnosticadas en un Hospital Nivel III en el periodo 201-2013, Chiclayo-Perú. Rev. cuerpo-méd. HNAAA 2015; 8(1).
11. Bain, B. J. Front Matter, in Leukaemia Diagnosis, Fourth Edition, Wiley-Blackwell, Oxford, UK. (2010) 391 p.
12. Vardiman JW, Thiele J, Arber DA, Brunning RD, Borowitz MJ, Porwit A et al. The 2008 revision of the World Health Organization (WHO) classifica-tion of myeloid neoplasms and acute leukemia: rationale and important changes. Blood. 2009; 114:937-951.
13. Ortolani C. Flow Cytometry of HematologicalMalignancies. Ve-nice:WileyBlackwell; 2011. 311 p.
14. Swerdlow SH, Campo E, Harris NL,Jaffe ES, Pileri SA, Stein H et al. WHO Classification of Tumours of Haematopoietic and Lymphoid Tissues. Fourth Edition. WHO; 2008. 439 p.
15. Saavedra C, Quijano SM, Romero M, Jaramillo R, Orduz R, Echeverri C et al. Reporte del primer consenso colombiano de citometría de flujo para el estudio de trastornos hematológicos. Biomédica 2010;30(Supl):11-21
16. Jaffe ES, Harris NL, Vardiman JW, Campo E, Arber DA.Hematopathology. First Edition. Philadelphia, PA: Saun-ders-Elsevier; 2011. 1058 p.
17. Kaushansky K, Lichtman MA, Prchal JT, Levi MM, Press OW, Burns LJ, et al. Williams Hematology. Nineth Edition. USA: McGraw-Hill Education; 2016. 2505 p.
18. Gómez RA, Fernández JD, Dita L, Guerra T. Sobrevida en pacientes con leucemia aguda no linfoblástica en el Hospital “Dr. Gustavo Aldereguía Lima”. Experiencia de diez años. Medisur 2010; 8(5)
19. González WM, Olarte I, Gutiérrez M, Montaño EH, Martínez C, Ramos CO. Frecuencia de leucemias agudas en un hospital de referencia. Rev Med Inst Mex Seguro Soc 2012; 50 (2).
20. Santoyo A, Ramos C, Palmeros G, Mendoza E, Olarte I, Martínez A et al. Leucemias agudas. Características clínicas y patrón estacional.Rev Med Inst Mex Seguro Soc. 2014; 52 (2):176-81.
21. Dores G, Devesa SS, Curtis RE, Linet MS, Morton LM. Acute leukemia incidence and patient survival among children and adults in the United States, 2001-2007. January 5, 2012; Blood: 119 (1).
22. Juliusson G, Lazarevic V, Hörstedt AS, Hagberg O, Höglund M; Swedish Acute Leukemia Registry Group.Acute myeloid leukemia in the real world: why population-based registries are needed. April 26, 2012; Blood: 119 (17).
23. Díaz LM, Madrid CA, Combariza JF, Gálvez KM, Olaya V, Donado JH. Supervivencia de los pacientes adultos con leucemia mieloide aguda en el departamento de Hematología del Hospital Pablo Tobón Uribe entre los años 2004 y 2010. 2012;31(2):105–12.
24. Martínez O. Epidemiología de la leucemia promielocítica aguda en el adulto.Acta Médica Colombiana 2004; 29 (3).
25. Amaru R, Torres G, Limachi M, Peña-loza R, Miguez H, Vargas ML et al. Epidemiología de las leucemias en Bolivia: Evaluación de 933 casos. Rev. Bolivianas. 2008; 53 (2).
26. Amaru R, Torres G, Peñaloza R, Mi-guez H, Velarde J, Huarachi N et. al. Epidemiología de las leucemias en Bolivia: 1473 casos enero 1999 a mayo de 2012.Rev. Méd. La Paz. 2012; 18 (1).
27. Douer D, Preston-Martin S, Chang E, Nichols PW, Watkins KJ, Levine AM. High frequency of acute promyelocytic leukemia among Latinos with acute myeloid leukemia. Blood. 1996 Jan 1;87(1):308-13
28. Maule M, Dama E, Mosso ML, Magnani C, Pastore G, Merletti F. High incidence of acute promyelocytic leukemia in children in northwest Italy, 1980–2003: a report from the Childhood Cancer Registry of Piedmont. Leukemia. 2008; 22, 439–441.
29. Abbasi S, Maleha F, Shobaki M.Acute Lymphoblastic Leukemia Experience: Epidemiology and Outcome of Two Dif-ferent Regimens. Mediterr J Hematol Infect Dis. 2013; 5(1): e2013024.
30. Li SY, Ye JY, Meng FY, Li CF, Yang MO. Clinical characteristics of acute lymphoblastic leukemia in male and female patients: A retrospective Analysis of 705 patients. Oncol Lett. 2015 Jul; 10(1): 453–458.
31. SEER Cancer Statistics Factsheets: Acute Myeloid Leukemia. National Cancer Institute. Bethesda, MD. [Internet] Available From:http://seer.cancer.gov/statfacts/html/amyl. html [última consulta 16 de ju-nio de 2016].
32. American Cancer Society. Leucemia mieloide (mielógena) aguda. [Internet] Available from: http://www.cancer.org/ acs/groups/cid/documents/webcontent/002302-pdf.pdf [última consulta 8 de Julio de 2016].
33. Costa Barbosa SF, Costa Ca, Canto Ferreira L, Souza D, Brito TC, Rodri-gues JA et al. Aspectos epidemiológicos dos casos de leucemia e infomas em jovens e adultos atendidos em hospital de referência para câncer em Belém, Estado do Pará, Amazônia, Brasil. Rev Pan-Amaz Saude 2015; 6(1):43-50
34. Inaba H, Greaves M, Mullighan CG. Acute lymphoblastic leukaemia. Lan-cet. 2013 Jun 1; 381(9881):1943-55.
35. SEER Cancer Statistics Factsheets: Acute Lymphocytic Leukemia. National Cancer Institute. Bethesda, MD.[Internet]. Available from:seer.cancer.gov/statfacts/html/alyl.html [última consulta 19 de junio de 2016].
36. Polo AM, Leon CA, Pérez JF, Yovera JD, Barraza O, Torres V et al. Características clínico epidemiológicas de los pacientes con Leucemia Aguda del Servicio de Hematología del Hospital Almanzor Aguinaga Asenjo. Horiz Med. 2014; 14(1):18-23
37. Hatton CS, Hughes-Jones NC, Hay D. Keeling D. Haematology – Lecture Notes. Ninth Edition. London: Wiley-Blackwell; 2013. 154 p.
38. Mehta AB, Hoffbrand AV. Haematolo-gyat a Glance. Fourth Edition. London: Wiley-Blackwell; 2014. 135 p.
39. Ross MH, Pawlina W. Histología: texto y atlas color con biología celular y molecular. Quinta Edición. Madrid: Editorial Médica Panamerica; 2007. 75 p.
40. Piedras J, López J, Cárdenas MR. Inmunofenotipos celulares en 97 adultos con leucemia aguda. Rev. invest. clín 1997; 49(6):457-64
41. Pino D, Macias C, Lahera T, Marsan V, Sánchez MC, Valle L et al. Caracterización inmunofenotípica de pacientes con leucemia mieloide aguda. Revista Cubana de Hematol, Inmunol y Hemoter. 2014;30(1):27-35
42. Emerenciano M, Bossa Y, Zanrosso CW, Alencar DM, Mendes M, Dobbin J et al. Freqüência de inmunofenótipos aberrantes em leucemias agudas. Revista Brasileira de Cancerologia 2004; 50(3): 183-189