Sistema de Gestión de la Calidad para Laboratorios Clínicos Privados de Venezuela bajo la Norma Internacional ISO 15189:2012
Luz M. Carrero-Gomez 1, Desireé Vázquez 2
marinaluz00@gmail.com, desireevazquez2000@gmail.com
1 Área de Ingeniería, Programa en Sistemas de la Calidad, Universidad Católica Andrés Bello, Caracas, Venezuela
2 Área de Ingeniería, Programa en Sistemas de la Calidad, Universidad Católica Andrés Bello, Caracas, Venezuela
Resumen
En la actualidad la calidad es un elemento fundamental en la gestión de las empresas, es por lo tanto una tarea importante mantener y evaluar el grado de calidad que han alcanzado. La investigación tiene como objetivo “Proponer un modelo de Sistema de Gestión de la Calidad en los laboratorios clínicos privados de Venezuela bajo la Norma Internacional ISO 15189:2012”. Es importante resaltar, que en septiembre del 2013 se publicó una actualización de la norma 15189:2013 – para los laboratorios. En Europa se pedía la actualización de sus prácticas de acuerdo a esa nueva actualización, efectivas para el 1 de marzo del 2016. Para el logro de este objetivo, se realizará una investigación de campo y modalidad investigación proyectiva. Tendrá las siguientes fases de desarrollo: conocer los laboratorios clínicos privados certificados bajo la norma ISO 9001:2008; determinar el nivel de madurez en calidad en los laboratorios certificados a través del anexo “A” de la Norma Internacional ISO 9004:2009, comparar la madurez de gestión de los laboratorios clínicos privados certificados y no certificados y finalmente diseñar el modelo de gestión de la calidad para laboratorios clínicos privados. La recolección de la información se hará a través de cuestionario, entrevistas estructuradas y observación directa. Con la realización del trabajo se busca orientar a los laboratorios clínicos a que un sistema de gestión de la calidad proporciona una guía para la mejora sistemática y continua del desempeño global de la organización, con opciones adicionales de lograr una certificación o acreditación incrementando su impacto en la gestión de todos los procesos y aumentando el grado de satisfacción de las expectativas de los clientes y demás partes interesadas.
Palabras Clave: sistema de gestión de la calidad, laboratorios clínicos, acreditación, madurez de calidad.
Abstract
Nowadays, Quality is a key aspect in Companies Management; therefore, it is important to maintain and assess the level of quality achieved. This research aims to «Propose a Quality Management System Model for private medical laboratories in Venezuela, according to the ISO 15189: 2012». It is important to note that an update of the standard 15189: 2013 for laboratories was published in September 2013. In Europe, it was requested to update practices according to this new update, in force since March 1, 2016. In order to fulfill this objective, a field research and projective research modality will be carried out , consisting of the following stages of development: To identify private medical laboratories certified under the ISO 9001: 2008 ; to determine the level of quality maturity in certified laboratories through Annex «A» according to the ISO 9004: 2009, to compare the management maturity of certified and non-certified private medical laboratories, and finally, to design the Quality Management Model for private medical laboratories. Data will be collected through questionnaire, structured interviews, and direct observation. The work is aimed at guiding medical laboratories to a Quality Management System which provides a guide for consistent and continuous improvement of the organization overall performance, with additional options to achieve certification or accreditation, thus increasing its impact over management of all the processes, and enhancing the level of satisfaction of customers and stakeholders’ expectations.
Introducción
Las empresas buscan entregar un producto y servicio con mejores características para cumplir con los requisitos propios y los de sus clientes. La implementación de un buen sistema de calidad ayudará a la organización a cumplir con los requisitos de sus clientes y usuarios en cuanto al producto y a la prestación del servicio que ofrece, generando en ellos la satisfacción de sus requerimientos.
Los servicios de salud, y dentro de ellos, los laboratorios clínicos requieren de un sistema de gestión que les permita garantizar la calidad de sus procesos y resultados desde el momento que el médico emite una solicitud de análisis, hasta cuando recibe los resultados de la misma.
El sistema de gestión de la calidad que se puede implantar en los laboratorios clínicos puede responder a distintos modelos y normativas, siendo el más aceptado internacionalmente el de las normas ISO (International Organization for Standardization) elaboradas por la Organización Internacional de Normalización. En este marco, el desarrollo e implementación de un sistema de gestión de la calidad apunta hacia la obtención de una certificación, donde la organización debe cumplir con los requisitos exigidos por la Norma Internacional ISO 9001:2008 “Sistemas de Gestión de la Calidad – Requisitos”, demostrando así su capacidad para proporcionar regularmente productos que satisfagan los requisitos del cliente, los legales y reglamentarios aplicables. Por otra parte, la Organización Internacional para la Normalización (ISO) publicó la Norma ISO 15189:2012 “Laboratorio Clínico. Requisitos particulares para la calidad y la competencia”, que establece los requerimientos que debe cumplir el laboratorio para demostrar su adecuado sistema de gestión de la calidad y competencia técnica, siendo esta norma el instrumento para la acreditación de los laboratorios clínicos en el país.
En relación a lo anteriormente expuesto, la presente investigación busca proponer un sistema de gestión de la calidad para los laboratorios clínicos privados siguiendo los requisitos de gestión exigidos por la Norma ISO 15189:2012 “Laboratorio Clínico. Requisitos particulares para la calidad y la competencia”, a partir de un diagnóstico con la aplicación del anexo “A” de la Norma ISO 9004:2009 “Gestión para el éxito sostenido de una organización – Enfoque de Gestión de la Calidad” a laboratorios clínicos privados certificados bajo la Norma ISO 9001:2008 “Sistemas de Gestión de la Calidad – Requisitos”.
Problema
Entre los principales retos que enfrentan las empresas a nivel mundial, se encuentra el alcanzar un nivel de adaptabilidad a las diversas condicionantes del entorno competitivo y globalizado en el que se desarrollan las organizaciones hoy en día. Es por esta razón, que con mayor frecuencia, los ejecutivos de las empresas se plantean dos preguntas: ¿Hacia dónde y cómo debo dirigir la organización? y ¿Qué cambios debería hacer con respecto a cómo hemos venido trabajando? En particular, en estos tiempos a diferencia del pasado, las empresas se enfrentan con problemas de calidad, productividad y competitividad. De ahí, la necesidad de la aplicación de herramientas como la “Administración de la calidad” en las empresas, para lograr el desarrollo adecuado de la estructura administrativa necesaria en donde se promueva el crecimiento de las relaciones entre todos los involucrados, dentro de la organización, en un ambiente que permita ser más competitivo. Si se desea transformar una empresa en una organización que labore con principios de calidad, el punto de partida debe ser el elemento más esencial con el que cuenta: su recurso humano.
Posteriormente, corresponde la implementación de sistemas de gestión de calidad basados en reglamentos y procedimientos, los cuales, representan desde hace algunos años la mejor opción para las empresas de todos los tipos y tamaños que se desenvuelven en diferentes industrias a involucrar procedimientos adecuados y eficientes que reflejen un alto grado de calidad y mejora continua. Uno de los beneficios que brinda la implementación de sistemas de gestión de la calidad bajo ISO 9001, es la certificación, aun así, no significa la eliminación total de fallas en sus procesos internos, pero ofrece métodos y procedimientos eficaces sistematizados para determinar las causas de los problemas para luego corregirlos y evitar que éstos se repitan nuevamente. La certificación de procedimientos de calidad en empresas que ofrecen bienes y servicios a un mercado determinado, representa en cualquier circunstancia un mejor posicionamiento de carácter estratégico con respecto al resto de competidores que no han realizado este proceso, sin importar el tamaño de estas organizaciones.
Actualmente, en los laboratorios clínicos se práctica uno de los componentes de la gestión de la calidad, es decir, el control de calidad, aplicado en las pruebas analíticas realizadas, los cuales participan en programas de calidad entre diferentes laboratorios. Sin embargo, es necesario aplicar la calidad en forma integral en cada ámbito de la organización. Existen laboratorios clínicos los cuales cuentan con sistemas de gestión de la calidad, algunos certificados bajo la Norma Internacional ISO 9001:2008 y otros que aún no lo están o simplemente tienen sistemas de gestión de calidad que contribuyen a la dirección, a la mejora y productividad de los mismos, es por ello, que el éxito solo se puede lograr mediante la gestión eficaz de la organización, autoevaluación, toma de conciencia de su entorno, mediante el aprendizaje y a través de la aplicación apropiada de mejoras, innovaciones o ambas.
Tomando en cuenta el escenario anterior, se formula la siguiente interrogante: ¿Cuál es el modelo del sistema de gestión de la calidad para laboratorios clínicos privados de Venezuela bajo la Norma Internacional ISO 15189:2012?
Justificación
La implementación de un sistema de gestión de la calidad se ha impulsado en los últimos años, desde los organismos públicos y sociedades científicas, como medio para avalar la excelencia de los servicios sanitarios prestados, siendo su finalidad incrementar el grado de satisfacción de la población que recibe los servicios [11].
En este contexto, es cada vez más evidente que el laboratorio clínico además de realizar ensayos con calidad, va a tener que demostrarlo, y la implementación de un modelo de gestión de la calidad se muestra como vía para alcanzar este fin [4].
Es por ello que la investigación guiará los directivos de los laboratorios clínicos a: Comprender la dinámica del sistema de gestión de calidad, generar estrategias que les otorgue mayor competitividad, mejor servicio, mejora continua, superar las expectativas de sus clientes y de otras partes interesadas, implementar los requisitos establecidos en la Norma Internacional ISO 15189:2012, potencializar la participación y motivación de cada uno de los colaboradores dentro de la organización y crear una cultura de calidad en la organización.
Se consultaron los siguientes artículos y trabajos de grado relacionados con sistemas de gestión de la calidad: Bautista [2], en su trabajo de investigación doctoral, “Implantación de un sistema de calidad basado en la norma UNE-EN-ISO 15189 en el servicio de microbiología del Hospital Universitario Virgen de las Nieves de Granada”, en la Universidad de Granada, describe el proceso y evaluación de la implementación de un sistema de calidad ISO 15189 en un laboratorio de microbiología del sistema sanitario público Andaluz, para lo cual inicialmente describió el proceso de acreditación llevado a cabo en el laboratorio de microbiología y posteriormente analizó el proceso de mejora continua en la unidad de urocultivos tras la implantación del sistema de gestión de la calidad. Finalmente, los resultados de dicho estudio proporcionaron la información sobre los beneficios y los aspectos de mayor dificultad derivados de la implantación de un sistema de gestión de la calidad ISO 15189, y a su vez permitió conocer su utilidad real en la mejora de la gestión en un laboratorio de microbiología.
Para la presente investigación el aporte radica en, la formulación de una metodología para la implementación de un sistema de gestión de la calidad en base a los requisitos de la Norma ISO 9001 y posteriormente la aplicación de la autoevaluación presentada por la Norma ISO 9004 con la cual se pretende medir el nivel de madurez de dicho sistema de gestión, demostrando además los beneficios de que genera poseer un sistema de gestión de la calidad en la organización.
Izquierdo [6], en su trabajo de investigación doctoral, titulado “Desarrollo e Implementación de un Sistema de Gestión de la Calidad en un laboratorio de referencia Unidad de Metales, Acreditación según la UNE-EN-ISO15189”, en la Universidad de Zaragoza, la investigación pretendió desarrollar una metodología para llegar a cabo la acreditación de cualquier “metal” en la “Unidad de Metales” del servicio de Bioquímica Clínica, centrándose principalmente en el desarrollo de un sistema de gestión de la calidad documental bajo la Norma Internacional ISO 15189, donde se elaboraron los diversos documentos involucrados en el proyecto de la acreditación, partiendo de los más sencillos, los procedimientos normalizados de trabajo de las diferentes determinaciones, hasta los más complejos, como el manual de la calidad.
Adicionalmente, el estudio dedicó una parte importante a la formación en gestión y control de la calidad de todos los usuarios del laboratorio, puesto que consideraron que de nada sirve desarrollar e implementar un buen sistema de gestión de la calidad documental si las personas que desarrollan su actividad en el laboratorio no han recibido una formación e información adecuadas.
Del trabajo mencionado anteriormente, servirá como apoyo a la presente investigación, la metodología utilizada para el desarrollo del sistema de gestión de la calidad documental según los requisitos exigidos por la Norma de referencia en común, ISO 15189.
Objetivos
A. Objetivo general.
Proponer un Sistema de Gestión de la Calidad para laboratorios clínicos privados de Venezuela bajo la Norma Internacional ISO 15189:2012.
B. Objetivos Específicos.
- Determinar los laboratorios clínicos privados certificados bajo ISO 9001:2008 y los laboratorios clínicos privados no certificados objeto de estudio del área metropolitana del Distrito Capital.
- Medir la madurez de la calidad de los laboratorios clínicos privados según el anexo “A” de la Norma ISO 9004:2009 “Gestión para el éxito sostenido de una organización – Enfoque de Gestión de la Calidad”.
- Comparar la madurez de gestión de la calidad de los laboratorios clínicos privados certificados y los laboratorios clínicos privados no certificados.
- Establecer el modelo del sistema de gestión de la calidad para laboratorios clínicos privados de Venezuela.
Solución propuesta sustentada
A. Tipo y Modalidad de la Investigación: El modelo del sistema de gestión de la calidad para laboratorios clínicos privados de Venezuela bajo la Norma Internacional ISO 15189:2012, será una investigación proyectiva, porque consiste en la elaboración de una propuesta o de un modelo, como solución a un problema o necesidad de tipo práctico, ya sea de un grupo social, o de una institución, en un área particular del conocimiento, a partir de un diagnóstico preciso de las necesidades del momento. El tipo de investigación será de campo, debido a que se van a recolectar datos directamente de los sujetos y de la realidad donde ocurren los hechos, como señala [1].
B. Población y Muestra: La población objeto de estudio son los laboratorios clínicos privados del área metropolitana del Distrito Capital. Y la muestra es parte de todo lo que llamamos universo y que sirve para representarlo; Adicionalmente, Arias [1], expresa el muestreo intencional “los elementos son escogidos con base en criterios o juicios preestablecidos por el investigador” (p.85). Por tal motivo, para que los laboratorios clínicos privados certificados puedan formar parte de la muestra de la investigación deben poseer las siguientes características: Mantener un sistema de gestión de la calidad bajo los lineamientos de la norma ISO 9001:2008 por más de dos años y poseer certificación ISO 9001:2008 otorgada por algún ente certificador (Bureau Veritas o FONDONORMA). Así mismo, los laboratorios clínicos privados no certificados, deberán tener definida una visión, misión, estructura organizativa, ser un laboratorio de referencia, es decir, un “laboratorio externo al que se envía una muestra para su análisis”.
C. Técnicas e Instrumentos de Recolección de Datos: Al referirse a las técnicas e instrumentos de recolección de datos, Sabino [12], define técnica como: “conjunto de mecanismos, medios y sistemas de dirigir, recolectar, conservar, reelaborar y transmitir los datos” (p.149). Para el desarrollo de la investigación se utilizarán la observación y la entrevista. Las entrevistas estarán dirigidas a los encargados de la gestión de la calidad y al equipo directivo de los laboratorios clínicos. Por medio de las entrevistas se busca obtener información detallada y actualizada sobre la situación del sistema de gestión de la calidad, así como de la cultura y clima organizacional.
D. Análisis e Interpretación de los Datos: los datos serán clasificados, registrados, organizados, codificados y tabulados, empleando las técnicas lógicas del análisis de recolección de datos, lo que permitirá resumir las observaciones encontradas en el estudio y proporcionará las respuestas a las interrogantes de la investigación, además, los resultados del análisis se expresarán en gráficos, imágenes, figuras y matrices, tablas, cuadros, planillas y documentos varios elaborados en archivos electrónicos a través de diferentes aplicaciones ofimáticas (Microsoft Word 2010, Microsoft Excel 2010).
Resultados alcanzados
A. Determinar los laboratorios clínicos privados certificados bajo ISO 9001:2008 y los laboratorios clínicos privados no certificados objeto de estudio del área metropolitana del Distrito Capital.
Los laboratorios clínicos privados certificados concretados para la investigación que mantienen un sistema de gestión de la calidad bajo los lineamientos de la norma ISO 9001:2008 por más de dos años y además poseen certificación ISO 9001:2008 otorgada por algún ente certificador (Bureau Veritas o FONDONORMA) son: CORPODIAGNOSTICA servicios para la salud y Laboratorio Clínico Medivar (EXAMINA).
Adicionalmente, los laboratorios clínicos privados no certificados ubicados en el área metropolitana del Distrito Capital, que mantienen una trayectoria en el mercado por más de 5 años como laboratorio de referencia y además tienen una visión, misión, estructura organizativa definida y que conocen las bases y lineamientos de un sistema de gestión de la calidad que formaran parte de la investigación son: Laboratorio Clínico Bacteriológico Gómez Ruiz C.A y Laboratorio Clínico de Referencia Sulab.
B. Medir la madurez de la calidad de los laboratorios clínicos privados según el anexo “A” de la Norma ISO 9004:2009 “Gestión para el éxito sostenido de una organización – Enfoque de Gestión de la Calidad”.
El Diagnóstico es un estudio sistemático, integral y periódico que tiene como propósito fundamental conocer la organización y su funcionamiento, con la finalidad de detectar las causas y efectos de los problemas de la organización, para analizar y proponer alternativas viables de solución que ayuden a la erradicación de los mismos. Para la realización de este diagnóstico fueron entrevistadas las Gerencias de la Calidad y la Dirección General de cada laboratorio objeto de estudio.
Basado en los resultados obtenidos a raíz de la investigación realizada se puede determinar a través del cálculo de la siguiente ecuación (1):
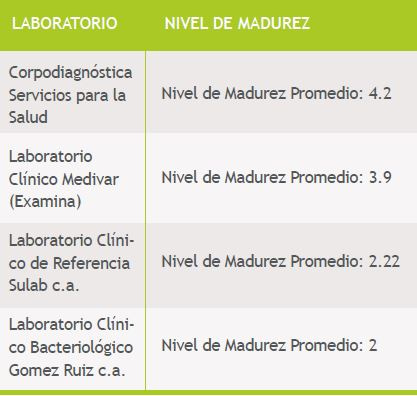
El Nivel de Madurez general presentado por los Laboratorios Clínicos Privados sin certificación, respecto a los elementos claves, es de 2,1 comparado al nivel 1 (Nivel de Base) y el nivel 5 (Mejores prácticas), por lo cual se observa que las organizaciones posee un nivel de madurez por debajo del nivel 3, a diferencia de los Laboratorios Clínicos Privados que mantienen un sistema de gestión de la calidad y que son certificados bajo ISO 9001:2008 por algún certificador, los cuales presentan un nivel de madurez promedio de 4.05 comparado al nivel 1 (Nivel de Base) y el nivel 5 (Mejores prácticas), por lo cual se observa que las organizaciones posee un nivel de madurez por encima del nivel 3, niveles significativos para este estudio (Tabla I).
Tabla I. Resultados de Medición de la Madurez
C. Comparar la madurez de gestión de la calidad de los laboratorios clínicos privados certificados y los laboratorios clínicos privados no certificados.
En la Tabla II, que se muestra a continuación se presentan los resultados obtenidos del diagnóstico de cada uno de los elementos detallados de un modelo de Sistema de Gestión de la Calidad presentes en los laboratorios objeto de estudio.
Tabla II. Comparación de Resultados Niveles de Madurez
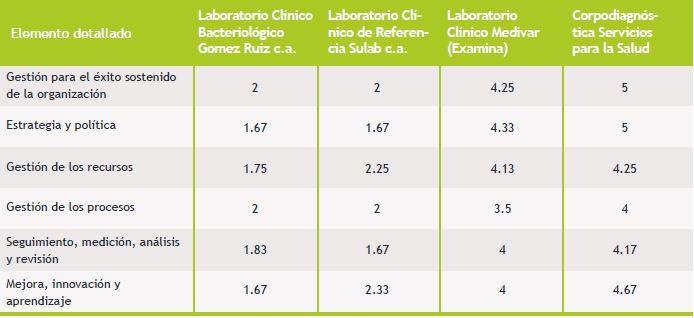
Una vez analizados los resultados, se puede evidenciar que los laboratorios clínicos privados que mantienen un sistema de gestión de la calidad y a su vez están certificados reportan niveles altos de madurez en su gestión en comparación con los laboratorios clínicos privados que a pesar de disponer de una visión, misión, estructura organizativa que sirven como base para el establecimiento de un sistema de gestión de la calidad, no logran superar un nivel promedio de la medición de la madurez de su gestión.
Imagen 1
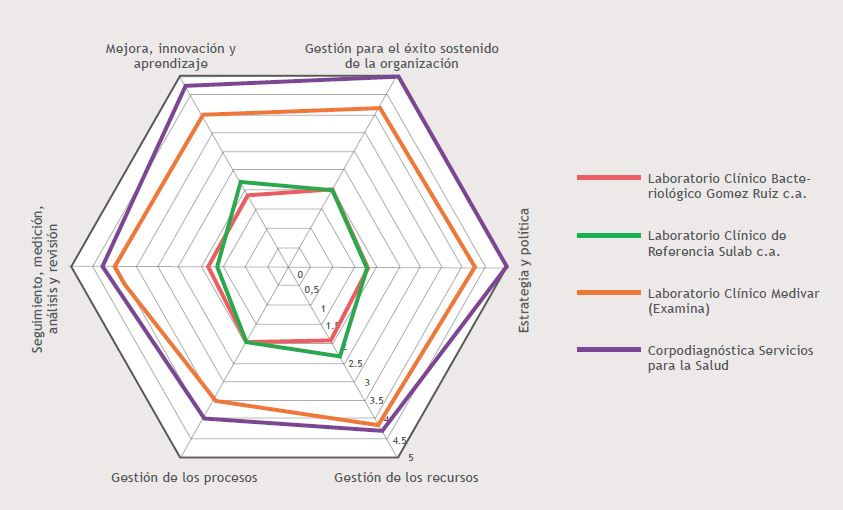
Sin embargo, a pesar de que los laboratorios clínicos realizan actividades y gestiones similares, es de vital importancia para mantener un sistema de gestión de la calidad el desarrollo de la documentación, controles y estándares de procesos adecuados y oportunos que permitan direccionar y evaluar el desempeño y éxito sostenido de la organización.
La variación entre los valores del diagnóstico obtenido de los laboratorios clínicos privados con sistemas de gestión de la calidad y certificación se ve afectada por variables como el tiempo de vida del sistema de gestión de la calidad que este a su vez influye en la cultura organizacional, por ejemplo Corpodiagnostica Servicios para la Salud, mantiene un sistema de gestión de la calidad desde hace 8 años y busca innovar para que el personal de la organización siempre se sienta involucrado con el SGC a diferencia del Laboratorio Medivar (Examina) que solo tiene 5 años manteniendo un sistema de gestión de la calidad y que igualmente apunta a que el personal se direccione hacia la mejora continua de la organización. Es importante señalar que ambas organizaciones han logrado recertificaciones lo que refleja el crecimiento, mejora y éxito sostenido de la gestión de los laboratorios.
Por otra parte, los laboratorios clínicos privados que no poseen un sistema de gestión de la calidad ni una certificación, mantienen valores similares bajos en cuanto a la medición de la madurez de su gestión, a pesar de no disponer de una estructura de documentos ni registros básicos para un sistema de gestión de la calidad, son laboratorios de amplia trayectoria y de referencia, que con la asesoría necesaria y con un modelo que permita orientar al desarrollo e implementación de un sistema de gestión de la calidad podrían lograr una mejor evaluación y gestión para el crecimiento y prestigio de la organización.
D. Establecer el modelo del sistema de gestión de la calidad para laboratorios clínicos privados de Venezuela.
La base de todo sistema de gestión de la calidad es la Norma Internacional ISO 9001:2008, es por ello que en la tabla III a continuación se muestra como relacionar los requisitos que exige la dicha norma con los requisitos específicos de laboratorios clínicos expresados en la Norma Internacional ISO 15189:2012 y a su vez la evidencia para demostrar el cumplimiento de los requisitos exigidos.
Tabla III. Relación de los requisitos de la Norma ISO 9001:2008 con la Norma ISO 15189:2012 y su evidencia
| ISO 9001:2008 | ISO 15189:2012 | Puede ser demostrado: |
|---|---|---|
| 1 Objeto y campo de aplicación | 1 Objeto y campo de aplicación | No aplica |
| 1.1 Generalidades | ||
| 1.2 Aplicación | ||
| 2 Normas para consulta | 2 Normas para consulta | |
| 3 Términos y definiciones | 3 Términos y definiciones | |
| 4 Sistema de gestión de la calidad | 4 Sistema de gestión de la calidad | |
| 4.1 Requisitos generales | 4.1 Requisitos generales | 4.2.2 Requisitos de la documentación 5.5.3 Documentación de los procedimientos analíticos |
| 4.2 Requisitos de la documentación | 4.2.2 Requisitos de la documentación 5.5.3 Documentación de los procedimientos analíticos | |
| 4.2.1 Generalidades | 4.2.1 Generalidades | |
| 4.2.2 Manual de la calidad | 4.2.2 Manual de la calidad | Manual de la calidad |
| 4.2.3 Control de los documentos | 4.2.3 Control de los documentación | Procedimiento documentado |
| 4.2.4 Control de los registros | 4.13 Control de los riesgos 5.1.9 Registro del personal 5.3.1.7 Registros del equipo 5.3.2.7 Reactivos y materiales fungibles. Registros 5.8.3 Contenido del informe del laboratorio | -Procedimiento documentado -Matriz de registros del SCG -Registros de reactivos y materiales fungibles (ficha de identificación) |
| 5 Responsabilidad de la dirección | 4 Requisitos de la gestión 4.1 Organización y responsabilidad de la dirección 4.1.1 Organización 4.1.2 Responsabilidad de la dirección | -Registro en el ministerio de sanidad, o en el colegio de bioanalistas. – Bioanalistas inscritos y solventes ante el colegio respectivo. |
| 5.1 Compromiso de la dirección | 4.1.2.1 Compromiso de la dirección | Designación del director del laboratorio y director de la calidad |
| 5.2 Enfoque al cliente | 4.1.2.2 Necesidades de los usuarios | Encuestas de satisfacción |
| 5.3 Política de la calidad | 4.1.2.3 Política de la calidad | Política de la calidad |
| 5.4 Planificación | 4.1.2.4 Objetivos y planificación de la calidad | Objetivos de la calidad |
| 5.4.1 Objetivos de la calidad | 4.1.2.4 Objetivos y planificación de la calidad | Objetivos de la calidad |
| 5.4.2 Planificación del sistema de gestión de la calidad | 4.1.2.4 Objetivos y planificación de la calidad | Objetivos de la calidad |
| 5.5 Responsabilidad, autoridad y comunicación | 4.1.2.5 Responsabilidad, autoridad e interrelaciones | Organigrama estructural |
| 5.5.1 Responsabilidad y autoridad | 4.1.2.5 Responsabilidad, autoridad e interrelaciones | Organigrama estructural |
| 5.5.2 Representante de la dirección | 4.1.2.7 Director de la calidad | Funciones y responsabilidades |
| 5.5.3 Comunicación interna | 4.1.2.6 Comunicación | Instrucciones de trabajo |
| 5.6 Revisión por la dirección | 4.15 Revisión por la dirección 4.15.1 Generalidades | -Evaluaciones de encuestas de satisfacción -Informes de auditorías internas -Revisiones periódicas a la política y objetivos de la calidad -Registros del SGC |
| 5.6.2 Información de entrada para la revisión | 4.15.2 Elementos de entrada de la revisión 4.15.3 Actividades de la revisión | |
| 5.6.3 Resultados de la revisión | 4.15.4 Elementos de la salida de la revisión | |
| 6 Gestión de los recursos | 5 Requisitos técnicos 5.3 Equipo de laboratorio, reactivos y materiales fungibles | -Procedimiento documentado -Calificación de instrumentos y equipos – Registro de instrumentos |
| 6.1 Provisión de recursos | ||
| 6.2 Recursos humanos | 5.1 Personal | Procedimiento documentado |
| 6.2.1 Generalidades | 5.1.1 Generalidades5.1.2 Cualificación del personal 5.1.3 Descripción de los puestos de trabajo 5.1.4 Introducción del personal al entorno organizativo | – Organigramas, políticas y descripción de cargos. Registros de calificación del personal -Manual de Inducción |
| 6.2.2 Competencia, formación y toma de conciencia | 5.1.5 Formación 5.1.6 Evaluación de la competencia 5.1.7 Revisiones del desempeño del personal 5.1.8 Educación continua y desarrollo profesional | -Evaluaciones de desempeño -Formularios y registros de las evaluaciones -Registros de formación del personal |
| 6.3 Infraestructura | 5.2 Instalaciones y condiciones ambientales 5.2.1 Generalidades 5.2.2 Instalaciones del laboratorio y oficinas 5.2.3 Instalaciones de almacenamiento 5.2.4 Instalaciones para el personal 5.2.5 Instalaciones para la toma de muestras de los pacientes | -Plan de mantenimiento de las instalaciones -Instrucciones de trabajo -Contratos de servicio técnico -Registros de actividades de mantenimiento -Informes de riesgos en el trabajo -Especificaciones sobre espacio, diseño, instalaciones, servicios, condiciones ambientales y limpieza |
| 6.4 Ambiente de trabajo | 5.2.6 Mantenimiento de la instalación y condiciones ambientales | |
| 7 Realización del producto | ||
| 7.1 Planificación de la realización del producto | 4.4 Contratos de prestación de servicios 4.7 Servicios de asesoramiento | -Procedimiento documentado para establecer y revisar los contratos de prestación de servicios -Registros de revisión y modificación de los contratos -Registros de comunicación de modificación de contrato |
| 7.2 Procesos relacionados con el cliente | ||
| 7.2.1 Determinación de los requisitos relacionados con el producto | 4.4.1 Establecimiento de los contratos de prestación de servicio | |
| 7.2.2 Revisión de los requisitos relacionados con el producto | 4.4.2 Revisión de los contratos | |
| 7.2.3 Comunicación con el cliente | -Instrucciones de trabajo | |
| 7.3 Diseño y desarrollo | Véase también 7.5 | |
| 7.3.1 Planificación del diseño y desarrollo | No aplica | |
| 7.3.2 Elementos de entrada para el diseño y desarrollo | ||
| 7.3.3 Resultados del diseño y desarrollo | ||
| 7.3.4 Revisión del diseño y desarrollo | ||
| 7.3.5 Verificación del diseño y desarrollo | ||
| 7.3.6 Validación del diseño y desarrollo | ||
| 7.3.7 Control de los cambios del diseño y desarrollo | ||
| 7.4 Compras | 4.6 Servicios externos y suministros | Procedimiento documentado |
| 7.4.1 Proceso de compras | 4.5 Análisis efectuados por laboratorios subcontratistas 4.5.1 Selección y evaluación de laboratorios consultores subcontratistas 4.5.2 Provisión de los resultados del análisis | -Procedimiento documentado -Acuerdos de servicios -Registro de revisiones de acuerdos -Identificación de los análisis por subcontratista |
| 7.4.2 Información de las compras | 5.3 Equipo de laboratorio, reactivos y materiales fungibles 5.3.1 Equipo 5.3.1.1 Generalidades 5.3.1.2 Reactivos y materiales fungibles 5.3.2.1 Generalidades 5.3.2.2 Reactivos y materiales fungibles. Recepción y almacenamiento | -Procedimiento documentado para la selección, compra y gestión de equipos -Procedimiento documentado para la recepción, almacenamiento y gestión de inventario -Especificaciones del fabricante |
| 7.4.3 Verificación de los productos comprados | 5.3.1.2 Ensayos de aceptación del equipo 5.3.2.3 Reactivos y materiales fungibles. Ensayos de aceptación | -Identificación de los equipos y reactivos -Instrucciones de uso de equipos y reactivos -Calibración de los equipos |
| 7.5 Producción y prestación del servicio | 5.4 Procesos preanalíticos 5.5 Procesos analíticos 5.7 Procesos posanalíticos 5.8 Notificación de los resultados 5.9 Comunicación de los resultados | -Procedimientos documentados -Solicitud de exámenes -Instrucciones para la preparación del paciente -Instrucciones de toma de muestra -Trazabilidad y transporte de las muestras -Aceptación y rechazo de muestra -Validación y verificación de ensayos -Intervalos de referencia -Documentación y revisión de los procedimientos de análisis -Revisión de resultados -Almacenamiento de muestras -Informe de resultados |
| 7.5.1 Control de la producción y de la prestación del servicio | ||
| 7.5.2 Validación de los procesos de la producción y de la prestación del servicio | 5.5.1 Selección, verificación y validación de los procedimientos analíticos5.5.1.2 Verificación de los procedimientos analíticos 5.5.1.3 Validación de los procedimientos analíticos 5.5.1.4 Incertidumbre de medida de los valores de la magnitud medidos | -Validación y verificación de los ensayos – Documentación y revisión de los procedimientos de análisis- Cálculo de la incertidumbre e intervalos de referencia |
| 7.5.3 Identificación y trazabilidad | 5.4.6 Recepción de la muestra | -Identificación de las muestras |
| 7.5.4 Propiedad del cliente | 5.7.2 Almacenamiento, retención y desecho de las muestras clínicas | Procedimiento documentado |
| 7.5.5 Preservación del producto | 5.10 Gestión de la información del laboratorio | Procedimiento documentado |
| 7.6 Control de los equipos de seguimiento y de medición | 5.3.1.3 Instrucciones de uso del equipo 5.3.1.4 Calibración del equipo y trazabilidad metrológica 5.3.1.5 Mantenimiento y reparación del equipo 5.3.1.6 Notificación de los incidentes adversos del equipo 5.3.2.5 Reactivos y materiales fungibles. Instrucciones de uso 5.3.2.6 Reactivos y materiales fungibles. Notificaciones de los incidentes adversos | -Identificación de los equipos y reactivos -Instrucciones de uso de equipos y reactivos -Calibración de los equipos -Plan de mantenimiento de equipos -Recomendaciones del fabricante |
| 8 Medición, análisis y mejora | 4.14 Evaluación y auditorias | -Ejecución de auditorias |
| 8.1 Generalidades | 4.14.1 Generalidades | |
| 8.2 Seguimiento y medición | ||
| 8.2.1 Satisfacción del cliente | 4.8 Resolución de las reclamaciones 4.14.3 Evaluación de la respuesta del usuario 4.14.4 Recomendaciones del personal | -Procedimiento documentado -Encuestas de satisfacción -Registros de recomendaciones |
| 8.2.2 Auditoría interna | 4.15.5 Auditoría interna | -Procedimiento documentado -Registros de auditorias -Formularios para auditorias |
| 8.2.3 Seguimiento y medición de los procesos | 4.14.2 Revisión periódica de las peticiones, y adecuación de los procedimientos y requisitos de la muestra4.14.6 Gestión del riesgo 4.14.7 Indicadores de la calidad 4.14.8 Revisiones por organizaciones externas 5.6 Aseguramiento de la calidad de los resultados del análisis | -Indicadores de gestión la calidad -Informes de resultados de gestión -Evaluaciones de la calidad-Resultados y registros de inspecciones |
| 8.2.4 Seguimiento y medición del producto | ||
| 8.3 Control del producto no conforme | 4.9 Identificación y control de las no conformidades 5.9.2 Selección y notificación automatizadas de los resultados | -Procedimiento documentado para gestión de las nos conformidades -Niveles de autoridad para gestión de no conformidades -Registros de las acciones tomadas -Procedimiento documentado para selección y notificación automatizada de los resultados del análisis -Instrucciones de sistemas de alertas de resultados |
| 8.4 Análisis de datos | ||
| 8.5 Mejora | -Informes de gestión de la calidad -Informes de auditorias -Análisis DOFA -Evaluaciones internas y externas -Revisiones por la dirección -Acciones correctivas -Acciones preventivas -Planes de acción | |
| 8.5.1 Mejora continua | 4.12 Mejora continua | |
| 8.5.2 Acción correctiva | 4.10 Acciones correctivas | -Procedimiento documentado -Registros de acciones correctivas tomadas |
| 8.5.3 Acción preventiva | 4.11 Acciones preventivas | -Procedimiento documentado -Registros de acciones preventivas tomadas |
Referencias Bibliográficas
[1] Arias, F. (2006). El proyecto de investigación. Introducción a la metodología científica. (5ª ed.) Caracas.
[2] Bautista (2012). Implantación de un sistema de calidad basado en la norma UNE-EN-ISO 15189 en el servicio de microbiología del Hospital Universitario Virgen de las Nieves de Granada. (Trabajo de Grado no publicado). Universidad de Granada. Granada. España.
[3] Feigenbaum, A. (1997). Control Total de la Calidad. Editorial CECSA, México.
[4] Gimeno, C. (2003). Sistemas de Gestión de la Calidad de los Laboratorios Clínicos: certificación y acreditación. Barcelona – España.
[5] Gómez, M. (2011). Metodología para la Implementación de un Sistema De Gestión de la Calidad en los entes de la Administración Pública Nacional. (Trabajo de Grado no publicado). Universidad Católica Andrés Bello. Caracas. Venezuela.
[6] Izquierdo, S. (2007). Desarrollo e Implementación de un Sistema de Gestión de la Calidad en un laboratorio de referencia Unidad de Metales, Acreditación según la UNE-EN-ISO1518. (Trabajo de Grado no publicado). Universidad de Zaragoza. Zaragoza. España.
[7] Norma Internacional ISO 9000: 2005: Sistemas de Gestión de la Calidad. Fundamentos y vocabulario. International Organization for Standardization, Ginebra.
[8] Norma Internacional ISO 9001: 2008: Sistemas de Gestión de la Calidad – Requisitos. International Organization for Standardization, Ginebra.
[9] Norma Internacional ISO 9004: 2009: Gestión para el éxito sostenido de una organización – Enfoque de gestión de la calidad. International Organization for Standardization, Ginebra.
[10] Norma Internacional ISO 15189: 2012. Laboratorios de análisis clínicos. Requisitos particulares para la calidad y la competencia. International Organization for Standardization, Ginebra.
[11] Rojo, M. (2010). Recomendaciones para la implementación de la normativa de calidad ISO 15189 en el laboratorio de microbiología clínica; bacteriología y serología. Madrid, España.
[12] Sabino, C. (2000). El Proceso de Investigación. Caracas.










