
Restricción de Crecimiento Intrauterino
Juan Andrés Pérez Wulff (a), Daniel Márquez Contreras(b), Hernán Muñoz(c), Alcibíades Solís Delgado(d), Lucas Otaño(e), Victor José Ayala Hung(f)
a: Hospital Universitario de Caracas, UCV, Caracas, Venezuela, japerezwulff@hotmail.com
b: Hospital Universitario de Caracas, UCV, Caracas, Venezuela, danielmarquez33@hotmail.com
c: Clínica las Condes, Santiago de Chile, Chile, obgynucg@ctcinternet.cl
d: Complejo Hospitalario Dr. Arnulfo Arias Madrid, Caja de Seguro Social, Panamá, alsolis76@gmail.com
e: Hospital Italiano de Buenos Aires, Buenos Aires, Argentina, lucasotano@hospitalitaliano.org.ar
f: Hospital Militar “Dr. Carlos Arvelo”, Caracas Venezuela, vj_ayala@hotmail.com.
Guía clínica de la Federación Latino Americana de Sociedades de Ginecología y Obstetricia. FLASOG: 2013
Introducción
La Restricción del Crecimiento Fetal Intrauterino (RCIU) constituye una de las principales complicaciones del embarazo, asociándose con un mayor riesgo de morbimortalidad perinatal, asimismo se asocia a efectos negativos a largo plazo que se extienden hasta la vida adulta (1). En la actualidad existe una clara evidencia de que las alteraciones de la curva de crecimiento en etapas tempranas del desarrollo humano es un factor de riesgo importante para el desarrollo de un grupo de enfermedades crónicas, que incluyen enfermedades cardiovasculares y diabetes (2). Por lo tanto, el feto con restricción de crecimiento representa una enorme carga tanto para el individuo afectado como para la sociedad. Velar por el bienestar fetal y determinar el momento óptimo para el parto del feto con restricción de crecimiento es un objetivo primordial del obstetra. La etiología de la RCIU es variada y envuelve una diversidad de procesos patológicos (3,4,5). Esta patología se considera una condición multifactorial donde están incluidos aspectos fisiopatológicos fetales, placentarios y maternos, entre los que se destacan reducción de nutrientes y disponibilidad de oxígeno, ingestión de drogas, disminución de la masa y flujo placentario, infección congénita y anomalías cromosómicas (6). Muchos aspectos de este complejo problema aún no están claros, una proporción significativa de los fetos con crecimiento restrictivo no son identificados antes de nacer, y la terapéutica preparto eficaz para prevenir o corregir el déficit de crecimiento sigue siendo difícil de alcanzar (1). La identificación temprana de la restricción del crecimiento intrauterino (RCIU) es fundamental en el intento de reducir la mortalidad y la morbilidad asociada a este problema (7).
Definición y Conceptos Actuales
La Restricción de Crecimiento Intrauterino se ha definido como la incapacidad de lograr un crecimiento intrauterino óptimo dado por su potencial genético. Aunque científicamente correcto, esta definición es difícil de aplicar en la práctica porque el crecimiento óptimo no se puede determinar fácilmente (5).
El Colegio Americano de Obstetras y Ginecólogos ha optado por definir RCIU como »Un feto con un peso estimado por debajo del décimo percentil para la edad gestacional», porque la mortalidad y la morbilidad perinatal aumentan cuando el peso al nacer es inferior a este percentil (8). Sin embargo no todos los fetos con peso inferior al percentil 10 están en riesgo de un resultado adverso, algunos son constitucionalmente pequeños, pero normales (5).
El enfoque adecuado para la definición de compromiso crecimiento fetal debe estar basado en la edad gestacional; la duración del embarazo se ha convertido en un componente integral de la evaluación del crecimiento prenatal y en la actualidad todas las definiciones prevalecientes de compromiso crecimiento fetal son edad gestacional específica (9). Sin embargo, la evaluación de la edad gestacional con precisión puede ser difícil y cualquier error en su cálculo dará lugar a errores de clasificación del infante con importantes implicaciones clínicas (9).
Por último, existe una limitación fundamental en la definición de RCIU por normogramas específicos por edad gestacional; y es que no todos los fetos pequeños tienen restricción de crecimiento, algunos son sólo constitucionalmente pequeños para la edad gestacional (PEG). Por lo tanto, estos enfoques para la definición de compromiso crecimiento no pueden distinguir estas categorías.En muchos casos la RCIU se asocia con alteraciones hemodinámicas que reflejan el estado fetal, la ecografía Doppler fetal puede ayudar a hacer esta distinción además de la historia clínica. Hay pruebas convincentes de ensayos aleatorios de que el Doppler de la arteria umbilical mejora la predicción del resultado perinatal en embarazos complicados con RCIU (14).
Basados en las diferentes recomendaciones internacionales (8,10,11,12,13,14) los fetos que presentan uno o varios de los siguientes parámetros son considerados como casos sospechosos de CFR:
- Crecimiento fetal por debajo del percentil 10 para la edad gestacional con signos de compromiso fetal que incluyen anormalidades de la circulación feto placentaria identificadas por Doppler, disminución del líquido amniótico o alteraciones en las pruebas de bienestar fetal (Perfil biofísico fetal, monitoreo no estresante – NST).
- El feto con un peso inferior al percentil 3 para la edad gestacional calculado por ecografía.
- Feto con circunferencia abdominal por debajo del percentil 2,5 para la edad gestacional sin alteraciones de otros parámetros biométricos.
Un feto pequeño para la edad gestacional es aquel cuyo peso fetal está entre el percentil 3 y 10, muestra una valoración anatómica por ultrasonido normal, presenta pruebas de bienestar fetal normales y al realizar una valoración prospectiva persiste en similares percentiles de crecimiento.
Clasificación
La RCIU ha sido clasificada conforme a la proporcionalidad del cuerpo, la gravedad del compromiso de crecimiento y su tiempo de aparición. De acuerdo con la concordancia del crecimiento de la cabeza y el abdomen, medido por ultrasonido, la RCIU ha sido clasificada como simétrica o asimétrica. La relevancia clínica de este concepto es controversial. La RCIU simétrico fue considerada inicialmente como menos frecuente, y se encontró asociado con etiologías tales como aneuploidía, infección fetal, e insuficiencia útero-placentaria de inicio temprano; conllevando peores pronósticos para el bebé. Sin embargo, investigaciones recientes refutan esto. Un estudio demostró un aumento significativo de la morbilidad neonatal en infantes con RCIU asimétricos sin malformaciones (9,15-18).
Uno de los mayores estudios con 1364 niños con RCIU ha proporcionado pruebas convincentes de que la restricción del crecimiento simétrica es mucho más frecuente y se asocia con un pronóstico mucho mejor que la restricción del crecimiento asimétrico (15-18).
Parece que muchos de los grupos simétricos eran en realidad lactantes constitucionalmente pequeños para la edad gestacional (PEG). En la actualidad, la simetría o asimetría de crecimiento fetal tiene poca relevancia para el manejo clínico de los fetos con CFR.
La RCIU también se clasifica de acuerdo a su severidad y el momento de su aparición clínica. La RCIU severo se define como el peso al nacer o el peso fetal estimado por ecografía por debajo del percentil tercero para la edad gestacional. Esta categorización conlleva peor pronóstico con una mortalidad y morbilidad perinatal sustancialmente mayor. La RCIU temprano se define como el crecimiento compromiso clínicamente reconocible antes de la semana 28 de gestación (15-18) y el RCIU tardío es aquel que aparece después de estas semanas de gestación (19).
Etiología
Las causas de RCIU las podemos agrupar de acuerdo al mecanismo de daño en: hipóxicas, malformaciones, infecciones, y eventualmente a una variante normal del crecimiento fetal, es decir fetos que cumpliendo a cabalidad su potencial genético de crecimiento se encuentran bajo el percentil 10 (20). Las condiciones asociadas o que representan un incremento en el riesgo de presentar RCIU se encuentran en la Tabla 1 (20-21).

Fisiopatología
Los mecanismos por el cual un feto compromete su crecimiento dependerán del mecanismo de daño, que pueden ser malformaciones, infecciones e hipoxia. En un 70 a 80% de los casos la causa es hipoxia, en la que describiremos los mecanismos involucrados así como los mecanismos fetales de adaptación fetal a la hipoxia y su relación con la clínica así como con los exámenes de bienestar fetal (21).
Malformaciones: En presencia de malformaciones el mecanismo generalmente involucra una disminución de la hiperplasia e hipertrofia celular por alteraciones cromosomitas y/o génicas causales del Síndrome Malformativo. En algunos casos estas alteraciones involucran a la placenta y se puede asociar una hipoxia crónica.
Infecciones: En los casos de infecciones también existirá una alteración de la hiperplasia e hipertrofia celular, causado por la citólisis e inflamación que serán variables de acuerdo al agente etiológico, ya sea, bacteria virus o parásito. La hipoxia crónica asociada a daño placentario o anemia por infección también puede ocurrir.
Hipoxia crónica: Si bien la disminución de la presión parcial de oxigeno puede ocurrir por múltiples causas, que pueden ser altura, enfermedades respiratorias, alteraciones cuantitativas o cualitativas de la hemoglobina, hasta daños vasculares en enfermedades crónicas, la más frecuente es una alteración de la placentación.
Alteración de la placentación: La placentación normal comprende dos etapas, antes de las 12 semanas la proliferación del trofoblasto está regulada por las concentraciones de oxígeno, lo que involucra niveles elevados de Factor inducido por hipoxia (HIF 1-alfa, el que disminuye luego de las 12 semanas por el aumento de oxígeno secundario a la apertura de las arterias espirales). Desde ese momento las células del trofoblasto cambian su fenotipo e invaden las arteriales espirales, donde eliminan la capa muscular y elástica y aumentan su diámetro cerca de 4 veces. Esto permite que el árbol vascular placentario sea refractario a agentes vasoativos y aumente el flujo de 70 a 700 mL/ min. (22).
Debido a factores no del todo conocidos, entre los que se encuentran los genéticos, inmunológicos, ambientales, así como factores predisponentes de la madre como obesidad, síndrome metabólico, hipertensión crónica y trombofilias, entre otras, se produce un aumento de HIF después de las 12 semanas, y también el déficit de la enzima, catecol orto metil transferasa (COMT), los que induce un aumento de factores anti-angiogénicos como el receptor soluble simil de la tirosina 1 (sFlt-1), disminución de factores angiogénicos, como el factor de crecimiento placentario (PGF), y también del factor de crecimiento transformante (TGF). Esto sumado a un incremento de la apoptosis placentaria, disminución de óxido nítrico, y a fenómenos de stress oxidativo, producen una falta de remodelación placentaria, placenta de menor tamaño con flujo inter-velloso disminuido e hipoxia. Esta hipoxia placentaria puede producir RCIU, o predominar los fenómenos inflamatorios y producir parto prematuro, o en algunos casos ya sea por fenómenos de oxidación-inflamación, aumento de sFlt-1, o deportación de micropartículas, se puede producir una disfunción endotelial sistémica y producir el cuadro clínico de preeclampsia (22).
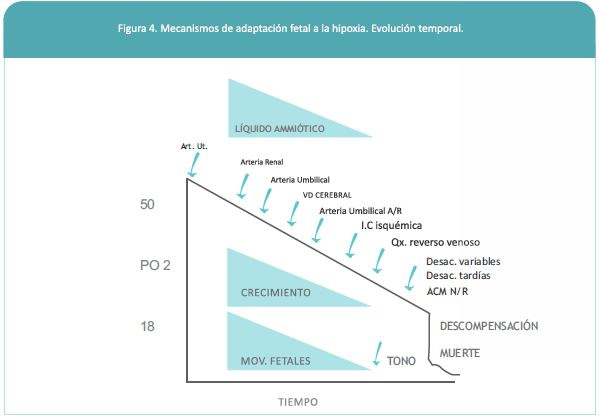
Mecanismos de adaptación fetal a la hipoxia: La disminución del flujo al espacio inter-velloso produce una disminución del aporte de oxígeno al feto. De acuerdo a la severidad de la alteración placentaria y a medida que el feto incrementa el consumo metabólico y de oxígeno, se produce una caída en el aporte de nutrientes y glucosa, así como una disminución de la presión parcial de oxígeno en la sangre fetal. El feto censa los niveles de oxígeno y de glucosa y helicita una serie de respuestas en múltiples sistemas y órganos, conocidos como mecanismos de adaptación fetal a la hipoxia, donde detallaremos los fenómenos metabólicos y cardiovasculares (Figura 1).

La caída en los niveles de glucosa induce glucogenólisis, producción de glucosa a partir de glicógenos, en hígado y secundariamente en músculo estriado, lo que explica la disminución del tamaño del hígado y por ende del perímetro abdominal fetal. Al progresar el déficit de glucosa, se activan mecanismos de gluconeogénesis, síntesis de glucosa a partir de aminoácidos y ácidos grasos desde músculo y tejido graso, lo que sumados a la caída de oxígeno, induce a que la producción de energía se realice mediante vía anaeróbica con aumento del ácido láctico. Las que son responsables de una disminución de la actividad biofísica, reducción del crecimiento y también de la eventual disminución en el metabolismo basal. Clínicamente reconocidos por RCIU, disminución del perímetro abdominal, y también por las alteraciones de las pruebas biofísicas (23) (Figura 2).

La estimulación de los receptores alfa adrenérgicos, presentes en vasos sanguíneos, produce vasoconstricción en múltiples territorios, donde destacamos: arteriola aferente renal, con caída del flujo plasmático renal y de la diuresis fetal, responsable de oligohidramnios; territorio hepático, disminución del tamaño del hígado; la vasoconstricción de las arterias mesentéricas puede producir peritonitis meconial; y en músculo piel y faneras, produce RCIU y disminución de la actividad biofísica fetal (23) (Figura 3).

Los mecanismos moleculares involucrados en la adaptación fetal a la hipoxia están mediados por HIF 1 alfa. Esta molécula dimérica, en normoxia la sub unidad alfa es degradada por el sistema de ubiquitinación, pero en condiciones de hipoxia, no hay degradación, se unen ambas sub unidades, ingresan a la célula, donde inician la traducción de múltiples proteínas responsables de los cambios fisiológicos fetales conocidos como mecanismos de adaptación fetal a la hipoxia (23,24).
Estos mecanismos, en hipoxia crónica, se activan en una secuencia relativamente ordenada, lo que permite desde la perspectiva clínica saber mediante los exámenes de bienestar fetal cuál es la presión parcial de oxígeno del f eto y/o cuánto tiempo tenemos antes de que estos mecanismos sean insuficientes para mantener la homeostasis fetal, y ocurra acidosis, falla de múltiples sistemas y finalmente la muerte del feto (24-26) (Figura 4).
Diagnóstico
Aunque varios métodos se han utilizado para identificar los fetos con CFR (tales como la evaluación de la ganancia de peso materno o mediciones del útero gestante), el ultrasonido es el método más preciso y sensible de la identificación de fetos con RCIU (7).
La importancia de la determinación rutinaria de la edad gestacional (EG) en forma precisa tanto en primero como segundo trimestre temprano, es esencial para la detección precoz de un trastorno del crecimiento fetal, y forma parte de un control prenatal adecuado. Tanto en el cribado como en el diagnóstico de RCIU, se debe ser enfático en la importancia de la edad gestacional exacta.
Ecografía de primer trimestre: La longitud céfalo caudal (LCC) entre las 8 y las 12 semanas de amenorrea es la medida más precisa que define la EG (27). Por este motivo es uno de los principales objetivos en los programas que contemplan la evaluación ecográfica sistemática entre las 11 y 14 semanas (28). Si la diferencia entre lo esperado por anamnesis y lo observado por ecografía de 1er trimestre es mayor a 2 DS (5 días o más) se recomienda realizar la corrección de la edad gestacional (27). La Tabla 2 compara el ultrasonido con otros métodos de cálculo de edad gestacional.

Ecografía de segundo trimestre: En ausencia de ecografía de 1er trimestre, la evaluación entre 16 y 22 semanas permite estimar con adecuada precisión la EG (28).Varias investigaciones han demostrado que el uso de múltiples parámetros fetales ultrasonográficos para calcular la edad gestacional es más preciso que el uso de cualquier parámetro único. Mediante las correspondientes pruebas estadísticos, (Ott et). El uso de múltiples parámetros ultrasonográficos [(BPD + CC + CA + FL) / 4] dio los errores sistemáticos y aleatorios más bajos (7) y son los parámetros sugeridos en el segundo trimestre. Especial consideración se debe tener con el diámetro trans-cerebeloso (28), el cual no se modifica con el CFR.
Fecha de última menstruación (FUM) y ritmo de ciclos menstruales. Es un parámetro confiable si se corresponde con la biometría fetal temprana, sin embargo una proporción significativa de embarazadas no recuerdan la FUM y/o tienen ciclos irregulares, por lo cual este dato frecuentemente resulta insuficiente.
Luego de establecida la edad gestacional se procede a determinar el peso fetal con los parámetros ultrasonográficos (BPD + CC + CA + FL) y se correlacionan estos dos parámetros para determinar en percentil de crecimiento fetal. Es importante resaltar que las variaciones en las determinaciones biométricas en evaluaciones posteriores se convierten en índices de crecimiento fetal y no se debe ser motivo para la modificación de la edad gestacional.
Seguimiento
El seguimiento del feto con RCIU va a depender de la edad gestacional en la cual se establezca el diagnóstico y del grado de afección fetal que se documente por flujometría Doppler.
El manejo de cada feto con RCIU debe ser individualizado y va a depender de la probable etiología del mismo. El ultrasonido detallado debe ser realizado para detectar defectos estructurales fetales; además de la determinación del cariotipo fetal (29), en caso que la restricción sea detectada en etapas tempranas del embarazo (<20 semanas). Otro punto importante a descartar es la presencia de infecciones principalmente tipo virales.Por esto, la realización de pruebas por PCR para detección de infecciones como varicela, rubéola y citomegalovirus debe ser considerada en los casos de CFR precoz.
Una vez descartada la presencia de anomalías estructurales, cromosómicas o infecciosas, se debe brindar un seguimiento seriado que incluya monitorización fetal, vigilancia del índice de líquido amniótico, perfil biofísico fetal y perfil hemodinámico feto-materno (30,31).
Especial atención requiere el RCIU de aparición tardía, en ausencia de alteraciones Doppler, y que es responsable del 50% de muertes fetales espontáneas (19).
La actuación del obstetra para decidir el momento de la terminación de la gestación debe radicar en sopesar entre los riesgos de la prematuridad y los riesgos de dejar el feto en un ambiente hostil, que puede llevar a complicaciones a corto y largo plazo. Se sugiere la hospitalización de la paciente en los casos de trastornos hipertensivos asociados con el embarazo, cambios Doppler sugestivos de asfixia fetal, enfermedades maternas asociadas, dificultad para realizar un adecuado seguimiento ambulatorio o indicación de terminación de la gestación (nivel de evidencia IV, recomendación tipo D). Los criterios para la inducción de la maduración fetal con esteroides no cambian con respecto a las normas generales (24-34 semanas) y se deben utilizar cuando se piensa finalizar la gestación entre los rangos establecidos (nivel de evidencia Ia, recomendación tipo A).
Cuando se decide la interrupción del embarazo por debajo de las 30 semanas de gestación se recomienda la infusión de sulfato de magnesio para disminuir el riesgo de trastornos del movimiento y de parálisis cerebral infantil (32). En casos especiales, cuando el diagnóstico se realiza antes de las 24 semanas, el manejo del mismo es controversial, y se requiere manejo interdisciplinario entre Obstetricia, Neonatología y la familia, para establecer consenso en el manejo. A continuación exponemos los hallazgos hemodinámicos en función de los mecanismos de adaptación fetal a la hipoxia, resaltando nuevamente las pautas básicas del manejo Tabla 3 (33-36).

Despistaje de fetos con RCIU
Actualmente, no existen estrategias o guías universalmente aceptados para el despistaje de RCIU. Los distintos factores que se asocian a RCIU se encuentran comprendidos dentro de las características y antecedentes maternos recolectados en la anamnesis, en el examen físico, y los estudios de laboratorio y de ultrasonido que se realizan durante el seguimiento prenatal. También pueden surgir del despistaje de otras patologías asociadas a RCIU, como el despistaje de aneuploidías, de malformaciones fetales, o de preeclampsia. La identificación de los embarazos con RCIU y su diagnóstico etiológico, es el primer paso para instaurar posibles intervenciones de prevención y para un seguimiento adecuado y finalización oportuna del embarazo.
Componentes del tamizaje de RCIU:
1. Conocimiento preciso de la edad gestacional.
La importancia de la determinación rutinaria de la edad gestacional (EG) en forma precisa tanto en primero como segundo trimestre temprano, es esencial para la detección precoz de un trastorno del crecimiento fetal. El conocimiento preciso de la EG se basa en la anamnesis y la ecografía.
a) Anamnesis: fecha de última menstruación(FUM): una proporción significativa de embarazadas no recuerdan la FUM y/o tienen ciclos irregulares, por lo cual este dato frecuentemente resulta insuficiente. En caso de técnicas de reproducción asistida, recabar información sobre fecha probable de ovulación, fertilización y/o de transferencia embrionaria suele ser muy precisa.
b) Ecografía: Ecografía de primer trimestre: La longitud céfalo – caudal (LCC) entre las 8 y las 12 semanas de amenorrea es la medida más precisa que define la edad gestacional (27). Ecografía de segundo trimestre: en ausencia de ecografía de 1er trimestre, la evaluación entre 16 y 22 semanas permite estimar con adecuada precisión la EG (28). Ecografía de tercer trimestre: generalmente imprecisa, con importante tasa de falsos positivos. Doppler color: En este grupo de pacientes, además de la ecografía, la evaluación con flujometría Doppler de las arterias uterinas ha demostrado ser útil en el despistaje de RCIU de origen placentario (37). El aumento del Índice de Pulsatilidad promedio de las 2 arterias uterinas mayor al percentil 95 en primer trimestre (IP: 2,35) y segundo trimestre (IP: 1,53), se considera un parámetro de aumento de riesgo para RCIU. El Doppler de arterias uterinas presenta una tasa de detección para RCIU temprano del 75% con una tasa de falsos positivos del 5 (38,39,40).
2. Identificación de factores de riesgo.
Existen numerosos factores descritos en asociación con RCIU y su interrelación e identificación temprana de los mismos constituye en la práctica el primer paso del despistaje de RCIU.
a) Características maternas: alrededor de 45% de los factores de riesgo descritos para RCIU corresponden a características maternas descriptas en la Tabla 1.
b) Antecedentes reproductivos: Los resultados perinatales adversos en embarazos previos se asocian frecuentemente con mayor riesgo de RCIU en el embarazo actual:
- Recién nacido previo con RCIU: El antecedente de un RCIU sin diagnóstico etiológico implica una tasa de recurrencia del 20% en el embarazo siguiente (41,42).
- Muerte fetal en embarazo previo: más de la mitad de los fetos muertos sin anomalías visibles se encuentran asociados a RCIU (41,42).
- Antecedente de preeclampsia/eclampsia en embarazo previo: en especial cuadros de preeclampsia severos y lejos del término. Tomando en cuenta solamente las características maternas mencionadas se describe una tasa de detección para RCIU en población de bajo riesgo del 34% para una tasa de falsos positivos (TFP) del 10%. Sin embargo, no está sugerido para ser usado como estrategia aislada, sino que se aplica en conjunto con datos biofísicos (ecografía y Doppler) y bioquímicos (43).
c) Marcadores Bioquímicos:
1° trimestre: valores bajos de PAPP – A (proteína plasmática A) y beta-hCG (gonadotrofina coriónica humana) se asocian a mayor riesgo de patologías por placentación anormal: RCIU y preeclampsia.
2° trimestre: valores altos de alfa-fetoproteína (AFP), beta-hCG, Inhibina A se asocian también con preeclampsia y RCIU.
Modelos que combinan marcadores bioquímicos en primer trimestre (PAPP-A, bfeta-hCG, PlGF, ADAM12 y PPT13) con características maternas, ecográficas y tensión arterial media describen una tasa de detección de RCIU 73% con una tasa de falsos positivos del 10% (44).
Prevención y Tratamiento
Cualquier medida preventiva en medicina pretende evitar que un determinado proceso patológico se inicie (prevención primaria) o bien, revertir, contrarrestar o enlentecer los mecanismos fisiopatológicos responsables antes de que la enfermedad sea clínicamente aparente (prevención secundaria). Así, a importancia de la detección prenatal temprana de los fetos con alteraciones del crecimiento radica en que el déficit de control contribuye a un empeoramiento en los resultados perinatales (12,25). El manejo antenatal subóptimo de estos fetos se ha demostrado como el factor más frecuentemente identificado en los casos de muerte perinatal considerada evitable (25).
Finalmente, la heterogeneidad etiopatogénica de esta entidad dificulta elaborar hipótesis que permitan obtener medidas preventivas y/o terapéuticas diseñadas según la posible etiología
Prevención Primaria
La prevención primaria pretende evitar el desarrollo de una enfermedad, de manera que tan solo es posible si se conocen las causas de la misma. En este orden de ideas, existen numerosos factores de riesgo que pueden contribuir al desarrollo de RCIU, sobre los que teóricamente podría ser posible alguna intervención previa para disminuir el riesgo.
Aunque para algunos autores el control prenatal es cuestionable en cuanto a la prevención de la RCIU, la modificación del estilo de vida, la disminución de las carencias nutricionales y el abandono del consumo de tabaco, alcohol y drogas psicotrópicas son medidas generales que pueden impactar en el peso fetal (12,25) (niveles de evidencia II y III, recomendaciones tipo C y D).
Una de las recomendaciones de esta guía es que, en lo posible, toda mujer que aspire a quedar embarazada (particularmente si presenta antecedentes de RCIU severa lejos del término, preeclampsia, cardiopatías, enfermedades renales, colagenopatías o trombofilias) debería ser valorada preconcepcionalmente por un obstetra especialista en medicina materno-fetal (perinatología) o en su defecto por un obstetra con experiencia en alto riesgo obstétrico (nivel de evidencia IV, recomendación tipo D). Aunque no se ha demostrado clínicamente con respecto a la prevención de la RCIU (44) es prioritario en el control prenatal de todas las mujeres en embarazo la educación sobre conductas saludables, tales como la nutrición, la prevención de ITS y el evitar la exposición a agentes medio ambientales potencialmente nocivos para el embarazo y el feto (nivel de evidencia IV, recomendación tipo D) (46).
Si bien, existen numerosos factores de riesgo que pueden contribuir al desarrollo de esta condición, algunos de ellos merecen ser desglosados más a detalle, pues la prevención primaria sería planteable a varios niveles. En la Tabla 1 destacamos los factores de riesgo clásicamente descriptos, algunos de ellos susceptibles de manejo preventivo, con sus respectivos niveles de evidencia.
Tabaquismo: El consumo de tabaco se ha asociado a un incremento del 35% del riesgo de padecer CFR. Incluso, algunas series publican una reducción del riesgo relativo (LR- de 2,6) para aquellas mujeres que suspendieron el hábito previo al inicio de la gestación. Así, una medida posible en la prevención primaria es la recomendación preconcepcional del cese del hábito tabáquico (47,48).
Obesidad: El IMC previo a la gestación mayor de 29 aumenta 4 veces el riesgo de padecer la enfermedad. La obesidad está directamente relacionada con la resistencia insulínica y la DM. Se estima el ajuste del IMC materno como medida preventiva primaria favorable a considerar en la consulta pre-embarazo (49).
Diabetes: Se estima que el riesgo de preeclampsia y CFR en mujeres con diabetes pre-gestacional está alrededor de 20% y en las diabéticas gestacionales del 9%. El riesgo está directamente relacionado a los efectos tóxicos de la hiperglicemia prolongada sobre el endotelio de la microvasculatura placentaria (50). Por tanto, se estima que un buen control metabólico preconcepcionales recomendable como medida preventiva (51).
Trombofilias maternas: Las trombofilias maternas congénitas o adquiridas tienen mayor riesgo de desarrollar preeclampsia y RCIU. Se estima que la trombosis placentaria constituye la piedra etiológica angular de esta condición (52). Varios estudios destacan que cerca del 40% de las pacientes con PE grave o CFR asimétrico severo presentan algún tipo de trombofilia. Estudios no randomizados sugieren que la profilaxis con heparina de bajo peso molecular (HBPM) estaría justificado en estas pacientes (nivel de evidencia III, recomendación tipo C). No está justificado el cribado de trombofilias a la población obstétrica de bajo riesgo, sin embargo es recomendable ante el antecedente de preeclampsia y/o CFR de instauración precoz en alguna gestación previa (53).
Prevención Secundaria del RCIU
Detección precoz y tratamiento temprano: Para que cualquier medida encaminada a la prevención secundaria de una enfermedad sea eficaz es importante que se dispongan de métodos para la detección precoz de las pacientes de riesgo. La prueba de despistaje debe de ser fácil de realizar, accesible a toda la población, no invasivo y con capacidad de detectar a las pacientes de riesgo con la suficiente antelación como para tener la posibilidad de aplicar un tratamiento preventivo. No existe en la actualidad una prueba diagnóstica que cumpla estas expectativas, sin embargo la prueba que hasta el momento parece ser el que se acerca a estas premisas es la realización del Doppler de las arterias uterinas durante el primer y segundo trimestre de la gestación.
En pacientes con factores de riesgo establecido, principalmente con antecedentes de preeclampsia grave lejos del término, CFR severo, trombofilias y enfermedades del colágeno, se ha demostrado que la utilización de ácido acetilsalicílico (ASA, por sus siglas en inglés) 81-100 mg día permite mejorar el resultado perinatal y disminuir las tasas de preeclampsia, aunque no se ha demostrado que reduzca de manera significativa la incidencia de bajo peso al nacer (54,10) (nivel de evidencia Ib, recomendación tipo A).
En estas pacientes de alto riesgo, la utilización del Doppler de arterias uterinas en la semana 11-14 y/o en la semana 20-24 de gestación, permite identificar el subgrupo de pacientes que van a desarrollar un crecimiento fetal restringido más severo y precoz y/o preeclampsia, principalmente grave y lejos del término. Es una recomendación de este consenso que en pacientes con factores de riesgo se evalúen las arterias uterinas mediante estudio Doppler, con tamizaje temprano de las mismas durante la ventana de 11 a 13 semanas + 6 días y seguimiento a las 20-24 semanas (40). Una vez detectada la alteración de las arterias uterinas, la utilización de ASA a baja dosis, iniciando en la semana 11-14 parece disminuir la frecuencia de bajo peso y preeclampsia, efecto que no se ha demostrado en pacientes en quienes se detecta la alteración en las arterias uterinas en la semana 20- 24 y se administra el mismo medicamento (55,56,57) (nivel de evidencia II, recomendación tipo B).
La combinación del Doppler de las arterias uterinas con los factores de riesgo maternos parece que aumenta de forma importante la sensibilidad y la especificidad del test (12,10), es por el momento el test de elección en caso de que se planteen en el futuro estrategias preventivas en la población general.
Finalmente y de forma más reciente, la combinación de marcadores bioquímicos (proteína plasmática A asociada al embarazo [PAPP-A], gonadotropina coriónica humana fracción Beta [BHCG libre], factor de crecimiento placentario, entre otros) (58,59) con factores de riesgo y el Doppler de las arterias uterinas en el primer trimestre como predictor de preeclampsia y RCIU, han recibido una considerable atención, con una buena cantidad de artículos publicados que sugieren la incorporación de pruebas combinadas (anamnesis – antecedentes – Doppler de uterinas – marcadores bioquímicos) como estrategias de evaluación susceptibles de incorporar a la práctica diaria (44,60).
Prevención Terciaria del RCIU
Una vez establecido el diagnóstico de la RCIU, se debería efectuar una valoración integral en un tercer nivel de atención que cuente con personal obstétrico entrenado, especialistas en medicina materno-fetal y neonatal habituado en el manejo del crecimiento fetal restringido. Se debe realizar una correcta clasificación, búsqueda de las enfermedades maternas o fetales subyacentes y hacer las pruebas de bienestar fetal adecuadas para definir el diagnóstico y el momento óptimo para la finalización de la gestación. Esta conducta es la única que ha demostrado incidir sobre la mortalidad perinatal y la morbilidad a largo plazo (10,60) (nivel de evidencia II, recomendación tipo B).
En la literatura mundial, existen investigaciones y estudios aleatorizados publicados, que evalúan el aporte suplementario de oligoelementos, como zinc o magnesio, aceites de pescado con lípidos supuestamente beneficioso al ser difícilmente oxidables. Ninguno de estos estudios ha podido demostrar diferencias razonables como para justificar la administración rutinaria y a la población general de suplementos para prevenir la RCIU. En nuestra opinión, la patogénesis de esta entidad constituye una condición multifactorial, pero parece evidente que diferentes factores de riesgo a varios niveles interactúan en el desarrollo de la enfermedad, y esta interacción es probablemente variable en diferentes pacientes. Si se consiguen caracterizar déficit concretos asociados a un aumento del riesgo de la enfermedad, la utilización de políticas para corregir estos déficit parece tener sentido, pero la utilización indiscriminada de sustancias en poblaciones con niveles adecuados de las mismas tendrá seguramente pocas probabilidades de tener éxito.
En la tabla 3 se resumen las medidas preventivas evaluadas. Expondremos los datos más relevantes en relación a las estrategias terapéuticas y preventivas de uso más común en nuestro medio.
Aspirina (Ácido Acetil Salicílico): uno de los mecanismos fisiopatológicos propuestos en la génesis de la preeclampsia y la restricción del crecimiento fetal es el desequilibrio entre la producción de prostaciclina y tromboxano A2 (TXA2), de tal manera que existe un relativo aumento del tromboxano producido por las plaquetas, que explicaría la vasoconstricción característica de la fase clínica de la enfermedad. El ácido acetil salicílico (ASA por sus siglas en inglés) inhibe la enzima que da lugar al TX-A2 en las plaquetas y en el endotelio (ciclo-oxigenasa), y por tanto, disminuye la síntesis de TX. Así pues el tratamiento con ASA podría evitar la vasoconstricción y l a hipercoagulabilidad características de la enfermedad. Esta hipótesis es la que ha llevado a pensar que la aspirina a baja dosis podría prevenir o retrasar el desarrollo de la enfermedad (61). Hasta el momento, los resultados de la mayoría de los estudios randomizados muestran un efecto beneficioso del ASA en la prevención de la preeclampsia y el CFR en población de riesgo, definida por aquellas pacientes con antecedentes de trastornos de mal adaptación vascular en embarazos anteriores o que al realizar el estudio Doppler de arterias uterinas cursen con IP superior al P95 para la edad gestacional.
Así pues, el tratamiento con ASA a bajas dosis hoy en día muestra una eficacia clara en la prevención de la preeclampsia y CFR de etiología vascular en las pacientes de alto riesgo (nivel de evidencia Ib, recomendación tipo A). Su uso en la población de bajo riesgo no está justificado. En todo caso su uso estaría limitado a la población alto riesgo, a dosis de 81 a 100 mg al día y su inicio antes de las 20 semanas de gestación. Hasta que no se disponga de mayor información no estaría indicado su uso a dosis más alta ni antes de las 11 semanas de gestación (62,63).
Aceite de pescado (Omega 3): el aceite de pescado contiene ácidos grasos de cadena larga poliinsaturados derivados del ácido linoleico (ácido eicosapentaenoico y ácido decosahexaenoico). Estos ácidos grasos originan un cambio en la síntesis de prostanoides que da lugar a la inhibición del tromboxano A2 de las plaquetas, disminuyendo los efectos vasocontrictores y trombóticos y por tanto, corrigiendo el desequilibrio con las prostaciclinas (PGI2) característico de los trastornos de mal adaptación vascular (63,64). Los estudios publicados hasta el momento muestran que los suplementos de aceite de hígado de pescado no son un tratamiento efectivo para la prevención de preeclampsia, pero pudieran generar un efecto benéfico sobre la ganancia ponderal fetal y la prevención de la retinopatía del prematuro, sustentado en el hecho de la alta concentración de Omega 3 presente en las vainas de mielina a nivel del SNC (nivel de evidencia III, recomendación tipo C) (64).
Vitaminas antioxidantes: vitamina E y C: en casos de RCIU, pareciera lógico que la suplementación con antioxidantes podría ser beneficiosa, para disminuir o minimizar el desarrollo de patología vascular mediada por radicales libres en gestantes de riesgo. Así, los antioxidantes han sido propuestos como una terapia potencialmente profiláctica para el desarrollo de PE y CFR. Estudios realizados durante la etapa aguda de la enfermedad no mostraron beneficio (66,67). Chappell y colaboradores (68) en un estudio randomizado con vitamina E 400 UI/ día y vitamina C 1.000 mg/día a partir de las 20-24semanas de gestación en las mujeres con riesgo de PE, demostraron una disminución de la incidencia de la patología del 40%. Sin embargo, Beazley, Sibai y colaboradores no encontraron diferencias significativas entre pacientes de alto riesgo que recibieron el complejo antioxidante y el placebo en el desarrollo de preeclampsia y/o CFR (69). En nuestra población donde los niveles séricos de estas vitaminas están aún por evaluarse, la introducción de este tratamiento preventivo debería ser detalladamente analizada, ya que es posible que los resultados en nuestra casuística no fuesen equiparables.
Aminoácidos: el consumo de etanol, nicotina, morfina y cocaína afecta notablemente el transporte de aminoácidos de la placenta al feto. Una disminución en la transferencia de aminoácidos a través de la placenta, o una dieta baja en proteínas (desnutrición proteico-calórica), puede ser causa de RCIU (69). Por su parte, la L-carnitina es esencial para el transporte de ácidos grasos de cadena larga y de otros ácidos orgánicos a través de la membrana interna de la mitocondria. Se ha determinado una deficiencia de L-carnitina en recién nacidos pretérmino y con diagnóstico prenatal de RCIU (70).
Hasta ahora no se ha demostrado que los suplementos nutricionales sean un tratamiento estándar para la restricción del crecimiento intrauterino; sin embargo, algunos complementos como la Lcarnitina pueden contribuir a mejorar el pronóstico fetal al disminuir la morbilidad neonatal (71). Una combinación de L-carnitina (4 gramos/día) y betametasona en periodo prenatal reduce la incidencia del síndrome de dificultad respiratoria y la mortalidad en recién nacidos prematuros, debido a su efecto sobre los receptores de glucocorticoides que modulan; así, varios estudios reportan la utilidad de la L-carnitina como coadyuvante en el tratamiento del CFR, planteando un efecto doblemente benéfico: sobre la ganancia ponderal fetal y la reducción del riesgo de distress respiratorio del recién nacido (72,73,74) (nivel de evidencia IV, recomendación tipo D).
Seguimiento Postnatal
Se considera indispensable la valoración mediante anatomía patológica de la placenta en los casos de RCIU. (10,75). Con respecto a la madre, la presencia de RCIU severa en forma precoz debe llevar a una valoración materna en el posparto de los posibles factores desencadenantes como son: síndrome de anticuerpos anti-fosfolípidos, enferme dades del colágeno, nefropatías y trombofilias. Esa consejable una visita al especialista en medicina materno-fetal o alto riesgo obstétrico para la adecuada consejería y valoración. En estos casos, se desaconseja la utilización de anticonceptivos orales hasta completar el estudio (nivel de evidencia IV, recomendación tipo D).
Los niños propensos a la RCIU deben ser evaluados durante intervalos regulares, una vez superado el período postnatal, en búsqueda de alteraciones del desarrollo psicomotor. En la vida adulta, se han encontrado alteraciones tales como diabetes, hipertensión y síndrome metabólico; por lo tanto, debería existir una intervención sobre los factores de riesgo cardiovasculares (10,76,77,78) (nivel de evidencia III, recomendación tipo C).
Recomendaciones Finales
- En la actualidad se considera RCIU cuando el crecimiento fetal está por debajo del percentil 10 para la edad gestacional con signos de compromiso fetal que incluyen anormalidades de la circulación feto placentaria identificadas por Doppler, disminución del líquido amniótico o alteraciones en las pruebas de bienestar fetal, sin embargo fetos con un peso inferior al percentil 3 para la edad gestacional, calculado por ecografía o CA < percentil 2,5, sin alteración de pruebas de bienestar fetal, debe ser considerado como RCIU y manejado como tal.
- En el diagnóstico es importante la estimación precisa de la edad gestacional por lo métodos mencionados y el cálculo del peso fetal estimado para determinar el percentil de crecimiento fetal. Las variaciones posteriores en la biometría no implican cambio de la edad gestacional sino una variación del percentil de crecimiento fetal.
- Ultrasonido de tercer trimestre con la finalidad de detectar casos de RCIU tardío, responsables de muertes perinatales espontáneas.
- La realización de un test de despistaje como el Doppler de las arterias uterinas a las 11-14 semanas disminuiría de forma importante la población a tratar; y su reevaluación a las 20 semanas permitiría establecer criterios claros de inclusión a protocolos de seguimiento de pacientes de alto riesgo.
- Todos los datos de los que disponemos hasta el momento para la prevención de los trastornos de mal adaptación vascular materna, cuyo común denominador está representado por la preeclampsia y el CFR, muestran que hay algunas intervenciones terapéuticas que podrían permitir disminuir la incidencia de los mismos, o al menos, retardar su instauración y limitar sus implicaciones postnatales. La cuestión está en definir si estos tratamientos preventivos están justificados en la práctica clínica y en establecer las indicaciones precisas. Cualquier intervención supone un importante número de pacientes a tratar y para que resulte beneficiosa, se debe ante todo valorar la prevalencia de la enfermedad a prevenir.
- En el manejo del CFR mediante un esquema terapéutico combinado, iniciando ASA a baja dosis (81 mg/día) en la población obstétrica de riesgo determinada por un tamiz positivo en el Doppler de arterias uterinas durante la ventana de 11-14 semanas. En aquellas pacientes con diagnóstico de RCIU consideramos el inicio de L-carnitina (4 gr/día) y Omega 3 (2000 mg/día), en combinación, de estar indicada la resolución pretérmino, con la inducción de madurez pulmonar fetal mediante un curso de betametasona (12 mg c/24 horas por 2 dosis), obteniendo hasta ahora resultados positivos en la curva de ganancia ponderal fetal, reducción del distress respiratorio del recién nacido, retinopatía del prematuro y estancia hospitalaria (nivel de evidencia IV, recomendación tipo D).
- El momento óptimo para la finalización de la gestación, es la única conducta que ha demostrado incidir sobre la mortalidad perinatal y la morbilidad a largo plazo.
El presente trabajo es la conclusión del esfuerzo de un grupo de investigadores de diversas nacionalidades, a quiénes nos une el propósito de contribuir con su experiencia a lograr el dominio de la ciencia que nos permita que el hombre mantenga la armonía que Dios nos entregó. Es tarea de todos colaborar con ese propósito común.








