
Método ultrasensible para determinar Proteína C – Reactiva. Inmuno-turbidimetría exaltada por látex
GT Lab ha introducido un método inmunoturbidimétrico con sensibilidad incrementada por partículas de látex que permite la determinación manual o automatizada de la Proteína C-Reactiva (PCR).
La exaltación de la respuesta inducida por partículas de látex permite trabajar con una sensibilidad adecuada para discriminar entre valores bajos de PCR, los que son de interés en procesos ateroscleróticos y vinculados a enfermedad cardíaca, entre otras patologías.
Los reactivos son presentados en forma líquida estables, los que pueden emplearse en analizadores capaces de usar dos reactivos por método o un reactivo único, a elección del laboratorio.
Introducción
La proteína C-reactiva (PCR) es una proteína de la fase aguda producida principalmente en el hígado como respuesta a una infección o agresión al organismo (1).
Recientemente, la PCR medida mediante métodos denominados de alta sensibilidad o ultrasensibles (PCR-US) han emergido como marcadores potenciales de riesgo de enfermedad cardíaca (2).
La Asociación Americana de Cardiología ha propuesto su medición como predictor de enfermedad cardiovascular (3).
La PCR-US ha sido identificada como un marcador sensible y más estable en el tiempo para riesgos vasculares que otros marcadores como el colesterol total y la presión sanguínea sistólica (4). El mismo trabajo demostró otros beneficios de esta determinación, como una gran estabilidad de su concentración en muestras sometidas a repetidos procesos de congelamiento-descongelamiento y menor variabilidad intra-individuo que otros marcadores de riesgo, tales como el colesterol total y la presión arterial.
También el estudio prospectivo de Reykjavik durante 12 años reveló una excelente correlación con otros marcadores de riesgo (5).
El meta-análisis de estudios prospectivos también arrojó resultados al respecto al asociar PCR-US, fibrinógeno, albúmina y recuento de leucocitos con enfermedad cardíaca coronaria (6).
La PCR-US ha sido identificada, además, como vinculada a procesos inflamatorios sistémicos en diversas afecciones tales como diabetes mellitus (7) y asma (8). Este trabajo demostró que un incremento en los niveles de PCR-US puede asociarse con obstrucción del flujo de aire e inflamación de las vías respiratorias, sirviendo como marcador subrogante de inflamación en asma.
Otro trabajo ha demostrado que, tanto en hombres como en mujeres físicamente saludables, desórdenes depresivos asociados con elevaciones de PCR-US se vincularon con isquemias cardíacas fatales y no fatales (9).
También, se ha detectado que niveles de PCRUS correlacionan con el estrechamiento de arteriolas y ensanchamiento de las vénulas retinales, asociadas con enfermedad cardiovascular (10).
Toda esta bibliografía demuestra la creciente importancia de la determinación de PCR por métodos ultrasensibles.
Principio
La proteína C reactiva de la muestra reacciona con anticuerpos anti-PCR-US adheridos a partículas de látex del reactivo, provocando una turbidez proporcional a su concentración, la que puede ser cuantificada fotométricamente. El empleo de partículas de látex incrementa la sensibilidad de la reacción haciendo que pueda tener perfecta discriminación entre valores bajos, donde las variaciones de concentración son marcadores eficientes de las referidas patologías.
Composición de los Reactivos Provistos
R1: buffer tris 20 mmol/L, pH= 8,2.
R2: partículas de látex recubiertas con anticuerpos anti-PCR, pH = 7,3.
Multicalibrador ASO / PCR / FR: la composición varía entre lotes. La concentración de PCR del Multicalibrador está referenciada al HUMAN CREACTIVE PROTEIN, 1st International Standard (Code 85/506).
Preparación de los Reactivos de Trabajo
Homogeinice suavemente R2 y mezcle una parte de dicho reactivo con 4 partes de R1. Las presentaciones di s ponibles permi ten directamente volcar el contenido de un frasco de R2 en uno de R1 sin necesidad de efectuar mediciones de los reactivos.
Conservación y Estabilidad
Kit PCR-US Inmunoquant: Conserve refrigerado (2-8ºC) sin congelar. La estabilidad alcanza la fecha de vencimiento indicada en la caja.
Reactivo de trabajo: 30 días refrigerado (2-8ºC). Muestra Suero fresco. Debe separarse dentro de los 30 minutos de extraída la muestra.
*Aditivos No es necesario el agregado de aditivos.
*Condiciones de conservación de las muestras Refrigerador (2-8ºC): estable 7 días. Congelador (-20ºC): estable 3 meses.
*Sustancias interferentes
Las muestras con restos de fibrina deben centrifugarse antes de ensayar. No emplee muestras groseramente hemolisadas o lipémicas. La bilirrubina (20 mg/dL), hemoglobina (10 g/L) y lípidos (10 g/L) y factor reumatoide (75 UI/mL) no interfieren.
Valores de Referencia
Hasta 3 mg/L Cada laboratorio debe establecer los valores normales correspondientes a la población que atiende.
EVALUACIÓN DE DESEMPEÑO DE PCR-US INMUNOQUANT
*Estudio de comparación Se efectuaron comparaciones de muestras contra reactivos comerciales de igual fundamento técnico y aprobados por ANMAT.
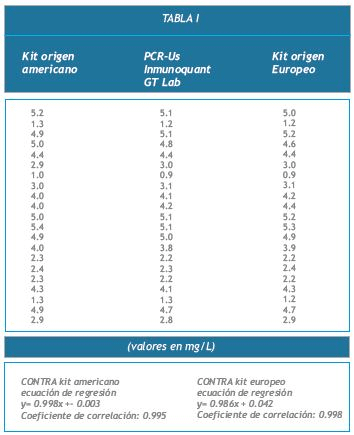
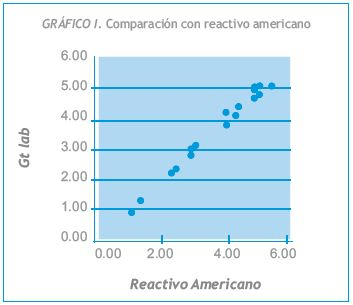
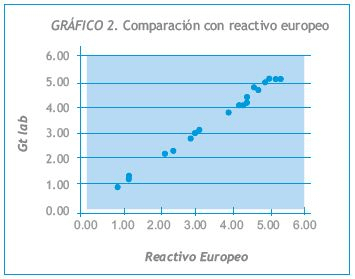
Los resultados obtenidos, expresados en mg/dL, se muestran en la Tabla I y en los Gráficos 1 y 2.
*Estudios de Precisión
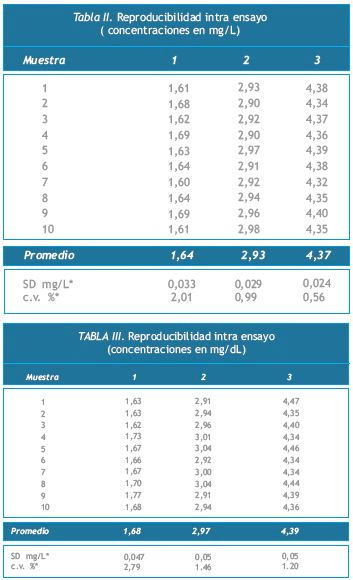
Se procesaron pooles de muestras de personas caucásicas, adultas, sin antecedentes de patologías y sin medicación para el caso del nivel “normal”, y sin otras patologías asociadas. Las muestras se conservaron congeladas a -20ºC durante todo el tiempo entre ensayos. Los resultados se muestran en las Tablas II y III.
EVALUACIÓN DE DESEMPEÑO DE PCR-US INMUNOQUANT
*Estudio de Comparación
Se efectuaron comparaciones de muestras contra reactivos comerciales de igual fundamento técnico y aprobados por ANMAT. Los resultados obtenidos, expresados en mg/dL, se muestran en la Tabla I y en los Gráficos 1 y 2.
*Estudio de Precisión
Se procesaron pooles de muestras de personas caucásicas, adultas, sin antecedentes de patologías y sin medicación para el caso del nivel “normal”, y sin otras patologías asociadas.
Las muestras se conservaron congeladas a -20ºC durante todo el tiempo entre ensayos. Los resultados se muestran en las Tablas II y III.
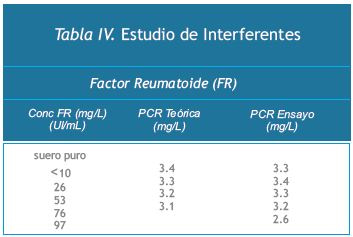
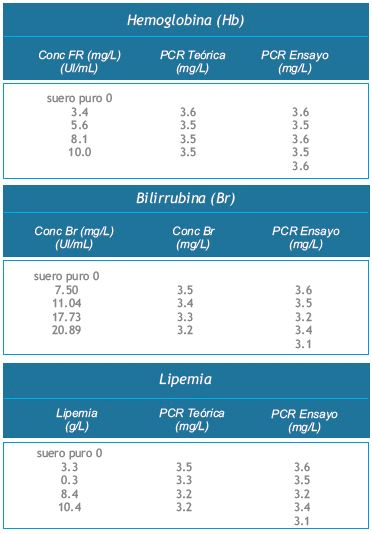
*Estudio de Interferencias
Se estudió la interferencia de componentes de la muestra que pueden presentar efectos indeseables en métodos de laboratorio, tales como la bilirrubina, los lípidos, el factor reumatoide y la hemólisis.
La bilirrubina (hasta 20 mg/dL), la hemoglobina (hasta 10 g/L), los lípidos (hasta 10 g/L) y el factor reumatoide (hasta 75 UI/mL) no mostraron interferir.
Las buenas prácticas de laboratorio recomiendan que las muestras con restos de fibrina deban centrifugarse antes de ensayar, y no emplear muestras groseramente hemolisadas o lipémicas.Los resultados se muestran en la Tabla IV.
Estabilidad de los Reactivos, Calibradores y Controles
La vida útil de los reactivos HbA1c Directo Plus, medida en tiempo real, demostró ser de 18 meses en refrigeración. Del mismo modo, los Calibradores y Controles demostraron una estabilidad de 24 meses refrigerados.
La técnica mostró cumplir con la Ley de Lambert Beer hasta 10 mg/L. Muestras con valores mayores deben reensayarse previa dilución con solución fisiológica. El resultado obtenido debe multiplicarse por la dilución efectuada.
Sensibilidad del Método
El método permite una resolución de 0.5 mg/L.
Estabilidad de Calibración del Instrumento
La estabilidad de la calibración depende del instrumento, ya que es función de sus características específicas.
Por ejemplo, el Beckman Coulter Cx tiene un sistema de medida basado en dos puntos de lectura. Estos sistemas tienen una estabilidad de calibración de 7 a 10 días.
Los analizadores Hitachi, por su parte, toman solamente un punto de lectura al final de la reacción. Esto les da una estabilidad de calibración de 21 a 28 días.
Adaptaciones a Instrumentos Automáticos
Están disponibles adaptaciones para diferentes analizadores automatizados. Consulte al departamento de atención al cliente para mayores datos (infoprofesional@gtlab.com.ar).
REFERENCIAS BIBLIOGRÁFICAS
1- O’Neal DN, Piers LS, Iser DM, Rowley KG, Jenkins AJ, Best JD, et al. – Atherosclerosis: 201:368 –77;2008
2- Verma S, Szmitko P, Ridker P.- Nature: Clin Pract Cardiovasc Med 2:29 –36; 2005
3- Pearson TA, Mensah GA, Alexander RW, Anderson JL, Cannon RO I, Criqui M, et al. Circulation: 107:499 –511; 2003
4- Shemesh T, Rowley KG, Jenkinns AJ et al. Clin Çhem 55:2, 336-341; 2009
5- Rifai N, Tracy RP, Ridker PM. – Clin Chem:45:2136–41;.1999
6- Danesh J, Collins Rory, Appleby P – JAMA: 279/18: 1477- 1482;19987- Tracy RP – Circulation: 97: 2000-2002; 1998
8- Takemura M, Matsumoto H, Niimi A et al. – Eur Respir J.:27(5):908-12; 2006
9- Surtees PG, Weinwright NWJ, boekhold SM et al –Psychosomatic Medicine 70:850-855; 2008
10- Yim-Lui Cheung C – Amer J. of Epidem 17/2: 206-213;2009





