Medición de Beta Crosslaps (B-CTx) por dos métodos automatizados.
Gonzalez D1,2, Jacobsen D1 , Fortuna F1 , Bravo M1 , Jamardo J2 , Gomez B2 , Mesch V1 , Maggi L3 , Maidana P1,3, Fabre B1,2 .
1Departamento de Bioquímica Clínica. Facultad de Farmacia y Bioquímica. Instituto de Fisiopatología y Bioquímica Clínica (INFIBIOC). Universidad de Buenos Aires, Argentina.
2Laboratorio de Endocrinología. Departamento de Bioquímica Clínica. Facultad de Farmacia y Bioquímica. Hospital de Clínicas José de San Martin. Universidad de Buenos Aires, Argentina.
3Laboratorio Centro de Diagnóstico Rossi, Buenos Aires Argentina

Introducción
El hueso es un tejido dinámico que se remodela continuamente a lo largo de la vida. La matriz orgánica del hueso está constituida en más del 90% por el colágeno de tipo I1. La formación y resorción ósea son dos procesos metabólicos altamente acoplados2. Sin embargo, bajo determinadas situaciones se produce un desacople de estos procesos, con predominio de uno sobre otro. Es así que, en la osteoporosis, el hiperparatiroidismo, el hipertiroidismo, el Síndrome de Cushing y la enfermedad de Paget hay un predominio de la resorción sobre la formación ósea3,4. Desde el laboratorio bioquímico contamos con marcadores de formación y resorción que nos permiten evaluar estos procesos. (Tabla 1).

Dentro de los marcadores de formación contamos con: Productos de la neosíntesis del colágeno (propéptidos del colágeno tipo 1, P1NP) y las proteínas relacionadas al osteoblasto (osteocalcina y FAL) y entre los marcadores de resorción se pueden medir desde el laboratorio los productos provenientes de la ruptura del colágeno: como la hidroxiprolina, cross links, telopéptidos y enzimas específicas del osteoclasto: fosfatasa ácido tartrato resistente, catepsina K5 .
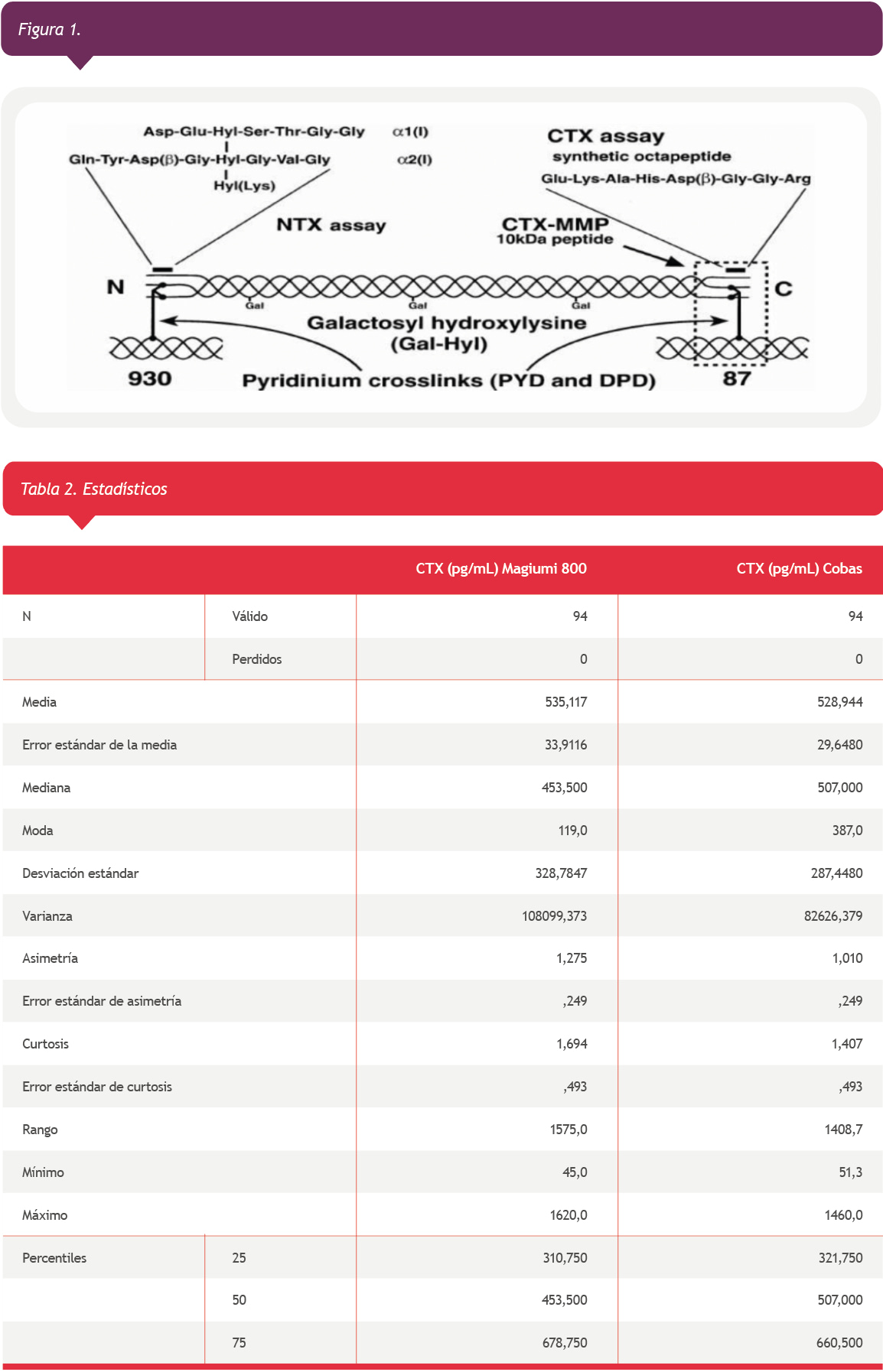
El marcador mas utilizado para la evaluación de la resorción ósea es el C-telopeptido, β cross laps o CTx. Durante la resorción ósea el colageno se degrada y sus fragmentos, incluidos los telopéptidos C-terminales (CTx), son liberados a la circulación y excretados por orina1,6 (Figura 1). Estos fragmentos parecen ser específicos de hueso ya que poseen el tipo de entrecruzamiento del colágeno maduro tipo I de este origen, que no ocurre en el colágeno tipo I de otras fuentes.
La mayoría de los inmunoensayos el anticuerpo está dirigido contra un octapéptido α8AA, que solo se encuentra en el CTx. Este octapeptido se β-isomeriza a octapéptido β-8AA durante la maduración ósea3,4. El octapéptido β-isomerizado se considera el principal producto específico de la degradación del colágeno tipo I1,7. Estos marcadores bioquímicos (formación y resorción) son útiles para el monitoreo de la terapia, predecir el riesgo de fractura y predecir la perdida ósea.
Estos marcadores tienen la ventaja de mostrar cambios a los 3 meses de iniciado un tratamiento con antiresortivos, mientras que para observar cambios con la medida de la DMO es necesario esperar dos años5. Los marcadores disminuyen a los 3 meses, reflejando el éxito de la terapéutica antiresortiva instaurada. Los estudios han demostrado que existe un aumento proporcional en el nivel de β-CTx sérico en personas con resorción ósea fisiológica o patológicamente elevada (p. ej., en la vejez o en la osteoporosis)1,8. Es por ello, que la determinación de β-CTx en suero sería un biomarcador de gran utilidad para controlar la eficacia de la terapia antirresortiva (p. ej., bisfosfonatos o terapia de reemplazo hormonal – TRH) en la osteoporosis u otras enfermedades óseas 9,10 .
Objetivo
Comparar los resultados de ß-CTx séricos medidos por un ensayo electroquimioluminiscente utilizado ampliamente en nuestro país con un nuevo ensayo quimioluminiscente disponible actualmente, en una población de individuos adultos.
Materiales y métodos
Se estudiaron muestras de suero de 94 pacientes con edades entre 29 y 90 años seleccionados al azar que concurrieron al laboratorio del Centro Diagnóstico Rossi. Todos los pacientes fueron derivados al laboratorio con solicitud médica de ß-CTx junto con otras determinaciones. El grupo estudiado fue heterogéneo, ya que algunos pacientes tenían diagnóstico reciente de osteoporosis y otros se encontraban en tratamiento desde hace varios años. Se obtuvo una muestra de suero por punción venosa, y la misma muestra de suero de cada paciente fue procesada en dos autoanalizadores diferentes: Cobas 801®, Roche (electroquimioluminiscencia) (CVi<4.5%, CVe<5.8%) y Maglumi 800®, Snibe (quimioluminiscencia) (CVi<4.3%, CVe<5.7%). La comparación de los resultados obtenidos se realizó mediante una adaptación de la guía EP-9A2 del CLSI.
El reactivo Elecsys/Cobas ß-CrossLaps/serum de Roche, utiliza un anticuerpo monoclonal anti-ß-CTx marcado con un quelato de Rutenio, un anticuerpo monoclonal biotinilado anti-ß-CTx y micropartículas paramagnéticas recubiertas de estreptavidina. Se trata de un ensayo electroquimioluminiscente de tipo no competitivo (sandwich).
El reactivo Maglumi ß-CT de Snibe, utiliza un anticuerpo monoclonal anti-ß-CTx marcado con N-(4-aminobutil)-N-etil isoluminol (ABEI) y micropartículas paramagnéticas recubiertas con un anticuerpo monoclonal anti-ß-CTx. Se trata de un ensayo quimioluminiscente de tipo no competitivo (sandwich).
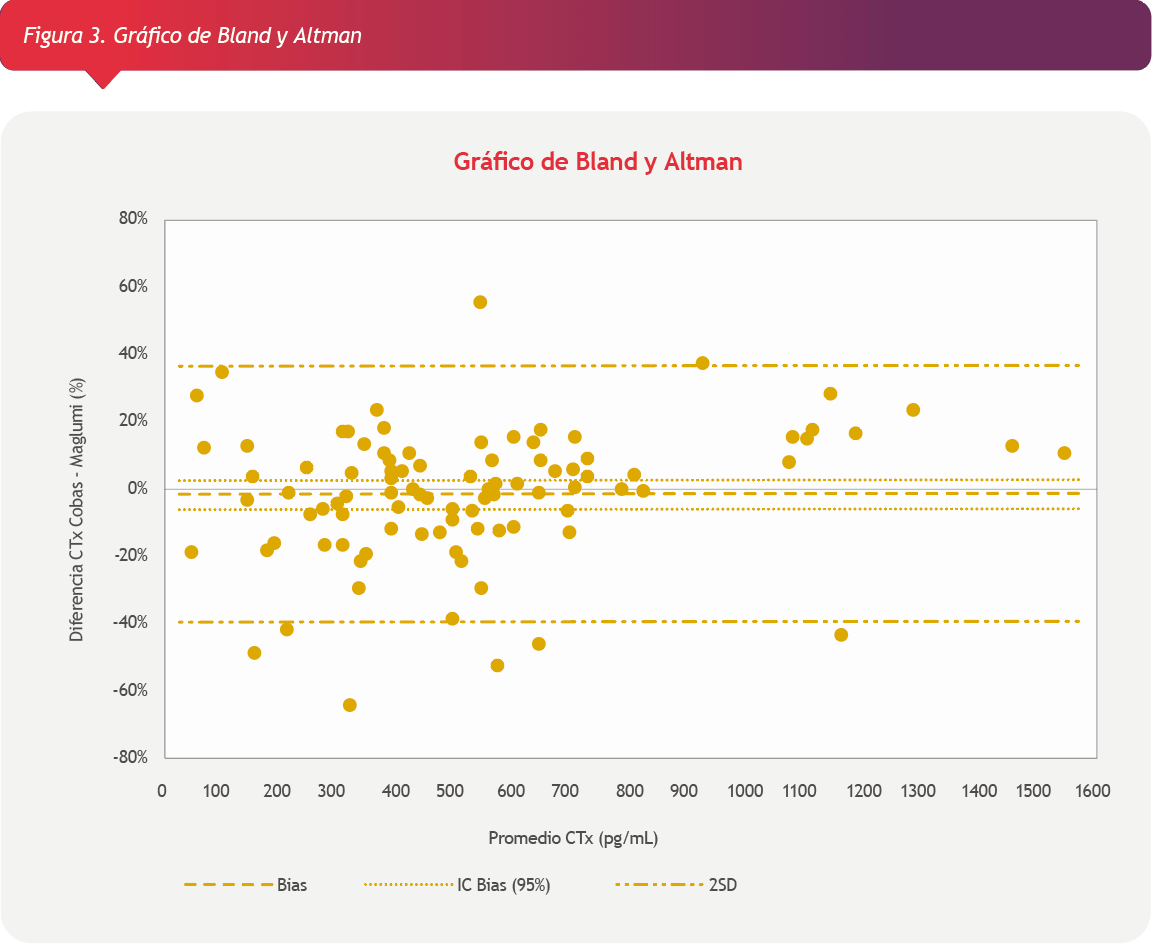
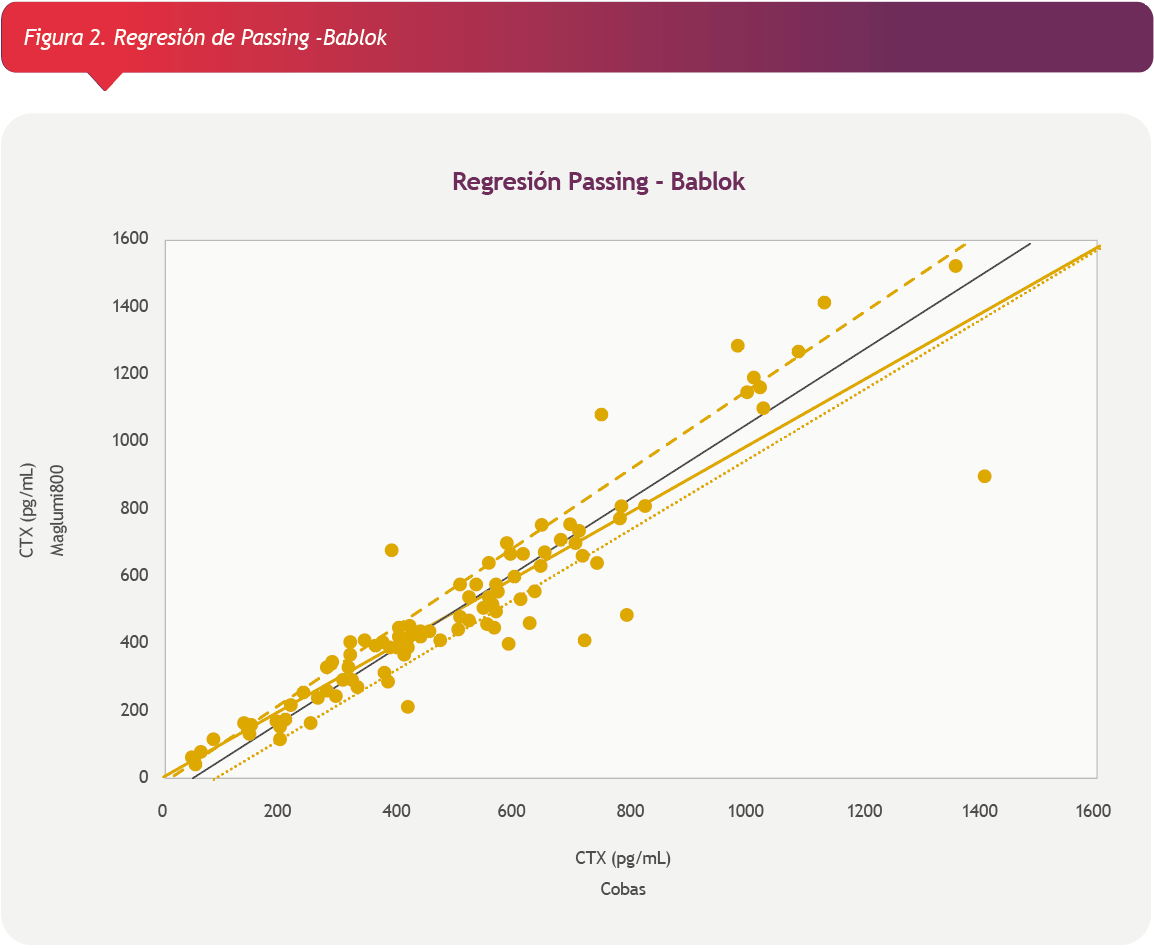
El análisis estadístico se realizó utilizando el software SPSS Versión 23.0. Para evaluar diferencias entre las medianas se utilizó el test U de Mann-Whitney. El análisis de correlación se realizó mediante la regresión de Passing-Bablok. La concordancia de resultados se evaluó mediante el Gráfico de Bland y Altman.
Resultados
En la tabla 1 se muestran los parámetros estadísticos del análisis exploratorio de datos. La distribución de ambos grupos de resultados fue no paramétrica. No se encontró diferencias significativas entre las medianas (test U de Mann-Whitney, p= 0.826).
Los resultados de ß-CTx medidos por ambos instrumentos presentaron una correlación lineal con un coeficiente de correlación de 0.937. (Figura 1)
Al realizar el análisis de Bland y Altman se observó que los métodos eran concordantes ya que el 80% de las diferencias se encuentran dentro de los límites del error estándar (19.6%) y se observó un sesgo promedio de -1.41 % (Figura 2).
Conclusiones
De acuerdo al análisis realizado no se observaron diferencias significativas entre las medianas de de ß-CTx en los resultados obtenidos por Cobas 801 y Maglumi 800. Se evidenció una correlación lineal con un coeficiente de correlación aceptable (r = 0.937).
Los resultados obtenidos por ambos instrumentos fueron concordantes, presentando un bias% de -1.44%, aunque este parámetro podría estar siendo subestimado debido a la elevada dispersión de las diferencias (desvío estándar % = 19,6%).
Si bien no se evidencia que la diferencia entre ambos métodos pueda generar un cambio en la decisión clínica siempre es recomendable informar sobre el cambio de plataforma al médico solicitante.
Referencias Bibliográficas
1. Rosenquist C, Fledelius C, Christgau S, et al. Serum CrossLaps One Step ELISA. First application of monoclonal antibodies for measurement in serum of bone-related degradation products from C-terminal telopeptides of type I collagen [J]. Clinical chemistry, 1998, 44(11): 2281-2289.
2. Byrjalsen I, Leeming D J, Qvist P, et al. Bone turnover and bone collagen maturation in osteoporosis: effects of antiresorptive therapies [J]. Osteoporosis international, 2008, 19(3): 339-348.
3. Samuel D Vasikaran, Masakazu Miura, Richard Pikner, Harjit P Bhattoa, Etienne Cavalier ; IOF-IFCC Joint Committee on Bone Metabolism (C-BM). Practical Considerations for the Clinical Application of Bone Turnover Markers in Osteoporosis. Calcif Tissue Int. 2021 Nov 30. doi: 10.1007/s00223-021-00930-4. Online ahead of print.
4. P D Delmas. Biochemical markers of bone turnover in Paget’s disease of bone. J Bone Miner Res. 1999 Oct;14 Suppl 2:66-9. doi: 10.1002/jbmr.5650140213.
5. Markus J Seibel. Biochemical markers of bone turnover: part I: biochemistry and variability Clin Biochem Rev. 2005 Nov;26(4):97-122.
6. Fledelius C, Johnsen A H, Cloos P, et al. Characterization of urinary degradation products derived from type I collagen. Identification of a beta-isomerized Asp-Gly sequence within the C-terminal telopeptide (alpha1) region. [J]. Journal of Biological Chemistry, 1997, 272(15):9755-63.
7. Bonde M, Garnero P, Fledelius C, et al. Measurement of Bone Degradation Products in Serum Using Antibodies Reactive with an Isomerized Form of an 8 Amino Acid Sequence of the C?Telopeptide of Type I Collagen[J]. Journal of Bone and Mineral Research, 1997, 12(7): 1028-1034.
8. Musumeci M B, Palermo A, Donofrio L, et al. Serum chitotriosidase in postmenopausal women with severe osteoporosis [J]. Osteoporosis International, 2016, 27(2): 711-716.
9. Okabe R, Nakatsuka K, Inaba M, et al. Clinical Evaluation of the Elecsys β-CrossLaps Serum Assay, a New Assay for Degradation Products of Type I Collagen CTelopeptides[J]. Clinical Chemistry, 2001, 47(8): 1410-1414.
10. Kucukalicselimovic E, Valjevac A, Hadžovicdžuvo A, et al. Evaluation of bone remodelling parameters after one year treatment with alendronate in postmenopausal women with osteoporosis[J]. Bosnian Journal of Basic Medical Sciences, 2011, 11(1): 41-45.