Inmunogenicidad de una vacuna recombinante anti hepatitis B en personal de salud*
Patricia García C.1, Gabriela De La Cerda S.2, Mario Calvo A.3, Rosa Godoy G.1,
Carmen Covarrubias F.4, Marcela Potin S.5 Y Teresa Quiroga G.1
Facultad de Medicina. Pontificia Universidad Católica de Chile:
1 Unidad Docente Asociada de Laboratorios Clínicos.
2 Comité de Infecciones Intrahospitalarias.
3 Departamento de Medicina.
4 Departamento de Gastroenterología.
5 Laboratorio GlaxoSmithKline.
* Trabajo financiado parcialmente por Laboratorio GlaxoSmithKline.
Correspondencia: Patricia García Cañete – E-mail: pgarcia@med.puc.cl
Bernanda Morín #488, 2° Piso, Providencia. Santiago – Chile. Fono/Fax: (56-2) 23413539 revinf@sochinf.c
Rev. chil. infectol. v.19 n.3 Santiago 2002
http://dx.doi.org/10.4067/S0716-10182002000300001
Rev Chil Infect (2002); 19 (3): 133 – 139
Hepatitis B is an infection, which can carry long-term serious health consequences, being the health-care workers a group in risk of acquiring it. There are safe and effective vaccines currently in use, although there is a percentage on non-responders. With the objective of evaluating the immunogenicity of a recombinant vaccine, health-care workers in high and moderate risk groups of acquiring this infection were vaccinated. Quantitative levels of antibodies against hepatitis B surface antigen (anti HBs) were measured after 6 months of the vaccination. The group included 351 women and 134 men, being the average 35.8 years. In this group 409 workers had levels of anti HBs over 100 mUI/ mL (84.3), 55 in between 10 and 99 mUI/mL (11.3%) and 21 under 10 mUI/mL (4.3%). Studing these three groups by multivaried analysis we found that the anti HBs were lower, if the age was higher (p < 0.01). These was no association with gender or corporal mass index. These results show that the immunogenicity or the recombinant vaccine is effective because 95.7% of the vaccinated people had protective levels of anti-HBs and only 4.3% required a booster dose. It is important to consider the age of the population when designing plans for prevention of hepatitis B infection.
Keywords: Hepatitis B, Vaccination, Health care workers, Recombinant vaccine.
Introducción
La hepatitis B (HB) es una infección de distribución universal, cuya importancia epidemiológica ha sido demostrada por múltiples estudios; la prevalencia del antígeno de superficie (HBsAg) varía entre 0,3 y 13% en la población general de América Latina1 y se estima en 3,2% en E.U.A.2. El conocimiento de sus formas de transmisión ha permitido determinar los grupos con mayor riesgo de contraer la infección; uno de ellos es el personal de salud que posee una prevalencia de 0,3% para HBsAg y de 3 a 10% si se considera cualquier marcador de hepatitis B3. Este riesgo es más importante para el personal de salud que toma contacto con sangre y fluidos corporales4. En Chile, los datos disponibles señalan una prevalencia variable; en un estudio realizado en el Hospital de Urgencia Asistencia Pública Dr. Alejandro Del Río en el año 1990, considerando cualquier marcador de HB, se detectó 13,6% de positividad en el Servicio de Emergencia, 9,1% en el Servicio de Odontología, 7,7% en el Laboratorio Clínico y 4,5% en el Banco de Sangre (Rosa Tapia, comunicación personal). Otros estudios han mostrado cifras que oscilan entre 0 y 0,62% para HBsAg5-7, cifra similar al 0,25 y 0,35% descrita en donantes de sangre y mujeres embarazadas respectivamente8-10, y observada en la población general. Sin embargo, los estudios de prevalencia en personal de salud poseen un sesgo pues la mayoría se han realizados en personal muy joven, en conocimiento que la prevalencia aumenta con el tiempo de exposición11.
El riesgo de seroconversión posterior a una exposición ocupacional con sangre o fluidos corporales de un individuo infectado varía entre 2 y 40%, según la presencia o ausencia del antígeno e12,13, así como según el estado inmune del receptor y el tipo de exposición4. La posibilidad de infección por VHB es 80 a 100 veces mayor que la descrita para VIH en las mismas condiciones. Estudios efectuados en E.U.A. estiman que 2% de los individuos infectados fallece, ya sea de hepatitis fulminante, cirrosis hepática o hepatocarcinoma y 6 a 10% permanece como portador4. Dada esta situación, se han diseñado estrategias para efectuar la profilaxis pre-exposición, consistentes fundamentalmente en barreras de protección, y en el uso de vacunas.
La vacuna de HB es segura y de eficacia conocida14-19. Más de 95% de los vacunados responde con niveles de anticuerpos protectores ( > 10 mUI/mL de anti HBs). La vacunación está indicada en los grupos expuestos, según la clasificación de riesgo del CDC3. Su inmunogenicidad está sujeta a variaciones individuales y se reconocen algunos factores que la disminuyen: sexo masculino, mayor edad, mayor índice de masa corporal (IMC) y el tabaquismo20-22. Se acepta que el grado de protección depende de la producción de anticuerpos anti HBs. Estos títulos van disminuyendo con el tiempo y se considera satisfactorio alcanzar después de la vacunación títulos mayores a 100 mUI/mL, dado que éstos se han correlacionado con una persistencia a más largo plazo de niveles protectores16,23-26.
Puesto que la inmunidad se relaciona con el nivel de títulos iniciales alcanzados post-vacunación, nuestro objetivo fue cuantificar la respuesta de anticuerpos anti HBs a la vacuna y evaluar los factores de riesgo que puedan condicionar inadecuada respuesta a ella.
Material y Método
Pacientes
Entre junio de 1996 y enero de 1997, se llevó a cabo un programa de vacunación contra HB en el Hospital Clínico de la Pontificia Universidad Católica de Chile. Se seleccionaron 913 funcionarios que no habían recibido en forma previa alguna dosis de vacunación contra HB, y que además, pertenecían por sus labores a los grupos de riesgo epidemiológico medio y alto según lo definido por la literatura médica3. Fue solicitado el consentimiento informado y se excluyeron los individuos que tenían contraindicaciones formales de vacunación o con posibles causales de incumplimiento.
Se registraron datos de edad, sexo e índice de masa corporal (IMC), profesión y servicio clínico de desempeño para definir su condición de riesgo, según los criterios señalados anteriormente.
Se utilizó la vacuna recombinante anti HB (Engerix B®, Glaxo SmithKline). La aplicación se realizó al mes 0, 1 y 6 por vía intramuscular, en la región deltoidea.
Medición de anticuerpos contra el antígeno de superficie de Hepatitis B
Se realizó medición de títulos de anticuerpos a los funcionarios en el período de 3 a 6 meses posteriores a la vacunación.
La determinación de anticuerpos anti HBs se efectuó mediante inmunoensayo cuantitativo (MEIA, AUSABÔ, Abbott), en un equipo Random Axes AxsymÔ, Abbott, en el Servicio de Laboratorios Clínicos de la Universidad Católica de Chile. Se categorizó a los vacunados en no respondedores (anti HBs menores de 10 mUI/mL), respondedores moderados (anti HBs entre 10 y 100 mUI/mL) y respondedores completos (mayores de 100 mUI/mL)17.
Se efectuó análisis de posibles factores relacionados a la ausencia de respuesta o al grupo con respuesta moderada, en los funcionarios en que se pudo obtener la información completa respecto a edad, sexo e IMC.
Análisis estadístico
Para el análisis estadístico se agruparon los títulos de anticuerpos en 3 niveles de respuesta: anti HBs menor de 10 mUI/mL, de 10 a 100 mUI/mL y mayor de 100 mUI/mL. Posteriormente se analizó con el método de t de Student para las variables cuantitativas. Para el análisis de la relación con el sexo, se utilizó la dócima no paramétrica de Kruskal-Wallis dada la gran dispersión de valores en los títulos de anticuerpos. Las variables que se correlacionaron con los niveles de anticuerpos fueron sometidas a un análisis multivariado mediante una regresión logística politómica.
Se utilizaron los paquetes estadísticos Epi.-Info 6.01, Minitab y RELOPO.
Se consideró significativo un nivel de p menor a 0,05.
Resultados
De los 913 funcionarios que ingresaron al programa de vacunación, 119 presentaban algún tipo de contraindicación (embarazo) o bien, rechazaron la vacunación. Iniciaron vacunación 794 funcionarios, de los cuales completaron el esquema 690 (86,8%); las causas de abandono fueron principalmente traslado a otro centro hospitalario y embarazo. De los 690 funcionarios se midió títulos en 485 (70,3%). Se calculó que se requerían 472 funcionarios para estimar la proporción de buena respuesta a la vacuna (respuesta total más respuesta parcial) con un rango de error de ± 2%, 99% de probabilidad, suponiendo una buena respuesta a la vacuna en al menos 90% de los individuos.
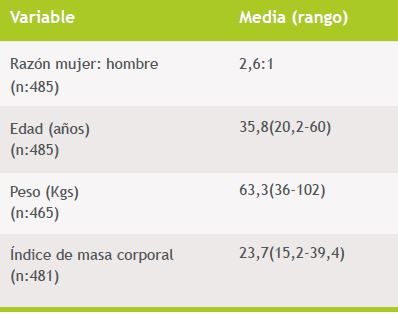
De los 485 funcionarios en los cuales se determinó título de anticuerpos, en 464 se dispuso de los datos de edad, talla y peso. El análisis univariado y multivariado se realizó con los 464 funcionarios para los cuales se disponía de toda la información. De los 485 funcionarios con títulos disponibles, 351 (72,4%) eran mujeres y 134 (27,6%) eran varones. El promedio de edad en los 465 funcionarios en que se obtuvo el dato, fue de 35,8 años; el peso promedio en los 481 funcionarios que aportaron el dato fue de 63,3 kg y el IMC promedio fue de 23,7 (Tabla 1).
Tabla 1. Características de la población vacunada
La actividad que desarrollaba cada funcionario se distribuyó de la siguiente forma: auxiliares paramédicos 227 (46,8%), enfermeras y matronas 102 (21,0%), médicos 87 (17,9%), tecnólogos médicos 57 (11,8%) y técnicas arsenaleras 12 (2,5%).
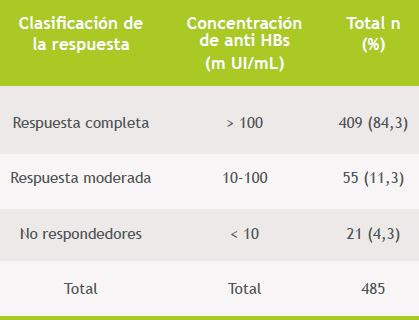
Los resultados de los títulos de anti HBs de los 485 funcionarios, obtenidos hasta los 6 meses post-vacunación se observan en la Tabla 2: 409 (84,3%) presentaron respuesta completa, 55 (11,3%) fueron respondedores moderados y 21 sujetos (4,3%) fueron no respondedores.
Tabla 2. Respuesta inmunogénica a la vacuna anti hepatitis B en funcionarios de la salud (n: 485)
La respuesta inmunogénica a la vacuna anti HB según sexo, edad e IMC, en aquellos pacientes en que se disponía del dato, se detalla en las Tablas 3, 4 y 5 respectivamente.
Tabla 3. Respuesta inmunológica a la vacuna anti hepatitis B según el sexo (n: 485)
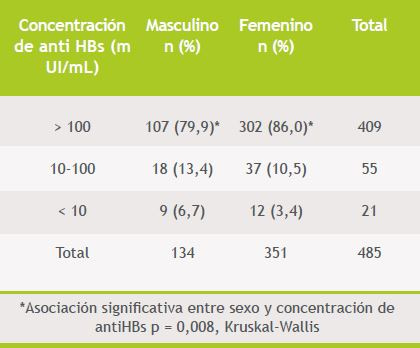
Tabla 4. Respuesta inmunológica a la vacuna anti hepatitis B según grupo de edad (n: 465)
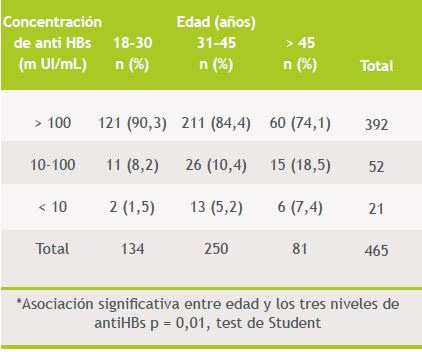
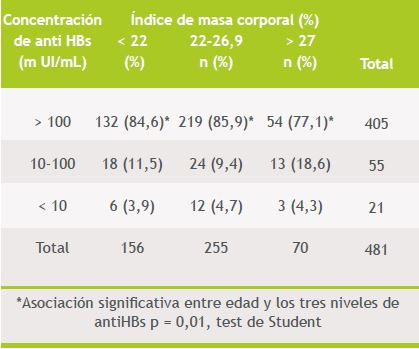
Tabla 5. Respuesta inmunológica a la vacuna anti hepatitis B según el índice de masa corporal (n: 481)
Relación entre falta de respuesta a la vacuna y factores de riesgo
Se encontró asociación significativa entre sexo y títulos de anti HBs (79 versus 86% con > 100 mUI/mL en varones versus mujeres, p = 0,008, Kruskal-Wallis), observándose que los títulos eran inferiores en el sexo masculino. Además se encontró asociación estadísticamente significativa entre edad y los 3 grupos de respuesta previamente definidos (p = 0,01, test de Student), de modo que a mayor edad, hubo menor respuesta a la vacuna contra HB. No se encontró asociación con el peso ni el índice de masa corporal por el mismo método.
El análisis multivariado considerando los tres grupos de respuesta, mostró sin embargo, asociación significativa sólo con la edad (p = 0,01). La asociación con el sexo no fue significativa (p = 0,09). Tampoco se demostró asociación con IMC (p = 0,57) ni con el peso corporal (p = 0,26).
Discusión
Los resultados confirman la inmunogenicidad de la vacuna recombinante utilizada en el personal de salud en riesgo ocupacional de HB, lo que ya ha sido demostrado por diversos autores14-19,22.
Los factores de riesgo de una mala respuesta a la vacuna encontrados en este trabajo concuerdan con los descritos en la literatura médica para edad y sexo, aunque para este último no se logró demostrar asociación independiente. Estos aspectos son importantes a considerar en el momento de definir una estrategia de prevención, ya que si bien hay consenso sobre la necesidad de vacunación universal a los grupos de riesgo medio y alto de infección por HB,4,22 no hay acuerdo sobre el tiempo de protección que confiere la vacuna y, por lo tanto, la estrategia de vacunación de refuerzo de estos grupos, es un tema aún por definir26-28. Una reciente publicación del Grupo Europeo de consenso en Inmunidad de Hepatitis B sugiere que las dosis de refuerzo no serían necesarias, ya que la protección depende de la generación de una memoria inmunológica más que de los títulos existentes al momento de la exposición ocupacional29. En consecuencia, sería necesario medir anticuerpos post-vacunación para diferenciar el grupo respondedor (moderado y completo) que permanecerá protegido, del grupo no respondedor (bajo 10 mUI/mL). En los grupos no respondedores la sugerencia es intentar obtener una seroconversión hasta con 3 dosis de vacuna espaciadas por 1 mes, midiendo la respuesta; aproximadamente dos tercios de los hasta entonces no respondedores, desarrollan una respuesta inmune. Aún así existe un bajo porcentaje que no responde; es importante identificarlo, educarlo y frente a exposiciones accidentales con una fuente conocidamente positiva para HBsAg, indicarles inmunoglobulina hiperinmune anti HB.
A pesar de lo anterior, dada la alta inmunogenicidad de la vacuna y del alto costo que significa determinar respuesta inmunogénica en los vacunados, se pudiera considerar mejor estrategia, definir los grupos de riesgo de inadecuada respuesta (grupos de mayor edad y de sexo masculino) para obtener el máximo beneficio versus costo en la determinación de anti HBs post-vacunación.
Respecto de los otros factores asociados a mala respuesta inmune a la vacuna ya descritos, no se encontró relación con el índice de masa corporal. Esto puede deberse a la poca precisión de la medición, ya que el peso fue consultado a cada funcionario, no habiéndose efectuado una medición del mismo. También pudo haber disminuido el poder estadístico para encontrar esta asociación, la poca incidencia de obesos moderados y severos en el grupo.
En conclusión, podemos señalar que la vacuna recombinante anti HB es inmunogénica en el grupo estudiado. Si bien las normas internacionales señalan que debiera medirse niveles de anticuerpos post-vacunación a todos los sujetos, el costo y la complejidad de esto lo hace poco practicable. Una opción alternativa sería medir la respuesta en los grupos de riesgo, que en esta serie fueron los mayores de 45 años de sexo masculino, o incluir otros grupos señalados en la literatura médica.
Resumen
El virus de hepatitis B (HB) es capaz de persistir en un porcentaje de los infectados produciendo enfermedad hepática crónica a largo plazo. El personal de salud es un grupo especialmente expuesto a contraer esta infección. Actualmente se dispone de vacunas anti HB inmunogénicas, eficaces y seguras. Aunque la mayoría de las personas responde en forma adecuada, un porcentaje bajo son no respondedores. Con el objeto de evaluar la respuesta inmune a una vacuna recombinante e identificar potenciales factores de riesgo de una respuesta inadecuada, se realizó un estudio prospectivo en funcionarios de la salud. A los 6 meses de recibir 3 dosis de vacuna contra HB (0-1-6 meses) se les midió título de anticuerpos contra antígeno de superficie de hepatitis B (anti HBs). Se estudiaron 485 sujetos con una relación mujer: hombre de 2,6:1 y una edad promedio de 35,8 años. De los 485, 409 (84,3%) funcionarios presentaron niveles mayores de 100 mUI/mL, 55 (11,3%) mostraron niveles entre
10 y 100 mUI/mL y 21 (4,3%) bajo 10 mUI/mL (4,3%). Un análisis multivariado de estos 3 grupos mostró que a mayor edad, los niveles de anti HBs eran menores (p < 0,01). No se encontró esta asociación con sexo e índice de masa corporal. Estos resultados muestran una adecuada inmunogenicidad de la vacuna recombinante ya que 95,7% de los individuos vacunados presentó niveles anti HBs considerados como protectores (> 10 mUI/mL.).
Referencias Bibliográficas
1.- Torres J, Machado I. Special aspects of hepatitis B virus and Delta virus infection in Latin America. Infect Dis Clin North Am 1994; 8:13-27.
2.- McQuillan G, Townsend T, Fields H, Carroll M, Leahy M, Polk F. Seroepidemiology of hepatitis B virus infection in the United States: 1976 to 1980. Am J Med 1989; 87: 5S-10S.
3.- Centers For Diseases Control. Protection against viral hepatitis. MMWR Morb Mortal Wkly Rep 1990: 39: 1-26 (Suppl 2S).
4.- Centers For Diseases Control. Guidelines for prevention of transmission of human immunodeficiency virus and hepatitis B virus to health-care and public- safety workers. MMWR Morb Mortal Wkly Rep 1989; 38: 1-37 (Suppl 6S).
5.- Ibarra H, Riedemann S, Gómez J C, Reinhardt G, Hochstein-Mintzel V, Froesner G. Hepatitis post-transfusional en Chile: Parámetros de referencia. Rev Méd Chile 1990; 118: 134-8.
6.- Velasco M, Brahm J, Borgoño J, Concha E, Veit O, Zavala C. Antígeno de superficie de la hepatitis B (HbsAg) y anticuerpo anti-HBs en consultantes ambulatorios y en personal del hospital. Rev Méd Chile 1984; 112: 994-7.
7.- Hadler S, Fay O, Pinheiro F, Maynard J. La Hepatitis en las Américas: Informe del Grupo Colaborador de la OPS. Bol Of Sanit Panam 1987; 103: 185-205.
8.- Mazzur S, Nath N, Fang C et al. Distribución de marcadores de virus de hepatitis B (VHB) en la sangre de donadores de 13 países del hemisferio occidental: Actas del Taller Latinoamericano de la Cruz Roja sobre hepatitis B. Bol Of Sanit Panam 1980; 89.
9.- Brahm J, Hurtado C, Latorre R et al. Infección con el virus de la hepatitis B en donantes de sangre en Chile. Estudio prospectivo (1988-1990). Rev Méd Chile 1991; 119(3): 354.
10.- Vial P, Torres-Pereyra J, Stagno S et al. Estudio serológico para citomegalovirus, virus del herpes simple y de la rubéola, hepatitis B y toxoplasma gondii. Bol Of Sanit Panam 1985; 90: 528-38.
11.- Chapiro C. Occupational risk of infection with hepatitis B and hepatitis C virus. Surg Clin North Am 1995; 75: 1047-56.
12.- Alter H, Seeff L, Kaplan P et al. Type B hepatitis: The infectivity of blood positive for e antigen and DNA polymerase after accidental needlestick exposure. N Engl J Med 1976; 295: 909-13.
13.- Grady F, Prince A M, Kaplan M M et al. Relation of e antigen to infectivity of HBsAg-positive inoculations among medical personnel. Lancet 1976; 1: 492-4.
14.- Van Damme P, Vranckx R, Saffary A et al. Protective efficacy of a recombinant deoxyribonucleic acid hepatitis B vaccine in institutionalized mentally handicapped clients. Am J Med 1989; 87 (Suppl 3A): 26S-31S.
15.- Centers For Disease Control. Recommendations for protection against viral hepatitis. MMWR Morb Mortal Wkly Rep 1985; 34: 313-324, 329-335.
16.- Hadler S, Francis D, Maynard J et al. Long term immunogenicity and efficacy of hepatitis B vaccine in homosexual men. N Engl J Med 1986; 315: 209-14.
17.- Centers For Disease Control. Hepatitis B Virus: A comprehensive strategy for eliminating transmission in the United States through universal childhood vaccination. MMWR Morb Mortal Wkly Rep 1991; 40: 1-25.
18.- Jefferson T, Demicheli V, Deeks J, Mcmillan A, Sassi F, Pratt M. Vaccines against hepatitis B in health care workers. The Cochrane Library 1998, Issue 4. www.cochrane.es
19.- Francis A, Path F. Summary of safety and efficacy data on a yeast-derived hepatitis B vaccine. Am J Med 1989; 87(Suppl 3 A): 14S-9S.
20.- Wood R, McDonald K L, White K, Hedberg C, Hanson M, Osterholm M. Risk factors for lack of detectable antibody following hepatitis B vaccination of Minnesota health care workers. JAMA 1993; 270: 2935-9.
21.- Weber D, Rutala W, Samsa G, Santimaw J, Lemon S m. Obesity as a predictor of poor antibody response to hepatitis B plasma vaccine. JAMA 1985; 254: 3187-9.
22.- Hollinger F. Factors influencing the immune response to hepatitis B vaccine, booster dose guidelines, and vaccine protocol recommendations. Am J Med 1989; 87: 36S-41S (Suppl 3A).
23.- Jilg W, Schmidt M, Deinhardt F, Zachoval R. Hepatitis B vaccination: How long does protection last?. Lancet 1984; 2: 458.
24.- Laplanche A, Couroucé A, Berhamou E, Jungers P. Timing of hepatitis B revaccination in healthy adults. Lancet 1987; 316: 47-8.
25.- Nommensen F, Go S, Maclaren D. Half-life of HBs antibody after hepatitis B vaccination: An aid to timing of booster vaccination. Lancet 1989; 2: 847-9.
26.- Van Herck C, Van Damme P, Thoelen S, Meheus A. Long term persistence of anti-HBs after vaccination with a recombinant DNA yeast-derived hepatitis B vaccine: 8 year results. Vaccine 1998; 16: 1933-5.
27.- Alimonos K, Nafziger A, Murray J, Bertino J Jr. Prediction of response to hepatitis B vaccine in health care workers: Whose titers of antibody to hepatitis B surface antigen should be determined after a three-dose series, and what are the implications in terms of cost-effectiveness?. Clin Infect Dis 1998; 26:566-71.
28. European Consensus Group on Hepatitis B Immunity. Are booster immunizations needed for lifelong hepatitis B immunity?. Lancet 2000; 355: 561-5.






