Incorporación de la evaluación de tecnologías sanitarias en la toma de decisiones en el sistema de servicios de salud del seguro social del Perú: La experiencia del IETSI
Verónica Peralta1,a, Maribel M. Castro-Reyes1,a,e, Patricia Pimentel-Álvarez3,b,f, Fabian Fiestas2,c, g, Víctor Dongo2,d,f
1 Instituto de Evaluación de Tecnologías en Salud e Investigación – IETSI, EsSalud, Lima, Perú
2 Instituto de Gestión y Evaluación de Tecnologías Sanitarias – IGETS, Lima, Perú
3 Universidad Continental, Lima, Perú.
a Médico especialista en Gestión en Salud
b Médico oncólogo
c Médico epidemiólogo
d Médico cirujano
e Magíster en Gestión Pública
f Magíster en Salud Pública
g Doctor en Filosofía en Epidemiología
ORCID
Maribel M. Castro-Reyes: 0000-0002-6791-0952
Verónica Peralta: https://orcid.org/0000-0002-4729-3571
Patricia Pimentel-Álvarez: https://orcid.org/0000-0001-7299-1227
Fabian Fiestas: http://orcid.org/0000-0002-9158-443X
Víctor Dongo: https://orcid.org/0000-0003-2406-2436
Contribución de autoría
VP, MMCR, PPA, FF y VD concibieron la idea de investigación, redactaron el primer borrador del manuscrito. Todos los autores revisaron críticamente el manuscrito, dieron aportes sustanciales, aprobaron la versión final y asumen responsabilidad relacionada a todos los aspectos del artículo.
Financiamiento
No se recibió financiamiento para la elaboración de este artículo.
Conflicto de intereses
VP Y MMCR son funcionarios del IETSI-EsSalud. Asimismo, PPA, FF y VD son ex – funcionarios del IETSI.
Autor corresponsal
Verónica Victoria Peralta Aguilar Dirección: Jirón Domingo Cueto 120, Jesús María 15072, Lima, Perú. Teléfono: + 51943644534 E-mail: veronica.peralta@essalud.gob.pe
Resumen
Los sistemas de salud públicos tienen el gran reto de atender las necesidades de salud de la población con recursos económicos limitados. Así, para incorporar nuevas tecnologías sanitarias (TS) en sus planes de cobertura usan herramientas que les permitan informar sus decisiones en evidencia científica, como las evaluaciones de tecnología sanitaria (ETS). Éstas son desarrolladas de forma multidisciplinaria, bajo una metodología explícita, lo que permite calcular el valor de una tecnología. Con esta información, el decisor puede sustentar su decisión, prever el impacto de su implementación, planificar acciones y establecer metas; todo lo cual potencia un uso eficiente de los recursos, transparencia de los procesos y facilita la rendición de cuentas.
El Seguro Social de Salud del Perú (EsSalud) implementó, a través del Instituto de Evaluación de Tecnologías en Salud e Investigación (IETSI), un proceso de toma de decisiones basado en ETS para decidir sobre la cobertura de nuevas TS. Desde la creación del IETSI en diciembre 2014 a diciembre del año 2021 se han realizado 407 ETS. De éstas, 161 fueron aprobatorias, extendiéndose así nuevos tratamientos para condiciones clínicas. Estas incorporaciones no se han traducido en un incremento agudo en el gasto anual de medicamentos que ponga en riesgo la sostenibilidad financiera de EsSalud, aunque incrementó el acceso de pacientes a tecnologías innovadoras. La inversión promedio por paciente atendido con estas tecnologías se redujo después de la creación del IETSI de S/ 133,270.00 en el 2011 a S/ 47,779.00 en el 2019.
Palabras clave: Evaluación de la Tecnología Biomédica, Cobertura Universal de Salud, toma de decisiones (DeCS-BIREME).
Abstract: Including health technology assessment in the decision-making process of the Peruvian social security healthcare system: The IETSI experience
Public health systems have the great challenge of meeting the population’s health needs with limited financial resources. Thus, to incorporate new health technologies (HT) in their coverage plans, they use tools that allow them to inform their decisions based on scientific evidence, such as health technology assessments (HTAs). These are developed in a multidisciplinary way, under an explicit methodology, which estimates the value of a technology. With this information, the decision-maker can support his decision, anticipate the impact of its implementation, plan actions, and set goals, all of which promote efficient use of resources, transparency of processes, and facilitate accountability.
The Peruvian Social Security healthcare system (EsSalud) implemented, through the Instituto de Evaluación de Tecnologías en Salud e Investigación (IETSI), a decision-making process based on HTAs to decide on the coverage of new HT. From the creation of the IETSI in December 2014 to December 2021, 407 ETS have been carried out. Of these, 161 were approved, thus extending new treatments for clinical conditions. These incorporations have not translated into a sharp increase in the annual expending of medicines to put EsSalud’s financial sustainability at risk, although it has increased patient access to innovative technologies. The average investment per patient treated with these technologies was reduced from S/ 133,270 in 2011 to S/ 47,779 in 2019.
Keywords: Technology assessment, biomedical, Universal Health Coverage, Decision making (MeSH-NLM).
Introducción
Una tecnología sanitaria (TS) es definida en el HTA Glossary como “una intervención desarrollada para prevenir, diagnosticar o tratar condiciones médicas; promover la salud, proveer rehabilitación u organizar los servicios de salud” (1). El avance tecnológico ha permitido que tecnologías sanitarias innovadoras ingresen al mercado a una velocidad mayor a la que pueden responder los sistemas que cobertura servicios de salud (2).
En este contexto, los sistemas de salud se ven en la necesidad de priorizar la cobertura de tecnologías que ofrezcan los mejores perfiles de seguridad, eficacia y costo efectividad con el objetivo de contribuir al uso racional de las tecnologías y una financiación sostenible de la salud. Al respecto, ya en el año 2010, la 67a Asamblea Mundial de la Salud, órgano tomador de decisiones de la Organización Mundial de la Salud (OMS), advertía que un 40% de los fondos en salud se despilfarraba, por lo que instó a los países miembros a establecer procedimientos sistemáticos que permitan la evaluación independiente, multidisciplinaria y científica de las tecnologías sanitarias, con el objetivo de fundamentar las decisiones políticas en salud (3). Por otro lado, la ETS es considerada por la Organización para la Cooperación y el Desarrollo Económico (OCDE) como la capacidad estratégica que un país debe implementar en su sistema de salud para lograr una adquisición inteligente de medicamentos. Así, la OCDE considera la ETS como una herramienta que impulsa el desarrollo integral de los gobiernos, pues contribuye en políticas que promueven el bienestar económico y social de las personas, que es justamente lo que promueve esta institución de relevancia mundial (4)(5).
Varios países han incorporado ya en sus sistemas sanitarios las ETS dentro de sus procedimientos para evaluar y darle valor a las tecnologías sanitarias innovadoras con el objetivo de informar la toma de decisión y priorizar su cobertura (2). Específicamente, la ETS es un procedimiento sistemático y formal desarrollado por un equipo multidisciplinario que utilizan métodos explícitos y científicos para determinar el valor de una tecnología sanitaria en sus diferentes ciclos de vida (desde la inversión hasta la desinversión); sus resultados permiten informar la toma de decisión de los actores políticos en salud, así, se contribuye a construir un sistema de salud equitativo, eficiente y de alta calidad (6).
Contexto del Sistema de Servicios de Salud de Essalud
El Seguro Social de Salud (EsSalud) es una entidad pública que brinda cobertura de atención en salud a 11,666,225 asegurados, aproximadamente a un tercio de la población peruana (7), y se rige bajo normas nacionales de salud emitidas por el Ministerio de Salud del Perú (MINSA). Entre los servicios que brinda a sus asegurados se encuentran servicios de prevención, promoción, recuperación y rehabilitación de la salud (8) a través de una red de establecimientos de salud de diferentes niveles de atención distribuidos en todo el país, donde se prestan intervenciones de salud de baja y alta complejidad según necesidad (9).
Entre los años 2011 al 2013, el porcentaje de gasto en medicamentos respecto al total de gasto de EsSalud (que incluye pago de personal de salud, de servicios básicos de los establecimientos de salud, adquisición de equipamiento, entre otros) tuvo una tendencia creciente. Así, en el año 2011 el gasto en medicamentos representaba el 9.5% del gasto total de EsSalud, en el año 2012 representó el 10.2% y en el año 2013 el 10.5%. Este incremento en la inversión en medicamentos se corresponde con el incremento en tratamientos especializados, como la quimioterapia, inmunoterapia para el tratamiento de pacientes positivos al virus de la inmunodeficiencia humana (VIH +) e inmunoterapia para trasplante. En el año 2011 se atendieron 89,466 tratamientos con quimioterapia, 49,382 tratamientos con inmunoterapia para VIH (+) y 11,100 tratamientos con inmunoterapia para trasplante; mientras que en el 2013 se atendieron 105,235 tratamientos con quimioterapia, 49,382 tratamientos con inmunoterapia para VIH (+) y 13,113 tratamientos con inmunoterapia para trasplante (10).
Muchos de estos tratamientos especializados involucran el uso de productos farmacéuticos innovadores. En el año 2014, la Dirección General de Medicamentos Insumos y Drogas determinó que el 97.8% del consumo de medicamentos oncológicos fue cubierto por aseguradoras públicas y el 62.4% de este consumo correspondió a EsSalud. Además, el 52% del consumo de medicamentos oncológicos en el sector público se concentró en 2 productos biotecnológicos o innovadores: trastuzumab y rituximab (11).
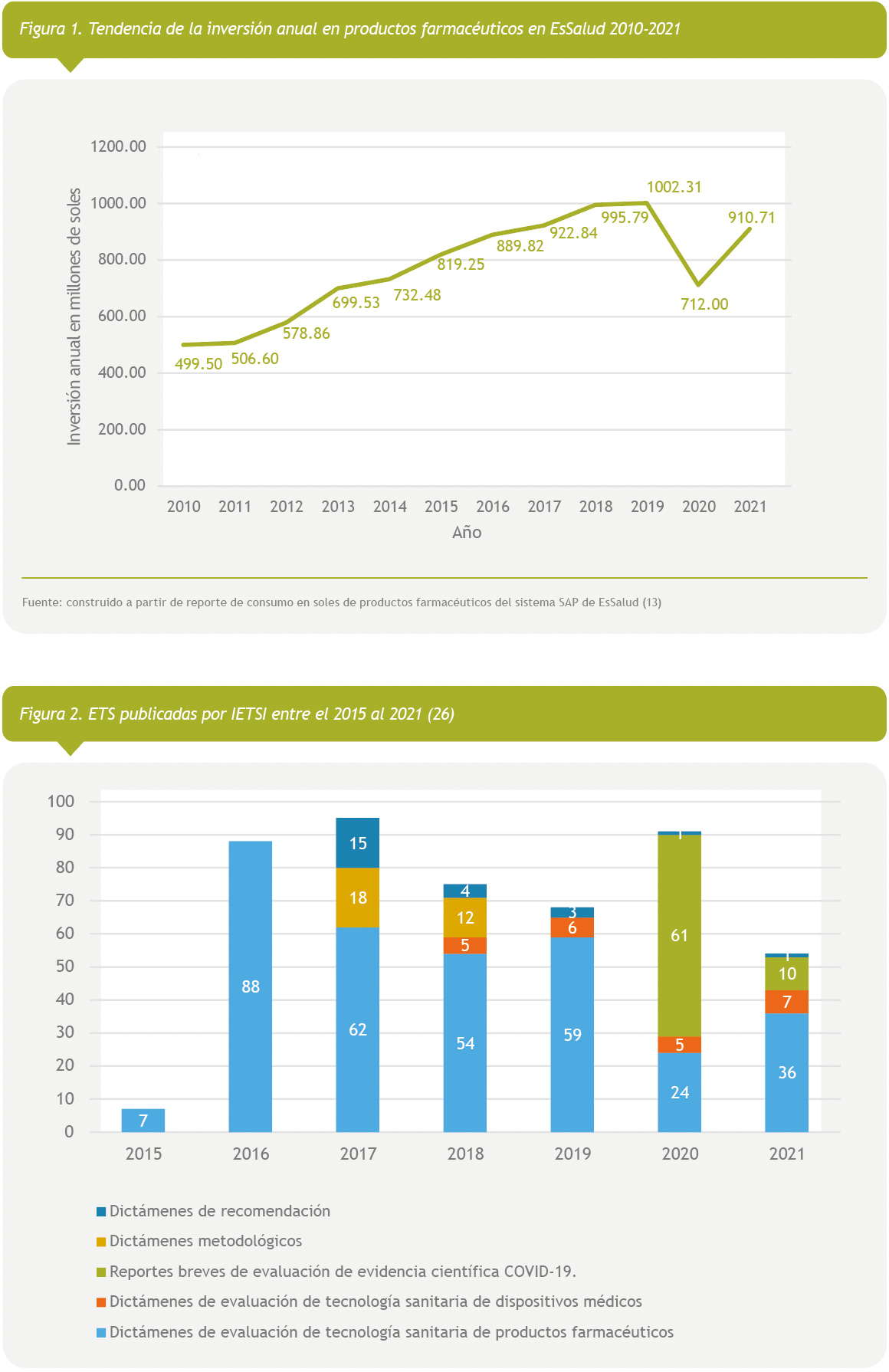
Adicional a ello, en el año 2011 se actualizó el Petitorio Farmacológico de EsSalud donde se evidenció la incorporación de 322 nuevos medicamentos entre los que se encontraban productos biológicos innovadores de alto costo, como infliximab, etanercep, interferón beta, algasidasa beta, imiglucerasa, etc. Sin embargo, no se publicaron las evaluaciones basadas en evidencia de cada uno de estos productos (12). En la figura 1 se observa la tendencia creciente en la inversión en productos farmacéuticos desde el año 2010 en EsSalud, desde el inicio de funciones del IETSI en el 2015 la tendencia continuó en crecimiento hasta el 2018 en donde se observa una tendencia de meseta hasta el 2019. Es preciso notar que, durante los años 2020 y 2021 se han observado cambios inusuales en la tendencia que se venía dando en la inversión en productos farmacéuticos, lo cual se explica por los cambios en la atención de los servicios de salud que se dieron por las medidas de restricción social dictaminadas por el gobierno peruano para controlar la pandemia por la COVID-19.
En este contexto se hizo necesario un procedimiento sistemático y transparente para evaluar y aprobar la cobertura de tecnologías sanitarias innovadoras, pues, hasta el año 2014 el procedimiento para la evaluación y aprobación de cobertura de nuevas tecnologías sanitarias en EsSalud se realizó a través de un comité de la Gerencia Central de Prestaciones de Salud de EsSalud, conformado por médicos especialistas cuyos procedimientos de evaluación y parámetros de toma de decisión no eran explícitos, la evaluación era de cada paciente individual (caso por caso) (14) y al no haber un marco normativo específico, los resultados de las evaluaciones tenían una alta variabilidad, no eran predictibles, y los miembros del comité no se sentían protegidos frente a la posibilidad de recibir presiones de intereses políticos o económicos, pues no se constituían como una unidad orgánica con independencia para la toma de decisión.
Una nueva forma de tomar decisiones en el Perú: El IETSI
El 31 de diciembre del año 2014, se creó el Instituto de Evaluación de Tecnologías en Salud e Investigación (IETSI) dentro del organigrama de Essalud, como órgano responsable de la “evaluación económica, social y sanitaria de las tecnologías sanitarias para su incorporación a la institución, así como de proponer las normas, estrategias e innovación científico tecnológica en el campo de la salud, que contribuya al acceso y uso racional de tecnologías en salud basada en la evidencia de la eficacia, seguridad y costo efectividad, a ser utilizadas por la Red Prestadora de servicios de salud de EsSalud en el ámbito nacional”(15).
Al momento de su creación, en el Perú la ETS no era parte inherente del proceso sistemático de toma de decisiones sobre cobertura o financiamiento en ninguno de los subsistemas públicos de servicios de salud (Ministerio de Salud, los gobiernos regionales, EsSalud, o de las Fuerzas Armadas y Policía Nacional). Sin embargo, ya se encontraban iniciativas que desde instancias públicas fomentaban y participaban generando evidencias científicas para elevarlas a los tomadores de decisiones de alto nivel e informar dichos procesos. Por ejemplo, en el 2009, se creó la Unidad de Análisis y Generación de Evidencias en Salud Pública (UNAGESP) como una unidad funcional dentro del Centro Nacional de Salud Pública del Instituto Nacional de Salud (INS). Esta unidad realizó avances importantes en la generación de documentos técnicos basados en evidencia científica que fueron usados por funcionarios del Ministerio de Salud para tomar decisiones sobre salud pública (16).
El IETSI, por su parte, fue creado para tener una naturaleza orgánica dual: de generador de evidencia y de tomador de decisiones, similar a agencias internacionales como Instituto Nacional de Salud y Excelencia Clínica del Reino Unido (NICE por sus siglas en inglés) de Reino Unido o Agencia Canadiense de Medicamentos y Tecnologías en Salud (CADTH por sus siglas en inglés) de Canadá agencias que concluyen en una recomendación para reembolso de tecnologías sanitarias en sus respectivos sistemas de salud (17,18). Así, el IETSI de acuerdo con su Reglamento de Organización y Funciones (ROF), publicado en febrero del año 2015, está constituido por tres direcciones que en conjunto le permiten cumplir con su naturaleza: la Dirección de Evaluación de Tecnologías Sanitarias (DETS), la Dirección de Guías de Práctica Clínica, Fármaco y Tecnovigilancia (DGPCFyT), y la Dirección de Investigación (DIS). Es a través de la DETS que el IETSI asume la responsabilidad de evaluar y decidir la incorporación, uso, salida o cambio de productos farmacéuticos y dispositivos médicos en EsSalud, basándose en evidencia científica, con el fin de lograr el máximo beneficio de la población asegurada y la sostenibilidad financiera de EsSalud (19); para ello, genera y sintetiza críticamente la evidencia científica existente a nivel local e internacional usando la metodología sistemática de desarrollo de evaluación de tecnologías sanitarias, cuyos resultados informan la toma de decisión y cuyas decisiones son de aplicación inmediata en toda la red nacional de EsSalud.
Hitos en desarrollo del IETSI, del 2015 al 2016
Para ejecutar las funciones encomendadas, en el año 2015 el IETSI publicó e implementó las normativas que establecen los nuevos procedimientos para solicitar, evaluar y aprobar una nueva TS en EsSalud. Aún, cuando estas normativas eran las primeras de su tipo en el país, puesto que establecía un proceso de toma de decisiones en base a ETS, éstas debían encajar armoniosamente en el contexto local. Por lo cual, fueron formuladas sobre la base del marco jurídico, las características organizacionales, de infraestructura, recursos humanos y financieros de EsSalud. Así, el marco jurídico nacional que regula la autorización y uso de productos farmacéuticos y dispositivos médicos en el país (MINSA) fueron insumos claves (20–23). En el Perú, la Ley 29459 “Ley de productos farmacéuticos, dispositivos médicos y productos sanitarios” establece un petitorio nacional único de productos farmacéuticos (24), y que todos los productos que se encuentren fuera de ese listado deben ser evaluados bajo criterios de seguridad, eficacia y costos para decidir su cobertura con el objetivo de asegurar el uso racional de los mismos (25), motivo por el cual, todos los productos farmacéuticos solicitados y que no se encontraran dentro del Petitorio farmacológico de EsSalud tendrían que pasar por un procedimiento de evaluación para decidir su cobertura.
Los nuevos procedimientos involucran un cambio en el flujo de atención de las solicitudes de tecnologías sanitarias innovadoras, así como un cambio en la evaluación, en la forma de tomar decisiones sobre su cobertura y de aplicar sus resultados. Se estableció que la evaluación de la solicitud de una TS innovadora sería realizada por el IETSI a través de una ETS, los resultados de esta sustentarán la toma de decisión a ser aplicada a nivel nacional y se publicaría mediante un Dictamen de forma transparente y con acceso libre a través de repositorios web. Así, en caso surgieran nuevos pacientes con la misma necesidad o condición clínica, los establecimientos de salud de la Red de EsSalud, de forma descentralizada, podrían consultar los dictámenes emitidos y en base a ellos recomendar el uso en sus pacientes individuales que cumplan con los criterios de uso establecidos en los dictámenes del IETSI, dejando de lado la práctica centralizada de evaluación de cada paciente individual (o caso por caso) por una decisión central de aplicación equitativa para el nivel nacional en la población asegurada cubierta por EsSalud.
Con respecto a la ETS, el procedimiento se enfocó principalmente en la evaluación de la seguridad y eficacia del uso de un producto farmacéutico para el tratamiento de una determinada condición clínica. La ETS es realizada por un equipo multidisciplinario que involucra metodólogos (profesionales de la salud con conocimientos de epidemiología, estadística avanzada y lectura crítica de la evidencia científica), médicos especialistas clínicos (se convoca especialidades médicas según la patología evaluada), médicos gestores en salud, bibliotecólogo y funcionarios del IETSI. La evaluación concluye con el perfil de seguridad y eficacia de la TS evaluada y la aprobación o no aprobación de uso. Este documento se publica en la página web del IETSI (26) y esta decisión se implementa inmediatamente a nivel nacional dentro de EsSalud. En caso sea aprobatoria, se dará cobertura a la TS a través de su inclusión en los listados institucionales de TS. De esta forma, el proceso es sistemático, equitativo, transparente y asegura el uso racional de la TS, pues solo se invierte en TS que resulten con un perfil beneficioso de eficacia y seguridad en desenlaces de relevancia clínica desde la perspectiva del paciente, práctica que contribuye a la sostenibilidad financiera de EsSalud.
Es importante hacer notar que, a este punto en el tiempo, muy pocas de las ETS publicadas por el IETSI han requerido de una evaluación económica (EE). Esto es porque la utilidad principal de las EE se da en escenarios donde dos TS que tienen un balance de eficacia y seguridad favorable en una condición clínica compiten por un mismo nicho de cobertura en un sistema de salud, siendo que cada una puede tener ventajas y desventajas en términos de efecto clínico o en costos. En la experiencia del IETSI, la gran parte de las evaluaciones resultaron en que la nueva tecnología propuesta (generalmente, de alto costo) no demostraron tener un beneficio comparable o superior al tratamiento ya disponible en EsSalud a pesar de su mayor costo, o no demostraron ser mejor que el placebo en aquellas condiciones clínicas en que al momento no se tenía tratamiento disponible en EsSalud. Así, el escenario en que la nueva tecnología representaba una alternativa razonable a la alternativa que constituía el statu quo en EsSalud, no era el más frecuente y de hecho, cuando la nueva alternativa propuesta resultaba con evidencia que proporcionaba un mayor beneficio clínico que el statu quo, ésta se aprobó en todos los casos, independientemente de su costo.
Por otra parte, la utilidad de las EE se da en escenarios donde son posibles las negociaciones con la industria farmacéutica para llegar a acuerdos financieros o de riesgo compartido en base al beneficio incremental que ofrezca la tecnología innovadora en relación a un umbral de costo-efectividad (27,28). Sin embargo, al no existir un marco normativo nacional para lograr estas negociaciones, las EE no fueron parte fundamental del proceso de toma de decisiones en EsSalud. Solo recientemente (año 2022), con la publicación del umbral de costo-efectividad peruano y el reglamento de la Ley del Cáncer donde se incluye el marco normativo para ejecutar acuerdos de riesgo compartido con la industria farmacéutica en relación a productos oncológicos, el MINSA acaba de establecer el marco normativo para el desarrollo de estos acuerdos los que deberán implementarse a futuro en caso se trate de TS oncológicas (29,30).
Resultados
La introducción de la ETS para la toma de decisiones informadas en la Seguridad Social Peruana repercutió en diferentes aspectos del proceso de evaluación y aprobación de tecnologías sanitarias innovadoras, que se describen a continuación:
El cambio de los procedimientos para la aprobación de uso de nuevas TS disminuyó los tiempos de espera en las respuestas, ahora, las solicitudes de cada paciente individual se evalúan y autorizan o no en los establecimientos de salud de la Red de EsSalud, en base a los dictámenes publicados por IETSI y las condiciones de uso establecidas en cada uno de ellos. Así, el tiempo de respuesta que en promedio era de 180 días por paciente, ahora es de 15 días por paciente. Por otro lado, el tiempo promedio de elaboración de un dictamen IETSI es de 60 días calendario, el que se elabora por única vez para todo EsSalud.
Desde la creación del IETSI hasta el año 2021 se han publicado:
407 entre dictámenes de evaluación de productos farmacéuticos y dispositivos médicos, de los cuales 161 aprobaron el uso de estas tecnologías.
30 dictámenes metodológicos, cuyo objetivo es confirmar la correlación que existe entre desenlaces subrrogados y desenlaces primarios en diferentes condiciones clínicas, información de utilidad para el análisis crítico de evidencia científica incluida en el desarrollo de dictámenes de evaluación de productos farmacéuticos y dispositivos médicos.
24 dictámenes de recomendación, los que evalúan tecnologías sanitarias relacionadas a programas de salud de atención primaria, cuyos resultados se compartieron con las áreas de EsSalud encargadas de estos programas a manera de sugerencias o recomendaciones basadas en evidencia científica.
Finalmente, durante los años 2020 y 2021 el IETSI emitió 71 ETS sobre TS para la prevención, diagnóstico, tratamiento o rehabilitación de la COVID-19, las que fueron publicadas bajo el título de “reportes breves de evaluación de evidencia científica COVID-19” (ver Figura 2). Todas estas evaluaciones están publicadas en la página web del IETSI en la sección de evaluación de tecnologías sanitarias y puestas a disposición con libre acceso a la comunidad médica, las asociaciones de pacientes, otras entidades públicas peruanas, como la Superintendencia Nacional de Salud (SUSALUD), Defensoría del Pueblo y Poder Judicial.
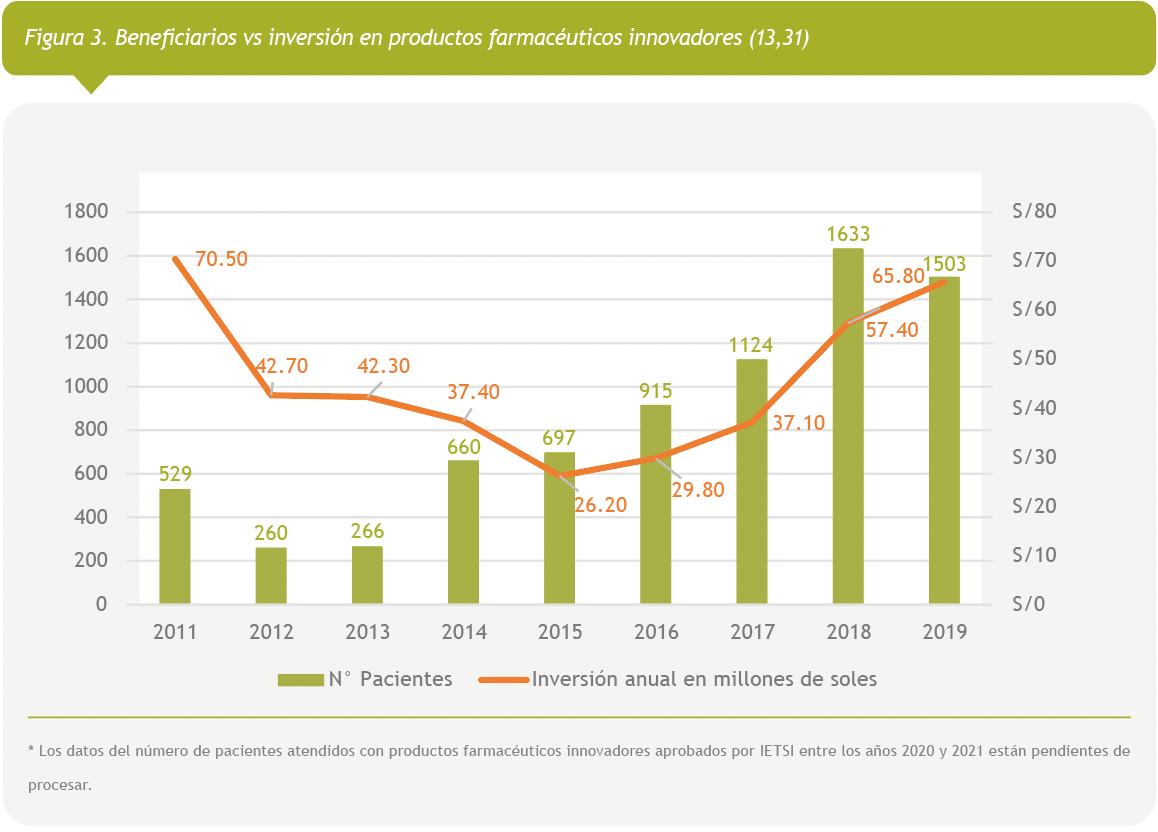
La relación entre la inversión en productos farmacéuticos innovadores y la inversión total de productos farmacéuticos se mantiene en un promedio de 5% anual entre el año 2015 y 2019, versus que entre los años 2011 al 2014 esta relación fue del 8% anual. Además, la razón entre la inversión en productos innovadores y el número de pacientes atendidos con estas tecnologías es cada vez menor, en el año 2011 esta razón fue de s/133,270 por paciente y en el año 2019 fue de s/47,779 por paciente. Esto denota un incremento de pacientes que acceden a tecnologías innovadoras sin afectar la sostenibilidad financiera (ver Figura 3).
Hasta el año 2021, fueron 246 las ETS que concluyeron en un perfil de seguridad y eficacia desfavorable con respecto al comparador que constituía el statu quo en EsSalud y que desembocaron en un dictamen que no aprobó la TS evaluada para la condición clínica de interés. Las principales razones de no aprobación de una TS, que están descritas en los documentos de ETS, son:
Porque la nueva TS no ofrece mayor eficacia ni seguridad que la tecnología disponible en la institución. Un ejemplo de esto es el caso del medicamento afatinib, el cual ofrecía un perfil de seguridad y eficacia comparable con el medicamento erlotinib para el tratamiento en primera línea en cáncer de pulmón de células no pequeñas y mutación en el dominio del gen de recepción de crecimiento epidérmico (EGFR). En este escenario, se realizó un análisis de costo minimización que contribuyó a la decisión de aprobar erlotinib, siendo que éste además de ofrecer un similar beneficio clínico tenía un menor costo. Esta decisión se constituyó entonces en un ahorro para el sistema de EsSalud (en aproximadamente S/ 630,000.00 anuales, ya que ésta sería la cantidad adicional que hubiese costado adquirir afatinib en los 25 pacientes por año que actualmente se benefician de erlotinib) (32).
Porque no existe diferencia con el placebo en desenlaces clínicos relevantes para el paciente. Por ejemplo, el medicamento ataluren no demostró ser mejor al placebo para el tratamiento de pacientes con el diagnóstico de distrofia muscular de Duchenne portadores de una mutación sin sentido en el gen de la distrofina; en concreto no demostró mejorar la calidad de vida, mejorar la distancia caminada a los 6 minutos, disminuir los tiempos para realizar tareas motoras como subir o bajar escalones, correr o caminar 10 metros y levantarse desde la posición supina. Su potencial cobertura hubiese significado una inversión de S/1,050,575.40 para la atención de 6 pacientes que presentan este diagnóstico en EsSalud, inversión que no se hubiera visto reflejada en una mejoría sustancial de la condición clínica de estos pacientes a juzgar por los resultados del ensayo clínico pivotal.
Porque el perfil de seguridad de la nueva tecnología es peor que el placebo. Un ejemplo de ello es la no aprobación del medicamento sorafenib para el tratamiento del cáncer de tiroides diferenciado, metastásico, irresecable y refractario a tratamiento con yodo radioactivo, pues, su uso presentaba un perfil de seguridad desfavorable en relación al placebo, ya que se había estimado que generaba un riesgo de muerte 2.76 veces mayor que el placebo (33). Su no aprobación no solo pudo haber significado evitar posibles eventos adversos serios y muertes a causa del medicamento, sino que evitó además el gasto innecesario de S/ 239,700.00 soles anuales por paciente (en el año 2015 se presentó un solo caso con esta condición clínica).
Las ETS publicadas por el IETSI tienen alcance nacional e internacional, pues son publicadas con acceso libre en la página web del IETSI, se encuentran disponibles en la Base de Datos internacionales como la base Regional de Informes de Evaluación de Tecnologías Sanitarias de las Américas (BRISA) de la Organización Panamericana de la Salud, en el buscador de literatura global sobre la enfermedad por coronavirus (COVID-19) de la Organización Mundial de la salud (34) y en el portal regional del Biblioteca Virtual en Salud de la Organización Panamericana de la Salud (35). De esta forma, se constituyen en documentos de referencia para otras instituciones del país y del mundo.
A nivel internacional, la Organización para la Cooperación y el Desarrollo Económicos (OECD) en su informe sobre la sostenibilidad y eficiencia del fondo del sistema sanitario del gobierno peruano resalta la iniciativa del IETSI-EsSalud por institucionalizar el uso de las ETS y manifiesta la necesidad de la institucionalización de la ETS en todas las IAFAS a nivel nacional, con el objetivo que la toma de decisión de financiamiento de tecnologías sanitarias sea la misma en todos los segmentos del sector salud peruano y se base en el mismo cuerpo de evidencia científica (36).
A nivel nacional, el Petitorio Nacional Único de Medicamentos Esenciales, aprobado en el año 2018 por el MINSA, consideró la inclusión de cinco (05) productos farmacéuticos innovadores en su listado a partir de los resultados de las ETS del IETSI (azacitidina, bortezomib, erlotinib, sunitinib y buprenorfina) (37). Así, estas tecnologías se encuentran disponibles para el beneficio de cualquier paciente que lo requiera en el territorio nacional.
Las entidades nacionales que atienden quejas o consultas de asegurados como la Defensoría del Pueblo, la Superintendencia Nacional de Salud, el Poder Judicial peruano toman en cuenta las publicaciones del IETSI para emitir sus pronunciamientos o sentencias (38).
Dada la incorporación de las ETS para la toma de decisiones en salud en el contexto de EsSalud, el IETSI ha sido admitido en redes de agencias evaluadoras internacionales como la Red Andina de Evaluación de Tecnologías Sanitarias (RAETS) y la Red de evaluación de tecnologías en salud de las Américas (RedETSA) en el año 2015 (39), la Red internacional de agencias de evaluación de tecnologías sanitarias (INAHTA por sus siglas en inglés) en el año 2019 (40) y, a nivel nacional conforma la Red Nacional de Evaluación de Tecnologías Sanitarias (RENETSA) creada en el año 2020 (41).
En el año 2018, EsSalud fue galardonado con el “Premio de buenas prácticas en gestión pública”, por implementar la ETS para la toma de decisiones en salud. Este premio es una competencia anual que tiene el objetivo de identificar, premiar y dar a conocer buenas prácticas en la administración pública con las que se haya obtenido resultados destacados para la ciudadanía y que puedan ser replicados en otras organizaciones del sector público peruano (42).
Conclusiones
La incorporación de la ETS en la toma de decisiones en EsSalud ha contribuido a expandir la cobertura de TS innovadoras, logrando que más pacientes se beneficien de tratamientos más eficaces y/o seguros de una manera ordenada, equitativa y sin imponer desafíos excesivos en los presupuestos institucionales. Asimismo, este proceso en base a ETS ha evitado la inversión de recursos en TS que no ofrecían algún beneficio clínico relevante para el paciente o que significaban un potencial mayor riesgo de daño que el statu quo en EsSalud, siguiendo los principios del uso racional de tecnologías sanitarias y transparencia en la toma de decisiones. Así, además de lograr ofrecer mejores servicios de salud a los asegurados de EsSalud, este proceso basado en ETS contribuye a cuidar la sostenibilidad financiera de la institución, lo cual es crucial, especialmente en circunstancias de inestabilidad económica como las que atraviesa actualmente el mundo en su travesía por la pandemia por Covid-19. Aunque el sistema de toma de decisiones basado en ETS en el Perú aún es joven y muchas mejoras vienen siendo propuestas y algunas implementándose aún, el IETSI representa una experiencia con resultados que juzgamos exitosos, que puede ser de utilidad para otras instituciones públicas de salud que requieran implementar un proceso sistemático, transparente y basado en evidencia científica para la toma de decisiones en salud.
Referencias Bibliográficas
1.International Network of Agencies for Health Technology Assessment, Health Tecnnology Assessment International, et al. Health technology [Internet]. HtaGlossary.net. [citado 24 de mayo de 2022]. Disponible en: http://htaglossary.net/health-technology
2. Angelis A, Kanavos P. Multiple Criteria Decision Analysis (MCDA) for evaluating new medicines in Health Technology Assessment and beyond: The Advance Value Framework. Soc Sci Med. septiembre de 2017;188:137-56.
3. 67.a Asamblea mundial de la salud. WHA 67.23 «Evaluación de las intervenciones y las tecnologías sanitarias en apoyo de la cobertura sanitaria universal» [Internet]. Ginebra: OMS; 2014 [citado 24 de abril de 2022]. Disponible en: https://apps.who.int/iris/handle/10665/170763
4. Organisation for Economic Co-operation and Development. Health Technologies and Decision Making [Internet]. The OECD Health Project, OECD Publishing, Paris; 2005. Disponible en: https://doi.org/10.1787/9789264016224-en
5. Organisation for Economic Co-operation and Development. Acerca de la OCDE [Internet]. [citado 24 de mayo de 2022]. Disponible en: https://www.oecd.org/acerca/
6. The International Network of Agencies for Health Technology Assessment [Internet]. INAHTA. [citado 23 de abril de 2022]. Disponible en: https://www.inahta.org/
7. Seguro Social de Salud. Estadística Institucional EsSalud [Internet]. [citado 15 de mayo de 2022]. Disponible en: http://www.essalud.gob.pe/estadistica-institucional/
8. Ley de creación del Seguro Social de Salud (EsSalud). Ley N° 27056. Diario Oficial el Peruano. 1999.
9. Reglamento de la Ley de Modernización de la Seguridad Social en Salud. Decreto Supremo No 009-97-SA. Diario Oficial el Peruano. 1997.
10. Seguro Social de Salud. Principales indicadores de salud y series estadísticas 2005- 2019 [Internet]. Power point presentado en; 2019 [citado 15 de mayo de 2022]. Disponible en: bit.ly/3Qo14fe
11. Dirección General de Medicamentos Insumos y Drogas. Situación de los productos oncológicos de mayor impacto económico en el sistema de salud. DIGEMID; 2015.
12. Seguro Social de Salud. Petitorio Farmacológico de EsSalud. Resolución de Gerencia General N° 944-GG-ESSALUD-2011. jun 17, 2011.
13. Seguro Social de Salud. Reporte de Consumo de productos farmacéuticos del 2010- 2021. 2021.
14. Seguro Social de Salud. Normas para el uso de medicamentos no incluidos en el Petitorio Farmacológico. Resolución de Gerencia General N° 469-GG-ESSALUD- 2012. 2012.
15. Seguro Social de Salud. Reglamento de Organización y Funciones del Seguro Social de Salud. Resolución de Presidencia Ejecutiva N° 656-PE-ESSALUD-2014.; 2014.
16. Gutierrez EL, Piazza M, Gutierrez-Aguado A, Hijar G, Carmona G, Caballero P, et al. Uso de la evidencia en políticas y programas de salud aportes del Instituto Nacional de Salud. Rev Peru Med Exp Salud Publica. julio de 2016;33(3):580-4.
17. Canada´s Drug and Health Technology Agency. About the Health Technology Assessment Service [Internet]. CADTH. [citado 14 de agosto de 2022]. Disponible en: https://www.cadth.ca/
18. National Institute for Health and Care Excellence. Guide to the processes of technology appraisal. NICE; 2014.
19. Seguro Social de Salud. Reglamento de organización y funciones del Instituto de Evaluación de Tecnologías en Salud e Investigación. Resolución de Presidencia Ejecutiva N° 152-PE-ESSALUD-2015; 2015.
20. Seguro Social de Salud. Normativa de uso del Petitorio Farmacológico de EsSalud. Directiva N° 001-IETSI-ESSALUD-2015. IETSI; 2015.
21. Seguro Social de Salud. Normativa para la autorización y uso de productos farmacéuticos no incluidos en el Petitorio Farmacológico de EsSalud. Directiva N° 003-IETSI-ESSALUD-2016. IETSI; 2016.
22. Seguro Social de Salud. Directiva que regula los Petitorios de Dispositivos Médicos, Equipos Biomédicos y Otras Tecnologías relacionadas de EsSalud. Directiva 001- IETSI-2018. IETSI; 2018.
23. Seguro Social de Salud. Normativa para el uso de productos farmacéuticos no incluidos en el Petitorio Farmacológico de EsSalud. Directiva N° 002-IETSI-ESSALUD-2015 (no vigente). IETSI; 2015.
24. Ley de los productos farmacéuticos, dispositivos médicos y productos sanitarios.Ley N° 29459. Diario Oficial el Peruano. 2009.
25. Ministerio de Salud. Norma técnica de salud para la utilización de medicamentos no considerados en el petitorio nacional único de medicamentos esenciales. NTS N° 091- MINSA/DIGEMID-V.01. Resolución Ministerial N° 540-2011/MINSA; 2011.
26. Evaluación de Tecnologías Sanitarias [Internet]. IETSI. 2021 [citado 14 de agosto de 2022]. Disponible en: https://IETSI.essalud.gob.pe/evaluacion-tecnologicas-sanitarias/
27. Zárate V. Evaluaciones económicas en salud: Conceptos básicos y clasificación. Rev Médica Chile. 2010;138(2):93-7.
28. Collado CG. Acuerdos de riesgo compartido con fármacos de alto impacto en el ámbito sanitario. Evaluación económica y resultados en salud [tesis doctoral]. Universidad de Granada; 2021.
29. Ministerio de Salud. Establecen el umbral de costo – efectividad de las evaluaciones de tecnologías sanitarias realizadas por la Dirección General de Medicamentos, Insumos y Drogas y por el Instituto Nacional de Salud. Resolución Ministerial N° 159-2022/MINSA. 2022.
30. Reglamento de la Ley N° 31336, Ley Nacional del Cáncer. Decreto Supremo No 004- 2022-SA. Diario Oficial el Peruano. 2022.
31. Seguro Social de Salud. Reporte de habilitaciones de códigos SAP de productos farmacéuticos no incluidos en el Petitorio Farmacológico de EsSalud para pacientes individuales. 2021.
32. Instituto de Evaluación de Tecnologías en Salud e Investigación. Seguridad y eficacia de afatinib en comparación con quimioterapia estándar o erlotinib como tratamiento de primera línea en cáncer de pulmón de células no pequeñas y mutación en el dominio del gen del receptor de crecimiento epidérmico (EGFR). Dictamen preliminar de evaluación de tecnología sanitaria N° 002-SDEPFyOTS-DETS-IETSI- 2015. EsSalud; 2015.
33. Instituto de Evaluación de Tecnologías en Salud e Investigación. Eficacia y seguridad de sorafenib en el tratamiento de pacientes con diagnóstico de carcinoma de tiroides diferenciado, metatásico, irresecable, refractario a tratamiento con yodo radioactivo. Dictamen preliminar de evaluación de tecnología sanitaria N° 056-SDEPFyOTS-DETS-IETSI-2016. EsSalud; 2016.
34. Organización Mundial de la Salud. Literatura global sobre la enfermedad por coronavirus [Internet]. [citado 24 de abril de 2022]. Disponible en: https://search.bvsalud.org/global-literature-on-novel-coronavirus-2019-ncov/
35. Organización Panamericana de la Salud. Portal Regional de la BVS [Internet]. [citado 24 de abril de 2022]. Disponible en: https://pesquisa.bvsalud.org/
36. Organisation for Economic Co-operation and Development. Chapter 3: Sustainability and efficiency of Peru´s government-funded health system. 2017.
37. Ministerio de Salud. Documento técnico: Petitorio nacional único de medicamentos esenciales para el sector salud. Resolución Ministerial N° 1361-2018/MINSA; 2018.
38. Tribunal Constitucional, República del Perú. Pleno. Sentencia 776/2021. 2021.
39. Red de Evaluación de Tecnologías en Salud de las Américas. Miembros [Internet]. [citado 24 de abril de 2022]. Disponible en: https://redetsa.bvsalud.org/conozca/miembros/
40. The International Network of Agencies for Health Technology Assessment. INAHTA welcomes IETSI, Peru, as a full member! [Internet]. INAHTA. 2019 [citado 24 de abril de 2022]. Disponible en: https://www.inahta.org/
41. Ministerio de Salud. Conforman la Red Nacional de Evaluación de Tecnologías Sanitarias (RENETSA) y aprueban otras disposiciones. Resolución Ministerial No 190-2020-MINSA. 2020.
42. Seguro Social de Salud. EsSalud reconoce a IETSI por Premio a las Buenas Prácticas en Gestión Pública [Internet]. 2018 [citado 24 de abril de 2022]. Disponible en: http://www.essalud.gob.pe/category/noticias/











