Importancia de la Relevancia Médica en ISO 15189:2003
Arturo M. Terrés-Speziale*
- Director de JAR Quality SA de CV. Representante de WASPaLM ante la OPS. Coeditor de la Revista Mexicana de Patología Clínica
Correspondencia:
Dr. Arturo M. Terrés Speziale
www.qualitat.com.mx
aterres@qualitat.com
Fuente: Rev Mex Patol Clin, Vol. 54, Núm. 2, pp 59-71 Abril – Junio, 2007
Resumen
Antecedentes. La Norma ISO 15189: 2003 fue desarrollada con la meta de establecer requisitos para acreditar el Sistema de Gestión de Calidad y la Competencia Técnica de los Laboratorios Clínicos, abarcando desde la etapa pre hasta la pos-examen. Desde el punto de vista médico, lo más sobresaliente de la nueva norma es la necesidad de que los laboratorios generen resultados que sean médicamente relevantes, por lo que es recomendable que los profesionales del laboratorio, además de vigilar la confiabilidad de los estudios, nos involucremos más en la adecuada utilización e indicación de las pruebas y en la correcta interpretación y utilización de los resultados. Objetivo: Revisar la Norma ISO 15189: 2003 para documentar el concepto de relevancia médica y los puntos que de ello derivan, tanto desde el punto de vista humano como el de la dimensión tecnológica. Material y métodos: Se trata de un artículo de revisión en el que, desde la perspectiva de la nueva norma, se evalúa el proceso analítico en sus tres etapas y se presentan definiciones, fórmulas y ejemplos prácticos sobre los indicadores bio-estadísticos de relevancia médica que pueden ser aplicados en los programas internos y externos de control de calidad. Resultados: La utilidad básica de las pr u eba s del laboratorio depende fundamentalmente de su relevancia médica, la cual puede ser evaluada en forma objetiva tanto en los programas internos como en los esquemas externos de control de calidad analítico. Discusión: La relevancia médica depende, en principio, de la decisión de utilizar el laboratorio clínico, de qué prueba se va a realizar, quién la indica, por qué y para qué se lleva a cabo, quién y dónde se efectúa, quién la controla y, sobre todo, qué se hace con los resultados. Cuando las pruebas se llevan a cabo en condiciones adecuadas, en un laboratorio con programas establecidos de control donde se aplican indicadores de calidad, resulta factible evaluar la relevancia de los resultados a través de la medición simultánea de la variabilidad biológica y de la variabilidad analítica, conforme a lo descrito en este trabajo.
Abstract
Background: ISO 15189: 2003 was developed in order to establish requirements for the Accreditation of Clinical Laboratory Quality Management System and Technical Competition, including standards from the pre to post examination stages. From the medical point of view the most important issue of the new norm, is the need to generate medically relevant results, making necessary for the laboratory professionals to watch for the reliability of the studies, and to become more involved on the suitable indication and utilization of the tests, and to be aware on the correct interpretation and better use of the results. Objective: To review ISO 15189:2003 and to document the medical relevance concept and the issues that may derive from the human perspective and from the technological dimension. Material and methods: This is a revision article on which the analytical process in its three stages is evaluated. Practical definitions, formulas and examples are presented as indicators of medical relevance that can be applied on the internal and external quality control pro-grams. Results: The basic utility of the tests of the laboratory depends fundamentally on their medical relevance, which can as be evaluated on an objective form in the internal quality programs and in the external proficiency schemes. Discussion: Medical relevance depends from the start on the decisión to use the clinical laboratory tests, depending on what test is to be performed, who indicates it, why and what for is carried out, who process it and where is developed, who controls it and finally what is done with the results. When the tests are carried out under suitable conditions, in a laboratory with well established quality control programs in which objective indicators are applied, it turns out feasible to evaluate the relevance of the results through the simultaneous measurement of the biological variability and analytical variability according to the described method on this communication.
Key words: Accreditation, ISO 15189, medical relevance, total variability, biological variability, analytical variability.
Introducción
El proceso de acreditación del laboratorio clínico es una intervención externa que se lleva a cabo por y entre profesionales de laboratorio con el fin de demostrar competencia técnica y capacidad de proporcionar un servicio de alta calidad.1
Para lograr esto, es necesario que el laboratorio demuestre con evidencia sólida y bien documentada la existencia de:
- Un Manual de Calidad en el que se describa en detalle la existencia de un Sistema de Gestión y Política de Calidad, además de la estructura, los procesos y los resultados esperados, incluyendo la descripción de un Programa de Control Interno y un Esquema de Evaluación Externa que cumplan los estándares y requisitos de Normas Nacionales o Internacionales establecidas.2-4
- Una serie de evaluaciones expertas calificadas por y entre pares, las cuales deben ser planeadas, organizadas, supervisadas y controladas a manera de auditorías internas y externas por una organización de acreditación establecida y reconocida dentro y fuera del país. Las diferencias fundamentales entre una Certificación ISO 9000 y una Acreditación ISO 15189 consisten fundamentalmente en que la primera se basa en demostrar la documentación e implantación de un Sistema de Gestión de Calidad que puede ser llevada a cabo en cualquier tipo de empresa de productos o servicios por cualquier tipo de profesionales, incluyendo legos en la materia, mientras que en la segunda, es decir, la Acreditación 15189, además de demostrar el alcance y objetivo de la ISO 9000, se debe demostrar ante auténticos Profesionales de Laboratorio la Competencia Técnica que es la capacidad de generar resultados confiables, oportunos y médicamente relevantes.
Es de vital interés para los pacientes, la sociedad y los gobiernos que los laboratorios clínicos funcionen con el mayor nivel de capacidad profesional y técnica posible, debido a que tanto el diagnóstico, el pronóstico y el tratamiento se basan con frecuencia en los resultados, y una mala interpretación de las pruebas de laboratorio puede causar daño irreversible a un paciente.5
La Norma ISO 15189: 2003, que se enfoca al Manejo de Calidad en el Laboratorio Clínico, fue desarrollada por el Comité ISO/TC: 212 con la intención de acreditar el Sistema de Gestión de Calidad y la Competencia Técnica de los Laboratorios Clínicos (Cuadro I). Para generar resultados médicamente relevantes, en esta norma se destaca que es muy importante que los profesionales del laboratorio clínico nos involucremos más en los procesos de atención médica, incluyendo por supuesto la indicación de pruebas y la correcta interpretación de resultados en los que, se supone, los profesionales del laboratorio deberíamos ser expertos.
Ver CUADRO I en las imágenes de la derecha.
La Norma ISO 15189: 2003 entró en vigor para la evaluación y acreditación de los laboratorios clínicos de todo el orbe para demostrar que las actividades de prueba son sistematizadas y confiables, con resultados rastreables y defendibles. La norma internacional tiene validez y es de cobertura mundial, abarca todo el proceso analítico, desde la etapa pre hasta la pos-examen, dando importancia a la bioética y a las medidas de seguridad e higiene, sin dejar de lado la evaluación de la variabilidad biológica y analítica, además de la trazabilidad, la validación y la medición de la incertidumbre de los resultados. En la nueva norma se indica que los servicios del laboratorio clínico, además de incluir la evaluación de los pacientes en la consulta médica, debe fomentar la participación activa en la prevención de enfermedades y en el diagnóstico y manejo de los pacientes.
Finalmente, se enfatiza que cada servicio debe proporcionar educación adecuada y oportunidades científicas para el personal de niveles profesional y técnico.
De acuerdo al diccionario de la lengua española, la palabra relevante es sinónimo de excelente, sobresaliente, importante o significativo.
Para que una prueba de laboratorio sea relevante, debe ser útil en el establecimiento de un diagnóstico, pronóstico o tratamiento, por lo que es indispensable que la prueba esté bien justificada, seleccionada, indicada, solicitada y procesada desde la toma de la muestra hasta el informe de resultado y, finalmente, bien interpretada por el médico, el cual debe interactuar con el laboratorio clínico cuando se requiera.
Los pacientes están cada vez mejor informados de los asuntos relacionados con el cuidado de su salud, por lo que desean participar en las decisiones que la pueden afectar. Todos debemos reconocer que la mayor responsabilidad del médico y del laboratorio clínico es el paciente.
La adherencia a los estándares de calidad, incluyendo la puntualidad en la entrega de los resultados de la prueba, la exactitud y la precisión del laboratorio, la capacitación y el entrenamiento del personal, así como la prevención de errores, son responsabilidad ética de todo el personal del laboratorio clínico.
En la inspección y acreditación de laboratorios clínicos también se debe asegurar que los dueños, los encargados y el personal cumplan con estándares éticos, como por ejemplo:
- Mantener en secreto la información del paciente.
- Cumplir con los estándares técnicos y profesionales sin importar las presiones de costo.
- Evitar conflictos de interés de tipo personal, incluyendo los mercantiles, económicos y financieros de la organización.
- No discriminar a ningún paciente o elemento del personal tanto por raza, género, posición política, creencia religiosa o circunstancias económicas.
Dentro de los capítulos más relacionados a la relevancia médica en ISO 15189: 2003 destacan:
4.1 Organización.
4.1.2 Los servicios del laboratorio clínico, incluyendo los de interpretación y los de consultoría, deben ser diseñados para que todo el personal satisfaga las necesidades de los pacientes de manera prioritaria.
4.7 Servicio al cliente.
4.7 El laboratorio debe definir y documentar el tipo de servicio que se habrá de ofrecer. Personal del laboratorio con capacitación adecuada debe proporcionar asesoría sobre la selección de los análisis y el uso de los servicios, el tipo de muestra que se requiere, incluyendo la frecuencia y motivos de repetición. Cuando se requiera, debe brindarse apoyo en la interpretación de los resultados de los exámenes.
El laboratorio debe documentar la realización de reuniones periódicas del personal del laboratorio con el personal clínico en forma regular con respecto al uso de los servicios y para el propósito de consulta sobre temas científicos. Los profesionales del laboratorio deben participar en sesiones clínicas, proporcionando asesoría sobre eficacia diagnóstica, tanto a nivel general como en casos particulares. Durante las auditorías de calidad se deben presentar registros de las reuniones entre el personal profesional del laboratorio y el personal clínico, según lo declarado con base en este punto.
5.1 Personal
5.1.12 El personal que hace juicios profesionales referentes a los exámenes debe tener el conocimiento teórico y práctico aplicable, así como experiencia actualizada. Los juicios profesionales se pueden expresar como opiniones, interpretaciones, predicciones, valores, simulaciones y modelos, y deben fundamentarse conforme a las regulaciones nacionales, regionales y locales. El personal tiene el deber de participar regularmente en actividades de desarrollo profesional o que contribuyan directa o indirectamente con su preparación.
5.1.13 La confidencialidad de la información relacionada con los pacientes debe ser mantenida por todo el personal en todo momento.
5.4 Procedimientos pre-examen.
5.4.1 El formato de solicitud debe contener información suficiente para identificar al paciente y al solicitante autorizado, además de proporcionar los datos clínicos pertinentes.
5.5 Procedimientos de examen.
5.5.4 Las especificaciones de ejecución para cada procedimiento utilizado en un examen deben estar relacionadas con el uso al que se destina el procedimiento.
5.5.5 Los intervalos biológicos de referencia deben ser revisados periódicamente. Si el laboratorio tiene razones para creer que un intervalo particular no es apropiado en toda su extensión para la población de referencia, entonces debe realizarse una investigación, seguida de una acción correctiva si fuera necesario. La revisión de los
intervalos biológicos de referencia también debe tener lugar cuando el laboratorio realiza cambios en el procedimiento de examen.
5.6 Aseguramiento de la calidad.
5.6.1 El laboratorio debe diseñar sistemas de control de la calidad internos que verifiquen que la calidad deseada de los resultados sea alcanzada. Es importante que el sistema de control provea a los miembros del personal con información clara y fácilmente entendible sobre la cual se basen las decisiones técnicas y médicas.7-9
5.6.2 El laboratorio debe determinar la incertidumbre de los resultados, cuando sea pertinente y posible. Los componentes de la incertidumbre, que sean de importancia, deben ser tomados en cuenta. Fuentes que contribuyen a la incertidumbre pueden incluir toma de la muestra, preparación de la muestra, selección de alícuota de la muestra, calibradores, materiales de referencia, cantidades de entrada, equipo utilizado, condiciones ambientales, condición de la muestra y cambios de operador.
5.6.3 Debe ser diseñado y realizado un programa de calibración de sistemas de medición y de verificación de la veracidad para asegurar que los resultados sean trazables al Sistema Internacional de Unidades (SIU) o por referencia a una constante natural u otra referencia indicada. Cuando esto no sea posible o pertinente, deben aplicarse otros medios para proporcionar confianza en los resultados, incluyendo, pero sin estar limitado, a lo siguiente:
- Participación en un programa adecuado de comparación inter-laboratorios.
- Uso de materiales de referencia adecuados, certificados para indicar la caracterización del material.
- Examen o calibración por otro procedimiento.
- Estándares o métodos de consenso que estén claramente establecidos, especificados, caracterizados y acordados por todas las partes involucradas.
- Documentación de las declaraciones relacionadas con los reactivos, procedimientos o sistemas de examen, cuando la trazabilidad sea proporcionada por el proveedor o fabricante.
5.6.4 El laboratorio debe participar en comparaciones inter-laboratorios, tales como las que se realizan bajo esquemas de evaluación externa de la calidad. La gerencia del laboratorio debe dar seguimiento a los resultados de los ensayos de aptitud y participar en la implementación de acciones correctivas cuando los criterios de control no se cumplen. Los programas de comparación inter-laboratorios deben estar en completo acuerdo con las Normas ISO/IEC 43-1 e ILAC G13:2000.2-4 Los esquemas de evaluación externa de la calidad deberán, tanto como sea posible, proporcionar retos clínicamente relevantes que imiten muestras de pacientes y que permitan la verificación de todo el proceso analítico, incluyendo los procedimientos pre y pos-examen relacionados a la indicación de pruebas e interpretación de resultados.
5.6.5 Cuando no esté disponible un programa formal de comparación inter-laboratorios, para una prueba en particular, el laboratorio debe desarrollar un mecanismo para determinar la aceptabilidad de los procedimientos que no sean evaluados de otra manera. Siempre que sea posible, este mecanismo debe utilizar materiales de origen externo que impliquen un reto al laboratorio, tales como el intercambio de muestras con otros laboratorios. La gerencia del laboratorio debe dar seguimiento a los resultados de este mecanismo de comparación inter-laboratorios y participar en la implementación y registro de acciones correctivas.
5.6.6 Para aquellos exámenes que se ejecuten empleando diferentes procedimientos o equipo en diferentes sitios, o todos estos, debe definirse un mecanismo para verificar que los resultados son comparables en todos los intervalos clínicamente apropiados. Tal verificación debe apegarse a periodos de tiempo definidos y apropiados a las características del procedimiento o instrumento.
5.6.7 El laboratorio debe documentar, registrar y, cuando sea apropiado, actuar en forma expedita sobre los resultados de estas comparaciones. Deben tomarse acciones sobre los problemas o deficiencias que se identifiquen y mantenerse los registros de las acciones aplicadas.
5.7 Procedimientos pos-examen.
5.7.1 El personal autorizado debe revisar sistemáticamente los resultados de los estudios, evaluarlos en conformidad con la información clínica referente al paciente y autorizar la liberación de los resultados. En el informe se debe llevar a cabo la interpretación de resultados, cuando se considere apropiado.
Se debe evaluar el significado médico de los exámenes no conformes y cuando sea apropiado informar al médico solicitante.
Evaluación de la relevancia médica
Para que una prueba de laboratorio sea relevante, debe ser útil en el establecimiento de un diagnóstico, pronóstico o tratamiento, 7 por lo que es indispensable que la prueba esté:
- Justificada. ¿Por qué y para qué se requiere del apoyo del laboratorio?
- Seleccionada ¿Quién eligió la prueba que se va a realizar?
- Indicada. ¿Por qué se eligió esta prueba y no otra?
- Solicitada. ¿Se generó una requisición escrita o la indicación es verbal?
- Tomada. ¿La muestra se obtuvo en ayuno, en reposo, etc.?
- Procesada. ¿Quién y cómo se hizo la prueba?
- Controlada. ¿Se hizo bajo un programa de control de calidad?
- Informada. ¿Se generó un informe escrito con límites de referencia?
- Interpretada. ¿Qué preparación tiene la persona que lee los resultados?
- Utilizada. ¿Qué decisiones se tomaron sobre la base de los estudios?
Un estudio de laboratorio es verdaderamente útil cuando influye en las decisiones médicas. Si el tratamiento del paciente no es afectado de modo alguno por los resultados, se puede cuestionar seriamente sobre la decisión de haber solicitado los estudios. Las tres resultantes lógicas de un estudio bien indicado, bien realizado y bien reportado son:
- Establecimiento de un diagnóstico o pronóstico.
- Indicación o modificación de un tratamiento.
- Ordenamiento de nuevas pruebas o procedimientos.
Suponiendo que hubiera un cumplimiento de los objetivos de cada etapa en 90% de los casos, la pérdida equivalente de 10% se acumularía, como se puede observar en la Figura 1. Resulta atractivo que cada laboratorio valide este ejercicio en su propio entorno, o que al menos cuantifique el porcentaje de estudios normales o negativos que produce diariamente en forma general, además de hacerlo en cada uno de sus departamentos.
Ver Figura 1 a la derecha de la nota.
De antemano se garantiza que la cifra será muy similar a la que se muestra en el resultado hipotético de la Figura 1.
Ahora bien, se debe reconocer que muchas pruebas de laboratorio son relevantes aún cuando sean normales o negativas. Un ejemplo clásico de esto es el caso de la citología exfoliativa que se realiza en el exudado cervicovaginal con el método de Papanicolaou, del que hoy día nadie duda de su gran utilidad, ni de su impacto en las Campañas de Detección Oportuna de Cáncer. En estas condiciones, serían justificables otros estudios que se podrían llevar a cabo anualmente en el individuo aparentemente sano, incluyendo:
- Biometría hemática completa con velocidad de sedimentación globular.
- Química de varios elementos, incluyendo glucosa, urea, creatinina, ácido úrico, perfil de lípidos, pruebas de funcionamiento hepático, calcio y hierro.
- Glucohemoglobina Hba1c, microalbuminuria, PCR alta sensibilidad.
- Examen general de orina.
- Coproparasitoscópico con detección de sangre oculta en heces.
- VDRL y anticuerpos anti HIV y anticuerpos antihepatitis C.
- Medición de niveles de plomo en sangre.
- En sexo femenino: Colposcopía y Papanicolaou.
- En sexo masculino: Niveles de antígeno prostático específico (PSA).
Pasando a la siguiente etapa, en la actualidad los laboratorios clínicos cuentan con varios proveedores de múltiples sistemas para la realización de pruebas diagnósticas, desde las más comunes hasta las más especializadas.
La diversidad de métodos disponibles tiene un impacto considerable en los resultados. Para satisfacer las necesidades de relevancia médica, se requiere que los resultados emitidos por los laboratorios sean comparables entre sí, independientemente de la marca del analizador, los métodos, el laboratorio, el hospital, el día de la semana y el personal que realizó la prueba.
Para establecer un diagnóstico es indispensable fijar un límite entre lo normal y lo patológico, lo cual debe fundamentarse en un enfoque científico y epidemiológico y no estar basado nada más en los datos de los insertos o de libros extranjeros.
El primer paso para controlar la relevancia es caracterizar cada prueba, utilizando un formato como el que presentamos en la Figura 2.
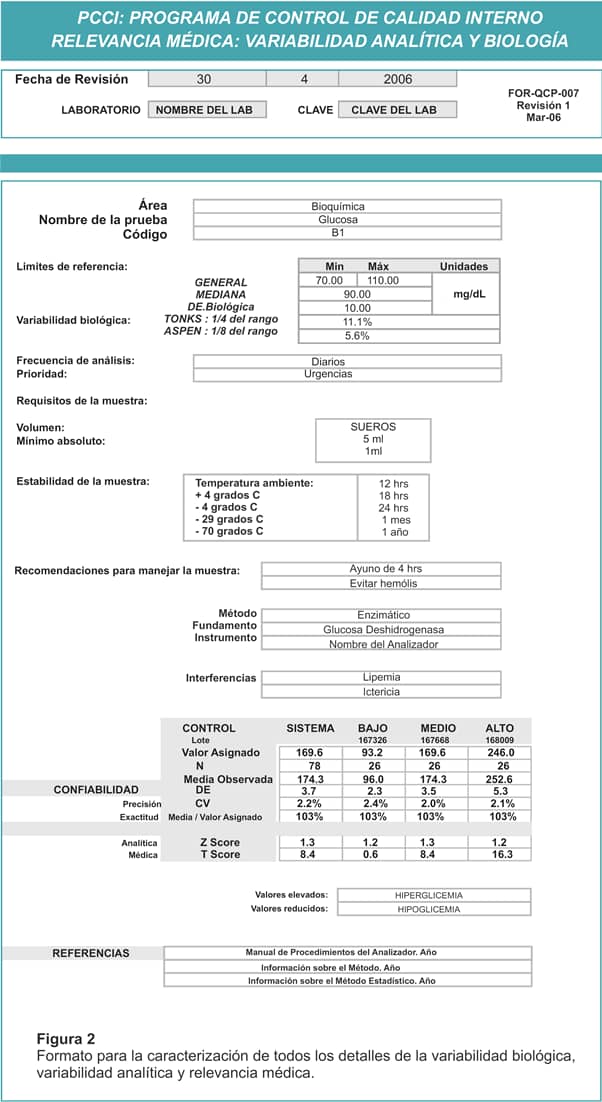
Una vez que se han documentado todas las variables de una prueba, el siguiente paso será comparar los resultados que se obtienen entre los diferentes equipos, utilizando controles con niveles altos, normales y bajos.
Ubicación de los resultados en la Curva de Gauss
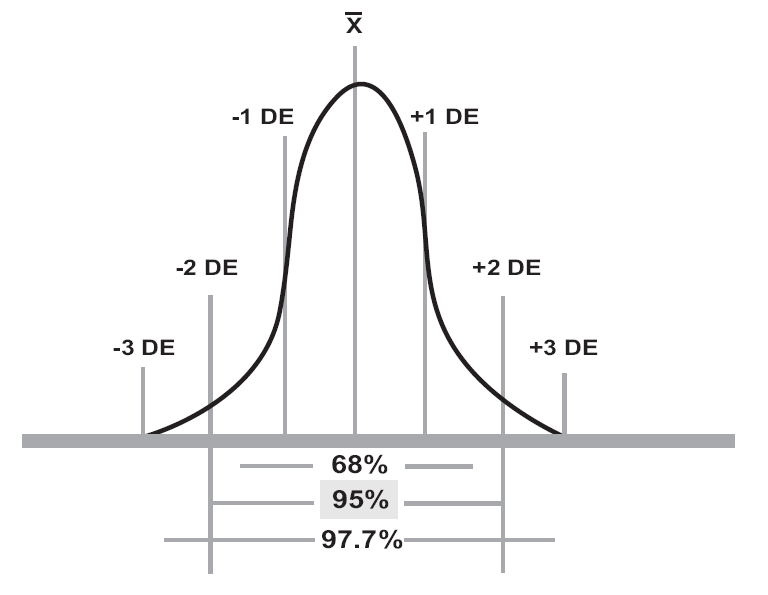
Conforme a la teoría de la estadística paramétrica, se consideran normales todos los datos que se encuentran dentro del rango de ±2 desviaciones estándar y que representan 95% de los resultados (Figura 3).
Calificación Z: Aplicación analítica
Esta prueba sirve para ubicar el resultado de un control analítico en la curva de Gauss que se obtiene a partir de la variabilidad analítica de una serie de controles. La fórmula para calcular el índice de desviación estándar analítico de una prueba, también denominado como «Z Score», es la siguiente:

La calificación Z es una prueba útil en control de calidad; de hecho, si se observa con cuidado, se comprenderá que esta prueba es la base sobre la que Westgard estableció sus famosas «Multirreglas de control» en los que los límites de referencia establecidos para cualquier prueba o analito será siempre ± 2DE.

Para calcular la desviación estándar biológica basta conocer los límites de referencia de una prueba en particular, a partir de los cuales se puede calcular la mediana, el rango y el cuartil que para fines prácticos es equivalente a una desviación estándar biológica (Cuadro II).

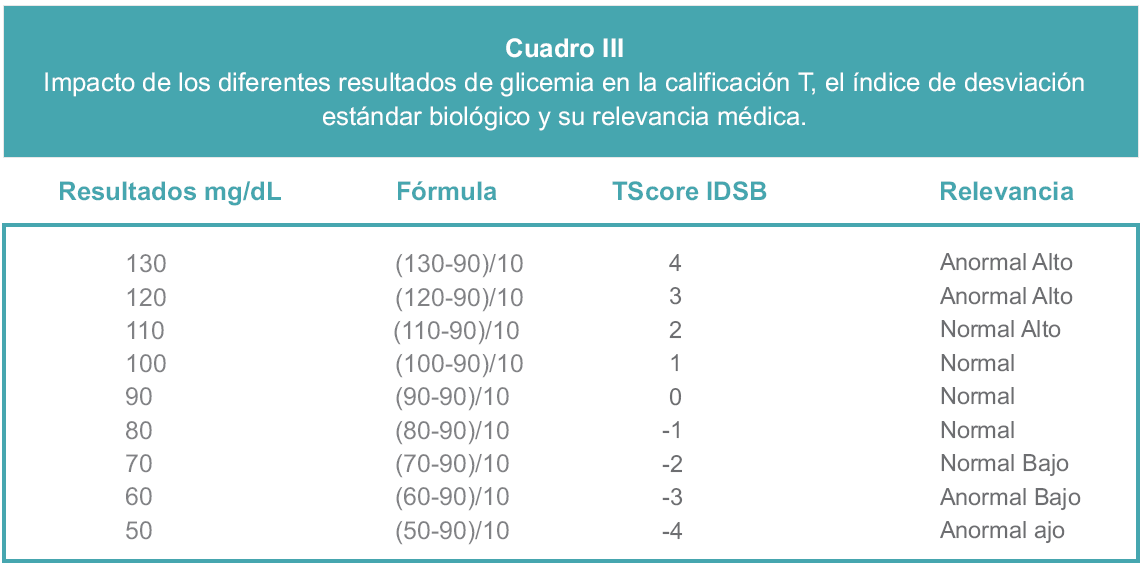
Ahora bien, supongamos que tenemos una serie de resultados de glucosa que van desde 50 hasta 250 mg/dL ¿Cuál sería la ubicación de cada uno de los siguientes resultados en la curva de Gauss con respecto a la mediana del rango normal? (Cuadro III).
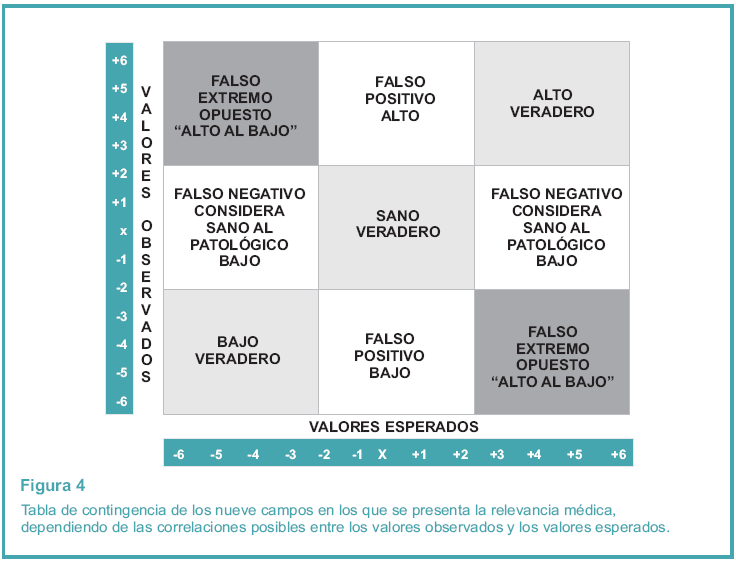
Al calcular los índices de desviación estándar biológico de los valores esperados y de los valores observados y ubicarlos en una tabla de contingencias de nueve campos se obtiene lo que se muestra en la Figura 4.
Como hemos visto, el cálculo del T Score es una herramienta práctica en variables continuas como la glucosa, colesterol, prolactina, triyodo-tironina, etc. Por lo que bien vale considerar su utilidad en pruebas inmunológicas, como son los marcadores tumorales, las pruebas para enfermedades infecciosas, etc. Tomemos el Perfil Torch (Cuadro IV) como ejemplo.
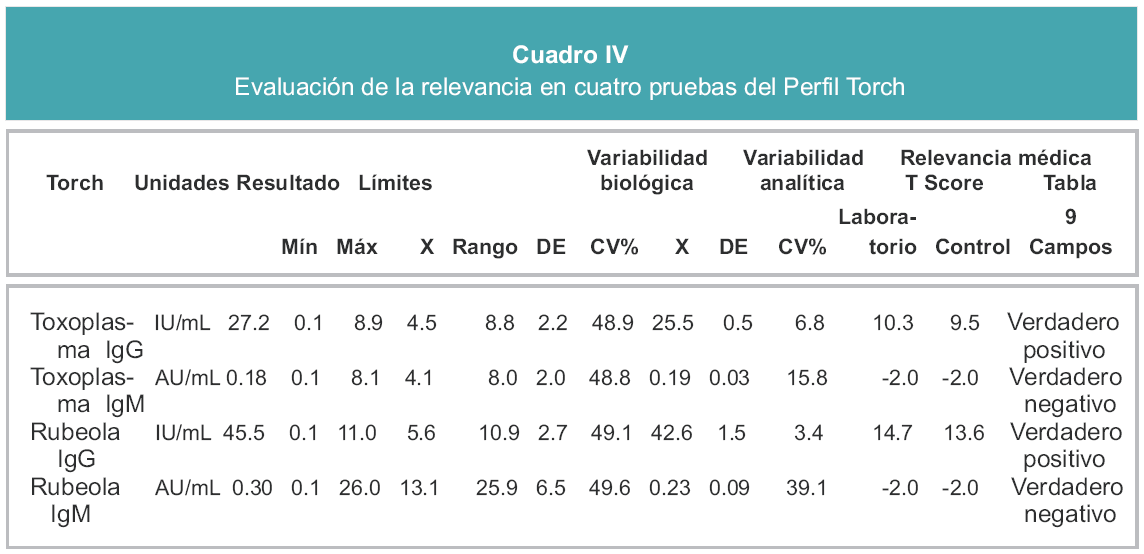
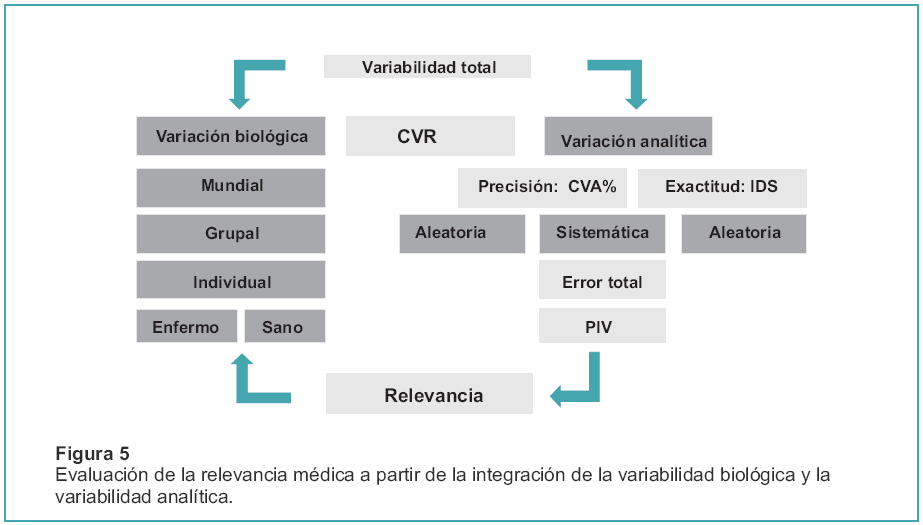
Como se puede observar, al aplicar la calificación T, es posible ubicar los resultados en la Curva de Gauss para que después se establezca un criterio diagnóstico preciso y confiable, conforme al cuadro de los 9 campos. Finalmente, de lo que se trata es de integrar toda la información que se obtiene a partir de la medición de la variabilidad biológica y de la variabilidad analítica, como se muestra en la Figura 5.
Además, para entrar en detalle, remitiremos al lector a publicaciones previas que sobre los mismos temas que hemos hecho en la Revista Mexicana de Patología Clínica. 6-9
Es importante reconocer que la Norma ISO 15189: 2003 establece claramente en el punto 5.1 que el personal que hace juicios profesionales referentes a los exámenes debe tener el conocimiento teórico y práctico aplicable, así como experiencia actualizada, y que todo el personal debe participar regularmente en actividades de desarrollo profesional y otras relacionadas, lo que en general es más fácil de llevar a cabo en los laboratorios general es más fácil de llevar a cabo en los laboratorios no se encuentre dentro de una institución hospitalaria no impide que los profesionales de laboratorio clínico se mantengan actualizados desde el punto de vista clínico en el ámbito de la indicación e interpretación de pruebas.
Los esquemas de evaluación externa de la calidad, además de ser una herramienta de control analítico, pueden ser organizaciones en las que el intercambio de opiniones, la asesoría, la asistencia técnica y la capacitación continua se lleven a cabo como parte del mismo programa, incluyendo la presentación, solución y discusión de casos clínicos en los que además se puede llevar a cabo la divulgación de artículos científicos sobre los mismos casos.
Discusión
Es probable que el avance más significativo de la Norma ISO 15189 sea precisamente el de la relevancia médica, el cual, de acuerdo a nuestra opinión, dignifica el trabajo de los Profesionales del Laboratorio Clínico, dejando atrás la idea de que los laboratorios tan sólo son fábricas de resultados en las que los trabajadores procesan muestras, manejan analizadores y aprietan botones con eficiencia para obtener resultados económicos, confiables y oportunos.
La medicina de laboratorio puede ser considerada como la más científica y tecnológica de las humanidades, al mismo tiempo que es la más humana de las ciencias y de las tecnologías.
No es aceptable que se quiera ver al laboratorio clínico como una fábrica ni como un negocio lucrativo en el que se subestime el bienestar del paciente. El Sistema de Gestión de Calidad y la Competencia Técnica de los Laboratorios Clínicos deben ser observados, analizados y comprendidos como estrategias para alcanzar la relevancia médica. Es de suma importancia que los profesionalesdel laboratorio clínico nos involucremos más en todo el proceso analítico, desde la indicación de pruebas hasta la interpretación de resultados, que abarquemos desde la etapa pre hasta el pos-examen, dando importancia a la bioética y a las medidas de seguridad e higiene, sin dejar de lado la evaluación de la variabilidad biológica y analítica, además de la trazabilidad, la validación y la medición de la incertidumbre de los resultados.
Para alcanzar la meta y los objetivos de la Normatividad Internacional es necesario que los Profesionales del Laboratorio Clínico tomemos una actitud más consciente, participativa y comprometida, no sólo en la búsqueda de la calidad en la operación de los Laboratorios Clínicos Mexicanos sino, sobre todo, en cuanto al manejo de sus políticas, organización, gestión de la calidad, regulación y control. Debemos eliminar prácticas cuestionables que anteponen intereses mercantiles, corrompen y vician el noble ejercicio de la medicina en general.
Referencias Bibliográficas
- NORMA ISO/IEC 15189:2003. Sistema de Gestión de Calidad para el Laboratorio Médico.
- NORMA ISO/IEC 43-2:1997. Prueba de Aptitud por Comparaciones entre Laboratorios – Parte 2: Selección y uso de los Esquemas. Evaluación Externa de la Calidad por los Cuerpos de la Acreditación del Laboratorio.
- NORMA ILAC-G13:2000. Requisitos para proveedores de ensayos de aptitud o esquemas de evaluación externa de la calidad.
- WASPaLM-IFCC. La Acreditación del Laboratorio. Declaración de Política. Rev Mex Patol Clin 2006; 53 (3): 174-177.
- Terrés SAM. Requisitos para proveedores de esquemas de evaluación externa de la calidad. Rev Mex Patol Clin 2006; 53(1): 3-15.
- Terrés SAM. Importancia de la variabilidad biológica y de la relevancia médica en ISO 15189. Rev Mex Patol Clin 2003; 50(3): 118-128.
- Terrés SAM. Estimación de la incertidumbre y de la variabilidad total en el laboratorio clínico. Rev Mex Patol Clin2006; 53 (4):185-196.
- Terrés SAM. Six Sigma: Determinación de metas analíticas con base en la variabilidad biológica y la evolución tecnológica. Rev Mex Patol Clin 2007; 54 (1): 28-39.





