Fisiopatología, diagnóstico y tratamiento de la enfermedad de Whipple
Marco Gudiño Gomezjurado(1), Alvaro Gudiño Gomezjurado(2)
(1)Universidad Federal de Lavras, Lavras, Brasil.
(2)Posgrado de Medicina Interna, Pontificia Universidad Católica del Ecuador, Puce, Ecuador; Hospital General Enrique Garcés,
Quito, Ecuador
E-mail: 584alvaro@gmail.com
Medwave 2011;11(08):e5112 doi: 10.5867/medwave.2011.08.5112
Introducción
La enfermedad de Whipple es una entidad infecciosa poco común descrita por primera vez en el año 1907 por George Hoyt Whipplei tras realizar la autopsia a un hombre de 36 años quien presentó tos crónica, artritis, fiebre, pérdida de peso y diarrea además de poliserositis, lesión de la válvula aórtica, y aumento del depósito de grasa intestinal evidenciadas mediante necropsia, siendo originalmente descrita como lipodistrofia intestinal (1,11). En 1952 se consideró el origen infeccioso de la enfermedad dada la buena respuesta frente al tratamiento con cloranfenicol, dato confirmado en el año 1961 tras la identificación de la bacteria en estudios por microscopía electrónica. En 1992 se logró secuenciar el genoma bacteriano de Tropheryma whippelii, nombre derivado de las palabras griegas trophe: alimentación, y eryma: barrera. En el año 2001 se aisló por primera vez la bacteria a partir de la válvula cardíaca infectada de un paciente con endocarditis cambiando su nombre a Tropheryma whipplei (1,11).
Epidemiología
Esta enfermedad se presenta en proporción de uno por cada cien mil habitantes y afecta a los hombres con una frecuencia ocho veces mayor que a las mujeres (10). Puede presentarse a cualquier edad pero es más común entre los 40 y 50 años de edad, y especialmente en descendientes de países europeos, siendo rara vez identificada en niños (1,11).
Descripción y ambiente de la bacteria
Tropheryma whipplei es una bacteria en forma de bastón que mide 2um de largo por 0,25 a 0,5um de diámetro, presenta estructura trilaminar, está constituida por péptidoglucano de tipo B. Pertenece al phylum Actinobacteria, y a la orden de los Actinomicetales, dentro del grupo de los Actinomicetes de la familia Cellulomonadaceae. Esta bacteria presenta tropismo positivo por las células mieloides, especialmente los macrófagos (5,19).
Es de crecimiento lento y puede identificarse después de 18 días de incubación. Su cromosoma tiene un peso aproximado de 1Mb, con 4 regiones altamente variables y con genes que codifican enzimas tales como la glutaredoxina, tioredoxina, y enzimas constituyentes del ciclo de Krebs. Tropheryma whipplei es un microorganismo simbiótrofo obligatorio, es decir que requiere establecer simbiosis con las células del huésped para conseguir su reproducción (1,5).
Es una bacteria ubícua. Es posible aislarla a partir del 5 al 15% de portadores sanos, especialmente personas que están en contacto con aguas servidas, identificados por biopsias de mucosa duodenal o a partir de muestras de heces. Sin embargo este porcentaje puede estar sobreestimado, ya que al realizar la amplificación del ADN bacteriano por PCR pueden ser reconocidas bacterias saprófitas como Actinomyces odontoliticus, Actinomyces turicensis u Ocapnocitofaga gingivalis (1,5,12).
Patogénesis e inmunología de la enfermedad
No se tiene conocimiento concreto acerca de cómo ingresa la bacteria al organismo, sin embargo se cree que es por vía fecal-oral. Es una bacteria intracelular, aunque también puede ser metabólicamente activa a nivel extraceluar (1).
Su principal blanco en el hospedador son los macrófagos intestinales localizados en la región subepitelial a nivel de la lámina propia, los cuales -a diferencia de otros macrófagos dispuestos en otras localizaciones del aparato digestivo- expresan los marcadores CD64+, CD68+, fosfatasa ácida, esterasa no específica, CD33+ que es una sialoadhesina derivada del ácido siálico además de no expresar el marcador CD14+, el cual actúa como receptor del lipopolisacárido de las bacterias Gram negativas, ni CD89+ que actúa como receptor para IgA1 e IgA2 en sus formas mono y poliméricas impidiendo la fagocitosis de microorganismos a expensas de IgA, situaciones que otorgan a estas células del intestino delgado cierta tolerancia inmunológica (28).
Una vez que la bacteria es internalizada dentro del macrófago, la replicación bacteriana intracelular tiene un patrón bifásico. En una primera fase el 80% de las bacterias son eliminadas dentro de las primeras 72 horas, posteriormente mantiene un crecimiento estable dentro de la célula por un período de 30 horas, para luego iniciar la segunda fase de crecimiento entre el sexto y décimo segundo día. Durante la transcripción sufre un proceso de glucosilación haciendo que ésta sea menos inmunogénica y no sea reconocida por el sistema inmune (5,8).
En el interior de la célula la bacteria impide la maduración del fagosoma al no permitir la liberación del contenido lítico (5). A nivel inmunológico produce alteración tanto en la inmunidad celular como humoral del hospedador. A nivel celular disminuye el contaje de linfocitos CD4+TH1 a consecuencia de los altos niveles de IL-4 además de disminuir los niveles de INF (alfa), así como la falta de expresión de CD11B, cofactor del receptor C3B del complemento indispensable para la fagocitosis (5).
La IL-12 necesaria para la activación de las células NK así como de la maduración de los linfocitos T disminuye, lo que impide la liberación de INF (gamma), que actúa como puente entre la inmunidad natural y la adquirida, permitiendo la lisis bacteriana (5). También se ha identificado que la quimiocina CCL18 aumenta, lo que induce la producción de IL-10 e IL-4 antagonizando con los receptores para IL-1 y para arginasa bloqueando la acción de la IL-12 e INF (gamma) permitiendo la proliferación de linfocitos TH2, los cuales provocan la disminución de la fagocitosis inhibiendo el procesamiento y presentación de los antígenos (5,39).
Otro aspecto de consideración es el papel que tiene la IL-6 expresada por los linfocitos T, mastocitos y células dendríticas, ya que esta interleucina, provoca la disminución de tioredoxina y glutaredoxina que son componentes esenciales para la maduración del macrófago induciendo la apoptosis por la activación de las caspasas 3, 6, 8 y 10 y la liberación de citocromo C de las mitocondrias celulares (5,9,38).
También se ha podido identificar que estas interleucinas interfieren en la maduración de las células dendríticas impidiendo que actúen como células presentadoras de antígeno y por ende activando a los linfocitos Th1 (1). Del mismo modo varios individuos con la enfermedad tienen susceptibilidad inmunológica ligada a los antígenos de superficie celular HLA B-27, HLA-DRB1*13 y DQB1*06, situación por la cual pocas personas llegan a desarrollar la dolencia (5).
A nivel de la inmunidad humoral, podría presentarse con niveles normales o paradójicamente aumentados de IgG, IgM e IgA, siendo más común esta situación en pacientes portadores de la bacteria más que en aquellos que llegan a desarrollar la enfermedad (5,28).
Manifestaciones clínicas
Forma clásica
En la forma clásica existen dos períodos de presentación. El pródromo, caracterizado por la presencia de artritis o artralgia migratoria de grandes articulaciones y menos frecuentemente en forma de oligoartritis o de poliartritis no deformante que no cede al tratamiento convencional. La segunda fase o de desarrollo completo se manifiesta por síntomas gastrointestinales como diarrea crónica, pérdida de peso, dolor abdominal, proctorragia y alteraciones asociadas a la mala absorción; además, en el 90% de los casos es posible evidenciar hipoalbuminemia que se manifiesta en forma de ascitis o edema; en el 95% por déficit de carotenos y en un 75% por anemia ferropénica (1,3,11).
Las articulaciones más comúnmente afectadas son las de las rodillas, de los tobillos, de los dedos, de las caderas, de las muñecas y de los codos, pudiendo asociarse en ciertos casos a derrame sinovial (1,10). Aproximadamente el 15% de los pacientes no presentan los síntomas clásicos de la enfermedad, y es más raro aún que se manifieste sin síntomas de malabsorción o solamente con alteraciones extraintestinales (11,17).
Entre las dos fases puede haber un período de 6 años; sin embargo, si el paciente ha estado bajo tratamiento inmunosupresor, éste puede acortarse a períodos tan cortos como de 4 meses, especialmente si estos fueran a base de corticoides (1,5,32). La frecuencia de presentación de los síntomas se resume en la Tabla 1.

Formas específicas: Cardiovascular
Las manifestaciones cardiovasculares oscilan entre el 10 a 25% de los casos, siendo posible identificar el compromiso de al menos una de las capas del corazón, resultando el endocardio la más afectada. Otras estructuras comprometidas son las arterias coronarias en donde se produce un proceso inflamatorio, dando como resultado arteritis. Estas manifestaciones son más comunes en pacientes varones mayores de 60 años de edad. En la mayor parte de los casos, esta forma específica está precedida por la presencia de artralgias sin que necesariamente al tratarse de endocarditis se acompañe de signos de infección, pudiendo su diagnóstico no ser sensible a los criterios de Duke (5,11,27,30).
Cuando existe el compromiso del epicardio o pericardio puede presentarse en forma de derrame pericárdico, y si se compromete el miocardio puede asociarse como miocarditis con infiltrado linfocitario (27). El compromiso valvular es frecuente, siendo la válvula mitral la más afectada, seguida en frecuencia de la válvula aórtica; también puede haber compromiso de las válvulas protésicas en pacientes con trasplante previo, teniendo predilección por las válvulas biológicas, de ahí que se prefieren las válvulas mecánicas, en caso de ser necesario (27).
Otra forma de presentación es la sola presencia de insuficiencia cardíaca, sea sistólica o diastólica, en ausencia de endocarditis o valvulopatía establecida; debiéndose diferenciar de entidades como miocarditis viral, miocardiopatía tóxica, déficit nutricional o enfermedad de Fabry (32).
Formas específicas: Pulmonar
Se presenta en 40% de los pacientes, se caracteriza por la presencia de tos crónica, dolor costal secundario a derrame pleural, infiltrado pulmonar de predominio basal y lesiones nodulares granulomatosas, así como por la presencia de adenopatías mediastinales no caseificantes (5,18).
Formas específicas: Sistema nervioso central
Las manifestaciones neurológicas se presentan entre el 6 y 63% de los casos, las estructuras más comúnmente comprometidas son el tallo cerebral, diencéfalo, rinencéfalo, lóbulo temporal medial y meninges, así como el eje hipotálamo hipofisario, siendo en este último caso manifestada por poliuria y polidipsia secundarios a la alteración en la síntesis de hormona antidiurética (18).
Las alteraciones cognitivas como demencia, trastornos de la memoria o del nivel de consciencia, e incluso estados de confusión son secundarias a la atrofia simétrica bilateral del hipocampo y del lóbulo temporal medial. En otros casos estos síntomas neurológicos pueden estar asociados con el síndrome de Korsakoff debido a una mala absorción de tiamina. También han sido descritos cambios en el ciclo circadiano; epilepsia, ataxia, cefalea y lesiones focales (1,20,35).
Una de los signos patognomónicos pero poco sensibles es la presencia de oftalmoplejia supranuclear y mioritmia de los músculos masticatorios, que en conjunto pueden presentarse como mioritmia oculofascioesquelética que se caracteriza por la presencia de nistagmus ligero, pendular y convergente asociado a contracciones sincrónicas de la mandíbula (1,18). Finalmente las manifestaciones neurológicas pueden recidivar hasta en 10 a 40% de los casos tratados previamente de forma exitosa (1).
Formas específicas: Ocular
Ocurre en menos del 5% del total de manifestaciones por consecuencia de la enfermedad de Whipple. El 11% de los pacientes puede manifestar uveítis y de forma menos común vitritis, retinitis, neuritis retrobulbar, o papiledema. La mayor parte de pacientes presentan visión borrosa y coincide su aparecimiento con el compromiso gastrointestinal o neurológico (1,5,41).
Formas específicas: Nódulos linfáticos
El compromiso ganglionar es común pero poco específico para la enfermedad, hasta 9% de los pacientes muestran asociación con granulomas linfáticos y en pocos casos se ha visto la presencia de enfermedades linfoproliferativas asociadas con adenomegalias intestinales (5,11,41).
Formas específicas: Renal
Se manifiesta en las fases tempranas como tardías de la enfermedad. Puede debutar con proteinuria franca acompañada de nefropatía por depósito de IgA o por la presencia de granulomas no caseificantes los cuales también pueden encontrarse a nivel hepático o pulmonar. En otros casos se ha podido identificar la presencia de depósito amiloide, teniendo este hallazgo pobre pronóstico (29).
Formas específicas: Endocrinológica
Puede haber compromiso de la glándula tiroides asociado a hipotiroidismo refractario al tratamiento y asociado a síntomas de malabsorción (15).
Formas específicas: Manifestaciones hematológicas
Es común la alteración en las tres líneas celulares, que se manifiesta con anemia asociada a déficit en la absorción de vitamina B12; sangrados microscópicos de la mucosa, anemia ferropénica y la presencia de leucopenia, leucocitosis o eosinofilia, pudiendo coexistir con trombocitosis y más raramente con trombocitopenia asociada a hiperesplenismo (11,31,41).
Diagnóstico e histología
Teniendo en cuenta la alta variabilidad de los signos y síntomas y la poca especificidad de los mismos, el diagnóstico de esta enfermedad pasa obligatoriamente por la realización de una o más pruebas complementarias (3).
La endoscopía digestiva alta más la biopsia de mucosa duodenal, son el primer paso para el diagnóstico de esta enfermedad. El estudio histológico se basa en la identificación de los macrófagos que infiltran la lámina propia de la mucosa intestinal. Estos se caracterizan por ser positivos para la tinción con ácido peryódico de Shiff (PAS), así como por ser diastasa resistente, y Zielh- Nielsen negativo, pudiendo no sólo identificarse a nivel intestinal sino en otros órganos como ganglios linfáticos, líquido cefalorraquídeo, cerebro y válvulas cardíacas (1). Sin embargo, tiene la desventaja de no ser específica, ya que estos mismos hallazgos se han podido encontrar en macrófagos asociados a infección por Mycobacterium avium intracelulare, Rhodococus equi, Bacillus cereus, Corynebacterium e Histoplasma (1,5).
Los cambios macroscópicos identificados a nivel intestinal se caracterizan por la dilatación, Diagnóstico e histología engrosamiento y exudado fibrinoide en la superficie peritoneal y aumento del tamaño de los ganglios linfáticos mesentéricos; en cambio entre los hallazgos microscópicos se puede evidenciar la dilatación de las vellosidades por infiltración de los macrófagos PAS positivos presentes en la mucosa intestinal y grados variables de atrofia intestinal (1,5).
Métodos moleculares
Los métodos genéticos han sido desarrollados gracias a la capacidad de amplificar el genoma bacteriano a partir de la subunidad 16S ADNr por PCR en tiempo real, la cual demostró en varios estudios sensibilidad del 60%, especificidad del 99,9%, valor predictivo positivo del 96% y valor predictivo negativo el 95,7% con probabilidad postest positiva del 96,6% y probabilidad postest negativa del 3,85% para el diagnóstico de enfermedad de Whipple (1,5). El mayor problema de esta técnica es la presencia de falsos positivos, los cuales son comunes en pacientes portadores sanos o en aquellos que poseen bacterias que comparten similitud en la subunidad 16S ribosomal. También se ha identificado discrepancia entre los hallazgos histológicos y de PCR ya que en algunos casos con PCR positiva puede no ser evidente la presencia de bacilos en las muestras por biopsia, ya sea por una baja densidad bacteriana, porque el pico de respuesta inflamatoria no coincidió con el momento de la obtención de la muestra, por la disposición en parches de las lesiones o porque éstas estuvieron predominantemente ubicadas en la submucosa más que en la mucosa (1,5,21).
Uno de los aspectos más importantes del uso de PCR es su utilidad en la monitorización del tratamiento antibiótico, ya que otros estudios como la inmunohistoquímica pueden permanecer positivos incluso varios años después de la remisión del cuadro clínico (3). Otro parámetro de utilidad es la posibilidad de detectar por esta técnica la presencia de portadores sanos en saliva teniendo en cuenta la posibilidad de encontrar falsos positivos, de ahí la necesidad de usar los primers o cebadores adecuados para su amplificación. En caso de haber duda se deberá usar dos métodos con diferente especificidad para confirmar el diagnóstico (1).
Cultivo
Es una técnica bastante laboriosa ya que es un microorganismo de difícil crecimiento, por lo que esta técnica solamente está circunscrita a laboratorios de referencia. Resulta útil en caso de que la prueba por PCR sea positiva (1,5).
Serología
Permite detectar anticuerpos tanto de tipo IgM como IgG, y presenta sensibilidad del 78%. La desventaja de este tipo de estudio es la poca especificidad, dado que pueden ser detectados anticuerpos en portadores sanos, ya que van dirigidos contra la proteína de choque de calor 65, la cual es poco específica. No obstante se están desarrollando nuevos kits para identificar al menos seis nuevas proteínas para mejorar la especificidad del diagnóstico. Al igual que el cultivo, las pruebas serológicas se limitan a lugares de referencia y están indicados en caso de PCR positiva (1,5).
Tratamiento
Hasta el año 1950 la enfermedad era considerada como una enfermedad mortal, sobre todo en los casos en los cuales el sistema nervioso central estaba involucrado. En principio se usó las tetraciclinas como opción para el tratamiento, sin embargo se asociaron a una tasa de recurrencia mayor al 35% (1).
La mayoría de las recomendaciones se basa en estudios farmacodinámicos, de sensibilidad in vitro o reportes de casos. Estos han demostrado que la doxiciclina, los macrólidos, los cetólidos, los aminoglucósidos, la penicilina, la rifampicina, la teicoplanina, el cloranfenicol y el trimetropim sulfametoxaxol fueron activos contra la bacteria. En cambio el uso de carbapenémicos, vancomicina y cefalosporinas tuvieron resultados variables toda vez que en medio de cultivos puros demostraron sensibilidad. En cambio las fluoroquinolonas y el aztreonam se mostraron francamente resistentes (1,3,5).
Entre los fármacos más utilizados en el manejo de la enfermedad de Whipple están las sulfonamidas cuyo mecanismo de acción radica en la capacidad de bloquear la síntesis de ácido para amino benzoico (PABA) que actúa como componente de la pared celular, esto se produce gracias a la inhibición competitiva de la dihidrofolato reductasa (DHFR) que impide el paso de dihidrofolato a tetrahidrofolato con el consecuente bloqueo de la síntesis de pteridina (2).
Tropheryma whipplei ha desarrollado como mecanismo de resistencia la mutación de varios genes, principalmente la que tiene relación con el gen folpP responsable por el aporte exógeno de timidina u otras purinas, garantizando así el aumento de la DHFR y por consiguiente del PABA, deahí que no se encomienda el uso de sulfonamidas solas y más bien la unión con pirimetamina que por sí sola carece de actividad contra la bacteria, consiguiendo también disminuir la posibilidad de desarrollar resistencias (1,2,5). Sin embargo el uso de trimetroprim sulfametxaxol tiene como desventaja que al ser administrado como único agente se asocia a menores tasas de curación, mayor presentación de efectos adversos, mayor incidencia de reconstitución autoinmune y fallo por aumento de resistencia (6).
Otro esquema propuesto es a base de doxiciclina y cloroquina con actividad bactericida al modificar el pH del microambiente bacteriano de ácido a alcalino, sin embargo es importante previamente al uso de este esquema descartar compromiso del sistema nervioso central ya que estos antibióticos tienen pobre penetración a ese nivel (2).
En el caso de compromiso del sistema nervioso central se debe incluir fármacos que tengan buena biodisponibilidad a ese nivel, para lo cual se indica el uso de altas dosis de penicilina cristalina o cefalosporinas de tercera generación seguido del uso de trimetroprim sulfametoxaxol o cloranfenicol en caso de alergias (1).
Recientemente se comparó el uso de ceftriaxona frente a meropenem antes de emplear trimetroprim sulfametoxaxol por un año sin encontrar diferencias en la eficacia, sin embargo la muestra del estudio fue pequeña y por el momento no es posible generalizar estos resultados (7).
Uno de los mayores problemas al momento de tratar esta enfermedad es la elevada tasa de recurrencias, las cuales oscilan entre el 9,1 al 35% y las infecciones del sistema nervioso central son las que más se asocian con esta complicación y las que más secuelas pueden manifestar, en estos casos se ha intentado con algunas estrategias como es el uso de sulfadiazina en lugar de trimetroprim sulfametoxaxol, ya que si bien tiene igual eficacia, posee mejor penetración en el sistema nervioso central (1,3)
También se ha propuesto como esquema de mantenimiento alternativo el uso de doxixiclina más cloroquina por presentar menor número de recidivas, y en el paso de compromiso del sistema nervioso central el uso de interferon tras descartar una lesión inflamatoria activa (3).
Otro de los problemas que se puede evidenciar es la presencia del síndrome de reconstitución autoinmune similar al que se observa en los pacientes sometidos a tratamiento por VIH o tuberculosis, en los cuales se pudo observar la presencia de artritis, fiebre, pleuresía, eritema nodoso y perforación intestinal. En estos casos el manejo con corticoides es exitoso (40).
La remisión de los síntomas constituye el mejor indicador de la respuesta al tratamiento en un período de 2 a 3 semanas después de iniciado el mismo. Se recomienda el seguimiento por laboratorio cada 6 meses durante el primer año y luego anualmente, en el caso de que las manifestaciones gastrointestinales sean las más preponderantes se deberá hacer controles mediante endoscopía alta y biopsia más PCR, ya que la presencia de macrófagos PAS positivos son marcadores de respuesta inadecuada al tratamiento y porque los estudios inmunohistoquímicos pueden dar resultados falsos positivos (1,3).
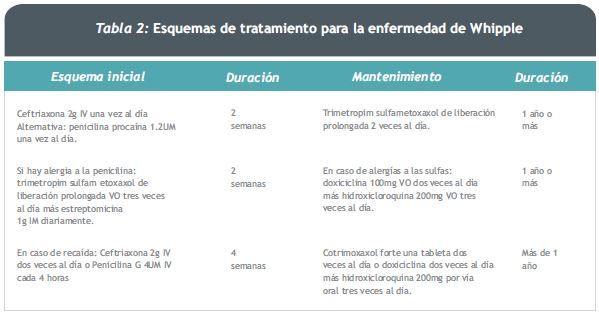
La duración ideal del tratamiento no ha sido establecida, sin embargo se recomienda mantenerlo por un periodo no menor a un año para disminuir el riesgo de recidiva. Los esquemas de tratamiento se resumen en la Tabla 2.
Discusión y conclusiones
La enfermedad de Whipple es una dolencia rara, crónica y de origen infeccioso caracterizada por ser multisistémica; y pese a su distribución no todos los pacientes portadores de la bacteria llegan a desarrollarla debido a varios factores como la susceptibilidad del hospedador o el grado de tolerancia inmunológica que éste desarrolle. El diagnóstico en muchas ocasiones dependerá de la utilización de varios métodos diagnósticos y el tratamiento inicial dependerá de si hay o no compromiso del sistema nervioso central, ya que en este caso son elegidos antibióticos con alta penetración a través de la barrera Hematoencefálica. Como punto final, la mayor parte de los esquemas de tratamiento se basan en estudios anecdóticos o series de caso, de ahí la necesidad de realizar estudios que confronten estos esquemas terapéuticos y poder validar la mejor alternativa para el tratamiento.
Referencias Bibliográficas
1.Schneider T, Moos V, Loddenkemper C, Marth T, Fenollar F, Raoult D. Whipple’s disease: new aspects of pathogenesis and treatment. Lancet Infect Dis. 2008 Mar;8(3):179-90. | CrossRef | PubMed |
2.Knaapen HK, Barrera P. Therapy for Whipple’s disease. J Antimicrob Chemother. 2007 Sep;60(3):457-8. Epub 2007 Jul 10. | CrossRef | PubMed |
3.Boulos A, Rolain JM, Raoult D. Antibiotic susceptibility of Tropheryma whipplei in MRC5 cells. Antimicrob Agents Chemother. 2004 Mar;48(3):747-52. | CrossRef | PubMed | PMC
4.Lagier JC, Lepidi H, Raoult D, Fenollar F. Systemic Tropheryma whipplei Clinical Presentation of 142 Patients with infections diagnosed or confirmed in a reference center. Medicine 2010; (89): 337-345. | CrossRef | PubMed |
5.Desnues B, Al Moussawi K, Fenollar F. New insights into Whipple’s disease and Tropheryma whipplei infections. Microbes and Infection 2010; (12) 1102-1110. | CrossRef | PubMed |
6.Lagier JC, Fenollar F, Lepidi H, Raoult D. Failure and relapse after treatment with trimethoprim/sulfamethoxazole in classic Whipple’s disease. J Antimicrob Chemother. 2010 Sep;65(9):2005-12. | CrossRef | PubMed |
7.Feurle GE, Junga NS, Marth T. Efficacy of ceftriaxone or meropenem as initial therapies in Whipple’s disease. Gastroenterology. 2010 Feb;138(2):478-86; quiz 11-2. Epub 2009 Oct 29. | CrossRef | PubMed |
8.Bonhomme CJ, Renesto P, Desnues B, Ghigo E, Lepidi H, Fourquet P, Fenollar F, Henrissat B, Mege JL, Raoult D. Tropheryma whipplei glycosylation in the pathophysiologic profile of Whipple’s disease. J Infect Dis. 2009 Apr 1;199(7):1043-52. | CrossRef | PubMed |
9.Gorvel L, Al Moussawi K, Ghigo E, Capo C, Mege JL, Desnues B. Tropheryma whipplei, the Whipple’s disease bacillus, induces macrophage apoptosis through the extrinsic pathway. Cell Death Dis. 2010 Apr 8;1:e34. | CrossRef | PubMed | PMC |
10.Koligi K, Mertz D, Benz D, Vogt T, Bloemberg GV, Winter L, Tyndall A, Battegay M, Walker UA. Of bugs and joints : Oligoarthritis caused by Tropheryma whipplei. Internist (Berl). 2011 Jul;52(7):884-888. | CrossRef | PubMed |
11.Jackuliak P, Koller T, Baqi L, Plank L, Lasabova Z, Minarik G, Payer J. Whipple’s Disease Generalized Stage. Dig Dis Sci 2008; (53):3250–3258. | CrossRef | PubMed |
12.Fenollar F Mediannikov O, Socolovschi C, Bassene H, Diatta G, Herve R et al. Tropheryma whipplei bacteremia during fever in rural West Africa. Clinical Infectious Diseases 2010; (5):515–521. | CrossRef | PubMed |
13.Rolain JM, Fenollar F, Raoult D. False positive PCR detection of Tropheryma whipplei in the saliva of healthy people, BMC Microbiology 2007; (7):48. | CrossRef | PubMed | PMC |
14.Fenollar F, Laouira S, Lepidi H, Rolain JM, Raoult D. Value of Tropheryma whipplei Quantitative Polymerase Chain Reaction Assay for the Diagnosis of Whipple Disease: sefulness of Saliva and Stool Specimens for First-Line Screening Clinical Infectious Diseases 2008; (47):659–67. | CrossRef | PubMed |
15.Tran H. Reversible hypothyroidism and Whipple’s disease, BMC Endocrine Disorders 2006; (6):3. | CrossRef | PubMed | PMC
16.Hansen A, Mereles D. Cardiac complications in Whipple’s disease, European Journal of Echocardiography 2008; (9): 426–427. | CrossRef | PubMed |
17.Misbah SA, Ozols B, Franks A, Mapstone N. Whipple’s disease without malabsorption: new atypical features. QJM. 1997 Dec;90(12):765-72. | PubMed |
18.Ratnaike R. Whipples disease. Postgrad Med J 2000;(76):760-766. | CrossRef | PubMed | PMC |
19.Maiwald M, Relman D. Whipple’s Disease and Tropheryma whippelii: Secrets Slowly Revealed. Clinical Infectious Diseases 2001; (32):457–63. | PubMed |
20.Panegyres PK, Edis R, Beaman M, Fallon M. Primary Whipple’s disease of the brain: characterization of the clinical syndrome and molecular diagnosis. QJM. 2006 Sep;99(9):609-23. Epub 2006 Aug 11. | CrossRef | PubMed |
21.Müller C, Petermann D, Stain C, Riemer H, Vogelsang H, Schnider P, Zeiler K, Wrba F. Whipple’s disease: comparison of histology with diagnosis based on polymerase chain reaction in four consecutive cases. Gut. 1997 Mar;40(3):425-7. | PubMed | PMC |
22.Knaapen HK, Barrera P. Therapy for Whipple’s disease. J Antimicrob Chemother. 2007 Sep;60(3):457-8. Epub 2007 Jul 10. | CrossRef | PubMed |
23.Fredricks D, Relman D. Localization of Tropheryma whippelii rRNA in Tissues from Patients with Whipple?s Disease. The Journal of Infectious Diseases 2001;(183):1229?37. | CrossRef | PubMed |
24.La Scola B, Fenollar F, Fournier P, Altwegg M, Mallet M, Raoult D. Description of Tropheryma whipplei gen. nov sp. nov., the Whipple’s disease bacillus. International Journal of Systematic and Evolutionary Microbiology. 2001; (51): 1471–1479. | PubMed
25.Panegyres P. Diagnosis and management of Whipples diasease of the brain. Pract Neurol 2008; (8): 311–317. | CrossRef | PubMed |
26.Maiwald M, Schuhmacher F, Ditton HJ, von Herbay A. Environmental occurrence of the Whipple’s disease bacterium (Tropheryma whippelii). Appl Environ Microbiol. 1998 Feb;64(2):760-2. | PubMed | PMC |
27.Elkins C, Shuman T, Pirolo J. Cardiac Whipple’s disease without digestive symptoms. Ann Thorac Surg. 1999; (67):250–251. | CrossRef | PubMed |
28.Desnues B, Ihrig M, Raoult D, Mege JL. Whipple’s disease: a macrophage disease. Clin Vaccine Immunol. 2006 Feb;13(2):170-8. | CrossRef | PubMed |PMC|
29.Kramer L, Manschot T, Barendregt J , Smit J. Whipple’s disease often a late diagnosis and a rare cause of nephropathy. NDT Plus 2009; (2): 55–58
30.Fenollar F, Lepidi H, Raoult D, Whipple’s Endocarditis Review of the Literature and Comparisons with Q Fever Bartonella Infection, and Blood Culture– Positive Endocarditis. Clinical Infectious Diseases. 2001; (33): 1309–16. | CrossRe f | PubMed |
31.Di Sabatino A, Vidali F, Cazzola P, Marchese A, Biancheri P, Biagi F, Corazza GR. Splenic hypofunction in Whipple’s disease. Am J Gastroenterol. 2009 Oct;104(10):2641-3. | CrossRef | PubMed |
32.Mahnel R, Kalt A, Ring S, Stallmach A, Strober W, Marth T. Inmunosuppresive therapy in Whipples disease patients in associated with the appearance of gastrointestinal manifesta-tions. Am J Gastroenterol. 2005; (100):1167-1173. | CrossRef | PubMed |
33.Fenollar F, Raoult D. Infection: How should classic Whipple disease be managed? Nat Rev Gastroenterol Hepatol. 2010 May;7(5):246-8. | CrossRef | PubMed |
34.Basagiannis C, Panagoulias G, Tentolouris N, Basoukeas S, Sambaziotis D, Spiros L. Whipple Disease. Southern Medical Journal. Apr 2010; (103): 353-356. | CrossRef | PubMed |
35.Panegyres P, Jonathan F, Fallon M, Connor C. The Amnesic Syndrome of Primary Whipple Disease of the Brain. Cog Behav Neurol. 2010; (23):49–51. | CrossRef | PubMed |
36.Freeman HJ. Tropheryma whipplei infection. World J Gastroenterol. 2009 May 7;15(17):2078-80. PubMed | PMC |
37.Baisden B, Lepidi H, Raoult D, Argani P, Yardley JH, Dumler J. Diagnosis of Whipple Disease by Immunohistochemical Analysis. Am J Clin Pathol 2002; (118):742-748. | PubMed |
38.Desnues B, Raoult D, Mege JL. IL-16 Is Critical for Tropheryma whipplei Replication in Whipple’s Disease. J Immunol 2005;(175):4575-4582. | PubMed |
39.Moos V, Kunkel D, Marth T, Feurle GE, LaScola B, Ignatius R, Zeitz M, Schneider T. Reduced peripheral and mucosal Tropheryma whipplei-specific Th1 response in patients with Whipple’s disease. J Immunol. 2006 Aug 1;177(3):2015-22. | PubMed |
40.Feurle GE, Moos V, Schinnerling K, Geelhaar A, Allers K, Biagi F, Bläker H, Moter A, Loddenkemper C, Jansen A, Schneider T. The immune reconstitution inflammatory syndrome in whipple disease: a cohort study. Ann Intern Med. 2010 Dec 7;153(11):710-7. | PubMed |
41.Dutly F, Altwegg M. Whipple’s disease and «Tropheryma whippelii». Clin Microbiol Rev. 2001 Jul;14(3):561-83. | CrossRef | PubMed | PMC |






