Detección por citometría de flujo de la enfermedad mínima residual en las leucemias agudas
Ricardo Andrés Cardona Quiceno1 http://orcid.org/0000-0002-5851-2143
Gladys Stella Mejía Pineda1 https://orcid.org/0000-0001-9885-7624
Lucelly López López2 https://orcid.org/0000-0002-1534-520X
Luis Felipe Álvarez Hernández2 https://orcid.org/0000-0002-0580-6463
Camilo Ruiz Mejía2 https://orcid.org/0000-0002-8151-0787
Laura Isabel Jaramillo Jaramillo2 https://orcid.org/0000-0002-2123-0847
Juan Diego Villegas Álzate2 https://orcid.org/0000-0002-7544-9801
Laura Herrera Almanza2 https://orcid.org/0000-0003-1898-1268
Felipe Hernández Restrepo2 https://orcid.org/0000-0003-3675-1538
Lina María Martínez Sánchez2* https://orcid.org/0000-0002-9555-0843
1Hospital “Pablo Tobón Uribe”. Medellín, Colombia.
2Universidad Pontificia Bolivariana. Medellín, Colombia.
*Autor para la correspondencia:linam.martinez@upb.edu.co
Revista Cubana de Hematología, Inmunología y Hemoterapia. 2021;37(3):e1428
Resumen
Introducción: La enfermedad mínima residual es la permanencia de células leucémicas residuales en niveles subclínicos luego de la remisión de la enfermedad. Esta condición incrementa el riesgo de recaída y mortalidad.
Objetivo: Caracterizar factores clínicos y moleculares de pacientes con leucemias agudas y enfermedad mínima residual detectada por citometría de flujo en una institución de alta complejidad de la ciudad de Medellín, Colombia durante los años 2015 – 2017.
Metodología: Este es un estudio descriptivo retrospectivo, que incluyó pacientes con leucemia diagnosticada por citometría de flujo. Se realizó un muestreo no probabilístico de casos consecutivos. La información recolectada fue digitada en una base de datos en Excel, y el análisis se realizó a través del programa IBM SPSS Versión 24, empleando según la naturaleza de cada variable frecuencias absolutas y relativas, promedio y desviación estándar o mediana y rangos intercuartílicos según su distribución.
Resultados: Se incluyó un total de 60 pacientes con predominio del sexo masculino 63,3 % (38). El diagnóstico más frecuente fue la leucemia linfoide 78,3 % (47). Del total de pacientes incluidos, 36,6% (22) fue positivo para enfermedad mínima residual; 28,3 % recibió trasplante de médula ósea y el 10 % (6) presentó compromiso de líquido cefalorraquídeo. En la segunda citometría en pacientes con enfermedad mínima residual, 90,9 % (20) expresaba CD45+. El 31,8 % (7) de los pacientes con enfermedad mínima residual presentó recaída.
Conclusión: La enfermedad mínima residual es una condición frecuente en pacientes con leucemias agudas que requiere seguimiento y constituye un factor pronóstico relevante.
Palabras clave: leucemia aguda, leucemia mieloide, leucemia linfoide, citometría de flujo, neoplasia residual.
Abstract
Introduction: The minimal residual disease is the permanence of residual leukemic cells at subclinical levels after remission of the disease. This condition increases the risk of relapse and mortality.
Objective: To characterize the clinical and molecular factors of patients with acute leukemias and minimal residual disease detected by flow cytometry in a highly complex institution in the city of Medellín, Colombia during the years 2015 – 2017.
Methodology: This is a retrospective descriptive observational study, which included patients with leukemia diagnosed by flow cytometry. A non-probabilistic sampling of consecutive cases was carried out. The information collected was entered into a database in Excel, and the analysis was carried out through the IBM SPSS Version 24 program, using absolute and relative frequencies, average and standard deviation or median and interquartile ranges, according to the nature of each variable and its distribution.
Results: 60 patients were included in which male sex predominated with 63.3% (38). The most frequent diagnosis was lymphoid leukemia with 78.3% (47). Of the total patients included, 36.6% (22) were positive for minimal residual disease; 28.3% received a bone marrow transplant and 10% (6) had a cerebrospinal fluid compromise. In the second cytometry of the patients with minimal residual disease, 90.9% (20) expressed CD45 +. 31.8% (7) of the patients with minimal residual disease relapsed.
Conclusion: Minimal residual disease is a frequent pathology in patients with acute leukemias that requires follow-up and constitutes a relevant prognostic factor.
Keywords: acuteleukemia, myeloid, leukemia, lymphoid, flow cytometry, neoplasm residual.
Introducción
El término enfermedad mínima residual (EMR), también conocida como neoplasia residual, hace referencia a la permanencia de células leucémicas residuales, generalmente en niveles subclínicos, luego de que el paciente se sometió al régimen quimioterapéutico indicado y alcanzó la remisión de la enfermedad.(1)Por ello, es importante determinar el riesgo de cada uno de los pacientes de presentar EMR positiva, puesto que es un factor pronóstico de gran importancia, ya que esta condición incrementa el riesgo de recaída y los pacientes que la desarrollan tienden a presentar peores resultados a largo plazo con mayores cifras de mortalidad y recaídas post-trasplante.(2,3,4)
De los pacientes que presentan una respuesta inicial adecuada al tratamiento de la leucemia aguda, el 20 al 25 % presentan recidiva durante el mismo o posteriormente.(5,6)
Dentro de los métodos útiles para el diagnóstico de EMR se encuentran la Reacción en Cadena Polimerasa (PCR) y la citometría de flujo.(4) Esta última técnica diagnóstica en comparación con la PCR, presenta menor sensibilidad, sin embargo, brinda múltiples ventajas como facilidad, rapidez, menores costos, mayor disponibilidad y aplicabilidad en las muestras.(4) A su vez, permite evaluar si la medula ósea se está recuperando luego de la quimioterapia o si la leucemia ha sufrido un cambio de linaje.(4) La citometría de flujo se debe realizar en varios momentos de la enfermedad: después de la inducción, durante la consolidación y luego de esta, además, previamente y posteriormente al trasplante.(2) Al momento del diagnóstico de la leucemia aguda mediante esta técnica se puede establecer en aproximadamente el 95 % de los pacientes el inmunofenotipo.(5)
Esta caracterización, permite establecer la presencia de EMR durante el tratamiento.(5)
La citometría de flujo presenta muchas ventajas y pocas desventajas al ser comparada con otras técnicas como las moleculares para el seguimiento de EMR. Dentro de las desventajas se encuentra la posibilidad de tener falsos positivos debido a la modulación antigénica inducida por los tratamientos.(7,8,9,10,11,12)
La cifra diagnóstica de EMR positiva es la presencia de 0,01 % de blastos o la presencia de un blasto en 10 mil células sanas.(2,5) Como se mencionó previamente, existen diversos momentos en los que se realiza citometría de flujo, uno de ellos es el día 15, en el cual, según Soria y otros, de los pacientes que presentaron EMR positiva, 57,5 % tuvo mayor cantidad de leucocitos al momento del diagnóstico y mayor riesgo de recaídas.(6)
Dentro de los factores de riesgo para EMR positiva se encuentran la capacidad de tolerancia y respuesta del paciente al tratamiento, el cariotipo e inmunofenotipo de la leucemia, es decir, los factores citogenéticos y las alteraciones genómicas.(1)
El objetivo de este trabajo fue caracterizar la detección de enfermedad mínima residual por citometría de flujo en leucemias agudas y su relación con factores clínicos y moleculares de pronóstico, así como la respuesta al tratamiento.
Métodos
Diseño y población de estudio
Se realizó un estudio de cohorte retrospectivo, que incluyó pacientes pediátricos y adultos con diagnóstico de leucemia aguda confirmada por citometría de flujo en una institución hospitalaria de alta complejidad de la ciudad de Medellín. Los criterios de elegibilidad fueron pacientes con seguimiento de la EMR mediante la técnica de citometría de flujo, a los que se les había realizado cariotipo y pruebas moleculares para alteraciones específicas de la enfermedad y que tuvieran seguimiento clínico en la institución entre los años 2015-2017. Se realizó un muestreo no probabilístico de casos consecutivos, con una muestra total de 77 pacientes.
Proceso de recolección de información
Se utilizaron las historias clínicas de los pacientes como fuente de información. Para la recolección de todas las variables de interés, el grupo de investigación diseñó un formulario físico.
Análisis estadístico
La información recolectada fue digitada en una base de datos en Excel, y el análisis se llevó a cabo a través del programa IBM SPSS Versión 24, empleando según la naturaleza de cada variable frecuencias absolutas y relativas, promedio y desviación estándar o mediana y rangos intercuartílicos (RIQ) según su distribución por medianas con percentiles 25 y 75.
Consideraciones éticas
Según la resolución 008430 de 1993 del Ministerio de Salud de Colombia, este trabajo constituye una investigación sin riesgo, puesto que no se realizaron intervenciones en la muestra del estudio. Adicionalmente, para la ejecución de esta investigación se obtuvo previamente el aval ético de la institución hospitalaria.
Resultados
De las 77 historias clínicas revisadas, se incluyeron 60 pacientes con diagnóstico de leucemia aguda, quienes cumplían con los criterios de elegibilidad, con una mediana de edad de 10 años (RIQ 5 – 19,5) y el 63,3% (38) eran de sexo masculino. En cuanto a la ocupación el 60% (36) eran estudiantes y respecto al Régimen de Seguridad Social de Salud el 78,3% (47) pertenecían al régimen contributivo y el 21,6% (13) eran del régimen subsidiado.
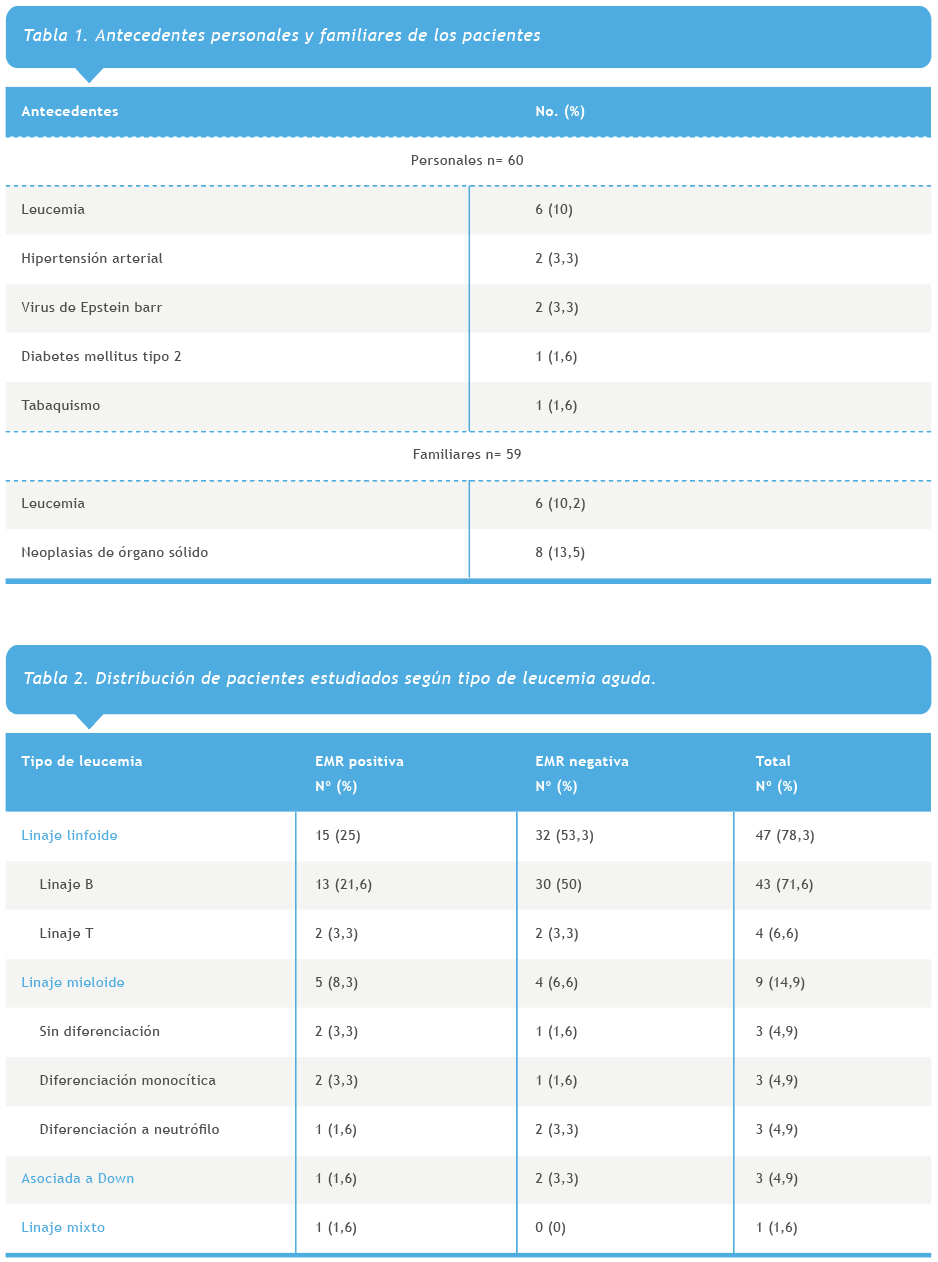
Tanto en los antecedentes personales como de los familiares de los pacientes incluidos, la principal patología encontrada fue leucemia en un 10% (6) en ambos casos. Para la variable de antecedente familiar, un paciente no tenía registro (Tabla 1).
Respecto al tipo de leucemias, la más común fue la leucemia de linaje linfoide con un 78,3 % (47). En la población de estudio el 36,6 % (22) presentó EMR positiva, de los cuales el linaje B fue el principal con 21,6 % (13) (Tabla 2).
En cuanto al tiempo de seguimiento, en los pacientes con EMR positiva la mediana de meses fue de 9 (RIQ: 6 – 25), y con EMR negativa fue de 11 (RIQ: 7 – 29).
En cuanto al estudio de líquido cefalorraquídeo (LCR), el 10% (6) presentó compromiso de los cuales, solo 1 de los pacientes presentó EMR positiva. Del total de pacientes incluidos, el 28,3% (17) recibió trasplante de médula ósea, de los cuales 9 pacientes tuvieron EMR positiva.
La alteración más frecuente fue la anemia de presentación normocítica normocrómica, tanto en los pacientes con diagnóstico de EMR positiva como negativa.
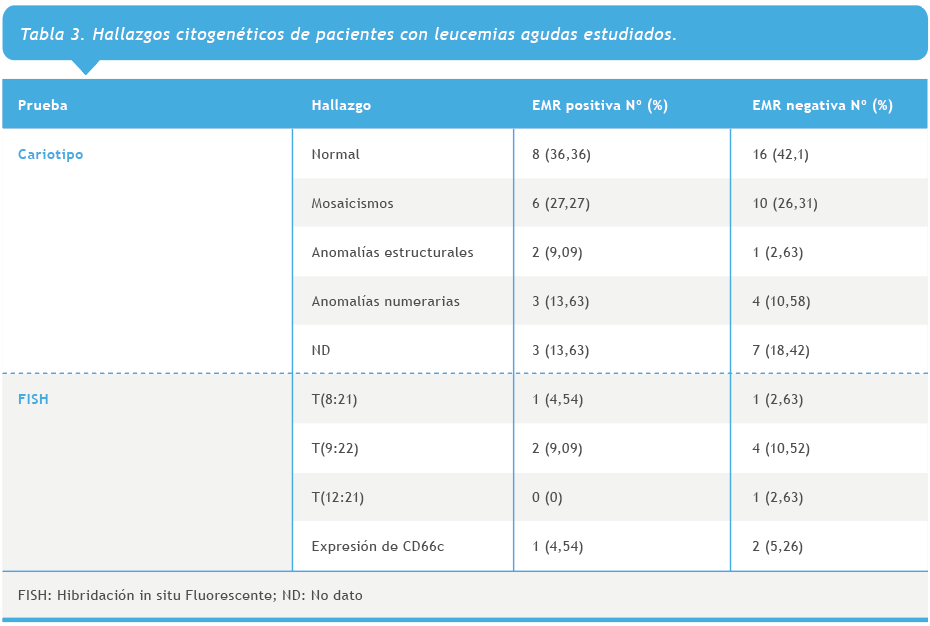
En cuanto a la citogenética observada en los pacientes con y sin EMR, 8 (36,36 %) y 16 (42,1 %) pacientes, respectivamente, presentaron un resultado normal (Tabla 3).
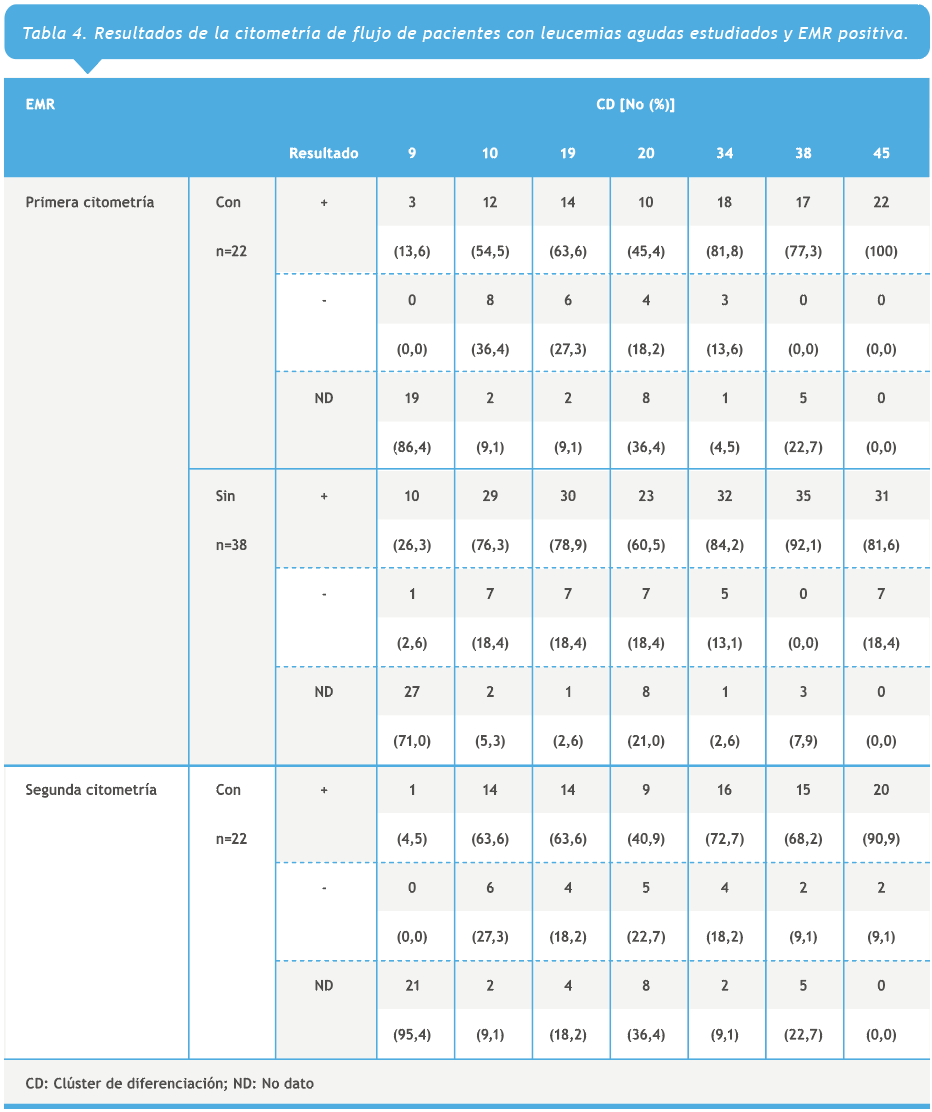
En la primera citometría de flujo, se observó la presencia del CD45+ en 22 (100 %) pacientes con EMR positiva, mientras que el CD38+ se evidenció en 35 (92,5 %) pacientes sin EMR. En la segunda citometría realizada a los pacientes con EMR positiva 20 (90,9 %) pacientes expresaron CD45+ (Tabla 4).
En cuanto a los desenlaces, 7 (31,8%) y 11 (28,9%) pacientes presentaron recaídas, con y sin EMR, respectivamente.
Discusión
En el estudio realizado por Liu y otros, en pacientes con leucemia aguda, la mediana de edad fue de 32 años con predominio del sexo femenino en el 53,1%.(13)
En el presente estudio, la mediana de edad fue de 11 años con predominio del sexo masculino en un 63,3%. Por su parte, Pérez y otros, obtuvieron una edad promedio de 46 años, (14) con un porcentaje de mujeres de 66% en una población muy similar a la de este estudio por su ubicación geográfica.
En cuanto a los estudios citogenéticos, Olsson y otros, encontraron que del total de pacientes con diagnóstico de leucemia linfoide aguda (LLA) el 44,3% no tenía ninguna alteración citogenética.(15) En el presente estudio se halló la ausencia de anormalidad de material genético en el 40% de los participantes.
En el estudio realizado por Karawajew y otros, que incluyó pacientes pediátricos con LLA,(16) reportaron que la expresión de CD38+ fue menor en los blastos comparados con los precursores de linfocitos B benignos en el 67% de los casos, junto con una alta expresión de CD10+ en 38% de los casos y de CD34+ en el 17%.
En el presente estudio la expresión de CD38+ se encontró en el 77,3% y el 92,1% en pacientes con y sin EMR, respectivamente; y en la segunda citometría realizada a los pacientes con EMR positiva este CD se evidenció en el 68,2%. La expresión de CD10+, este estuvo presente en el 54,5% y 76,3% de la población con y sin EMR, respectivamente. En la segunda citometría realizada a los pacientes, el 63,6% de los pacientes con EMR positiva lo expresaban.
La expresión de CD34+ este estuvo presente en el 81,8% y 84,2% de la población con y sin EMR, respectivamente; y en el 72,7% de los pacientes con EMR positiva, en la segunda citometría.
En cuanto a las recaídas, en el estudio Villarroel y otros, realizado en pacientes pediátricos con diagnóstico de LLA, el 38,2% de los pacientes con EMR positiva las presentaron,(17) dato similar al encontrado en el presente estudio.
La enfermedad mínima residual, es una condición frecuente en pacientes con leucemia aguda que requiere seguimiento, ya que constituye un factor pronóstico relevante. Para dicho seguimiento se pueden utilizar las ayudas diagnósticas descritas en este artículo. Una de ellas es la citometría de flujo, la cual trae consigo ventajas para el seguimiento del paciente, ya que brinda la posibilidad de realizar el diagnóstico de la enfermedad y brindar información acerca de los CD expresados en las células, lo cual, sirve de ayuda al clínico para elegir el tratamiento más adecuado.
Al tratarse de un trabajo retrospectivo se encontró con falta de información para explorar profundamente la caracterización lo que representa la principal limitación.
Referencias bibliográficas
1. Ravandi F, Jorgensen J, Borthakur G, Jabbour E, Kadia T, Pierce S, et al. Persistence of minimal residual disease assessed by multiparameter flow cytometry is highly prognostic in younger patients with acute myeloid leukemia. Cancer. 2017;123(3):426-35. DOI: https://10.1002/cncr.30361
2. Short NJ, Ravandi F. How close are we to incorporating measurable residual disease into clinical practice for acute myeloid leukemia? Haematological. 2019. DOI: https://10.3324/haematol.2018.208454
3. Buckley SA, Wood BL, Othus M, Hourigan CS, Ustun C, Linden MA, et al. Minimal residual disease prior to allogeneic hematopoietic cell transplantation in acute myeloid leukemia: a meta-analysis. Haematologica. 2017;102(5):865-73. DOI: https://10.3324/haematol.2016.159343
4. Tembhare PR, Subramanian Pg PG, Ghogale S, Chatterjee G, Patkar NV, Gupta A,Et al. A High-Sensitivity 10-Color Flow Cytometric Minimal Residual Disease Assay in B-Lymphoblastic Leukemia/Lymphoma Can Easily Achieve the Sensitivity of 2-in10(6) and Is Superior to Standard Minimal Residual Disease Assay: A Study of 622 Patients. Cytometry Part B 2019;00B: 1-11. DOI: https://10.1002/cyto.b.21831
5. Cárdenas-Araujo D, Gutiérrez-Aguirre CH. Métodos para detectar enfermedad mínima residual en leucemia linfoblástica aguda y su aplicación clínica. Hematol Méx. 2018;19(1):41-9. 6. Soria M, Gailliard M, Gutierrez M, Morán L, Rivas F, Prada S, et al. Enfermedad Mínima Residual por Citometría de Flujo en niños con Leucemia Linfoblástica Aguda. Hematol Méx. 2012; 16(1):42-6.
7. Borowitz MJ, Pullen DJ, Winick N, Martin PL, Bowman WP, Camitta B. Comparison of diagnostic and relapse flow cytometry phenotypes in childhood acute lymphoblasticleukemia: implications for residual disease detection: a report from the children’s oncology group. Cytometry 2005;68:18-24.
8. Gaipa G, Basso G, Maglia O, Leoni V, Faini A, Cazzaniga G, et al. Drug induced immunophenotypic modulation in childhood ALL: implications for minimal residual disease detection. Leukemia. 2005;19:49-56.
9. Szczepanski T. Why and how to quantify minimal residual disease in acute lymphoblastic leukemia? Leukemia. 2007;21:622-6.
10. Campana D. Minimal residual disease studies in acute leukemia. Am J Clin Pathol. 2004;122 Suppl:S47-57.
11. van derVelden VH, Boeckx N, van Wering ER, van Dongen JJ. Detection of minimal residual disease in acute leukemia. J Biol Reg Homeost Agents. 2004;18:146-54.
12. Campana D, Coustan-Smith E. Minimal residual disease studies by flow cytometry in acute leukemia. Acta Haematol. 2004;112:8-15
13. Liu J, Zhao XS, Liu YR, Xu LP, Zhang XH, et al. Association of Persistent Minimal Residual Disease with Poor Outcomes of Patients with Acute Myeloid Leukemia Undergoing Allogeneic Hematopoietic Stem Cell Transplantation. Chin Med J (Engl). 2018;131(23):2808-16. DOI: https://10.4103/0366-6999.246072
14. Pérez A, Prada-Arismendy J, Castillo E, Castellanos W. Detección del gen fusión PML-RARα en pacientes colombianos con leucemia mieloide aguda. CES Medicina. 2019;33(2):88-99.
15. Olsson L, Lundin-Ström KB, Castor A, Improved cytogenetic characterization and risk stratification of pediatric acute lymphoblastic leukemia using single nucleotide polymorphism array analysis: A single center experience of 296 cases. Genes Chromosomes Cancer.2018; 1-4. DOI: https://doi.org/10.1002/gcc.22664
16. Karawajew L, Dworzak M, Ratei R, Rhein P, Gaipa G, Buldini B, et al. Minimal residual disease analysis by eight-color flow cytometry in relapsed childhood acute lymphoblastic leukemia. Haematologica. 2015;100(7):935-44. DOI: https://10.3324/haematol.2014.116707
17. Villarroel LVR. Leucemia linfoblástica aguda B, correlación entre enfermedad mínima residual y recaída medular en pacientes pediátricos. Instituto Oncológico Nacional Solca 2015-2017. [Internet]. [acceso 15/01/2020]. (Tesis para el título de Especialista en Anatomía Patológica). Guayaquil: Universidad de Guayaquil; 2017.
Disponible en: http://repositorio.ug.edu.ec/handle/redug/29349
Conflicto de intereses: Los autores declaran que no existe conflicto de intereses.
Contribución de autoría: Conceptualización: Ricardo Andrés Cardona Quiceno, Gladys Stella Mejía Pineda, Lucelly López López, Luis Felipe Álvarez Hernández, Camilo Ruiz Mejía, Laura Isabel Jaramillo Jaramillo, Juan Diego Villegas Álzate, Laura Herrera Almanza, Felipe Hernández Restrepo, Lina María Martínez Sánchez.
Curación de datos: Ricardo Andrés Cardona Quiceno, Gladys Stella Mejía Pineda, Lucelly López López, Luis Felipe Álvarez Hernández, Camilo Ruiz Mejía, Laura Isabel Jaramillo Jaramillo, Juan Diego Villegas Álzate, Laura Herrera Almanza, Felipe Hernández Restrepo, Lina María Martínez Sánchez.
Análisis formal: Ricardo Andrés Cardona Quiceno, Lucelly López López, Luis Felipe Álvarez Hernández, Camilo Ruiz Mejía, Laura Isabel Jaramillo Jaramillo, Juan Diego Villegas Álzate, Laura Herrera Almanza, Felipe Hernández Restrepo, Lina María Martínez Sánchez.
Adquisición de fondos: Ricardo Andrés Cardona Quiceno, Gladys Stella Mejía Pineda, Lucelly López López, Luis Felipe Álvarez Hernández, Camilo Ruiz Mejía, Laura Isabel Jaramillo Jaramillo, Juan Diego Villegas Álzate, Laura Herrera Almanza, Felipe Hernández Restrepo, Lina María Martínez Sánchez.
Investigación: Ricardo Andrés Cardona Quiceno, Gladys Stella Mejía Pineda, Lucelly López López, Luis Felipe Álvarez Hernández, Camilo Ruiz Mejía, Laura Isabel Jaramillo Jaramillo, Juan Diego Villegas Álzate, Laura Herrera Almanza, Felipe Hernández Restrepo, Lina María Martínez Sánchez.
Metodología: Ricardo Andrés Cardona Quiceno, Gladys Stella Mejía Pineda, Lucelly López López, Luis Felipe Álvarez Hernández, Camilo Ruiz Mejía, Laura Isabel Jaramillo Jaramillo, Juan Diego Villegas Álzate, Laura Herrera Almanza, Felipe Hernández Restrepo, Lina María Martínez Sánchez.
Administración del proyecto: Lina María Martínez Sánchez.
Supervisión: Lina María Martínez Sánchez.
Validación: Ricardo Andrés Cardona Quiceno, Gladys Stella Mejía Pineda, Lucelly López López, Luis Felipe Álvarez Hernández, Camilo Ruiz Mejía, Laura Isabel Jaramillo Jaramillo, Juan Diego Villegas Álzate, Laura Herrera Almanza, Felipe Hernández Restrepo, Lina María Martínez Sánchez.
Redacción – borrador original: Ricardo Andrés Cardona Quiceno, Gladys Stella Mejía Pineda, Lucelly López López, Luis Felipe Álvarez Hernández, Camilo Ruiz Mejía, Laura Isabel Jaramillo Jaramillo, Juan Diego Villegas Álzate, Laura Herrera Almanza, Felipe Hernández Restrepo, Lina María Martínez Sánchez.
Redacción – revisión y edición: Ricardo Andrés Cardona Quiceno, Gladys Stella Mejía Pineda, Lucelly López López, Luis Felipe Álvarez Hernández, Camilo Ruiz Mejía, Laura Isabel Jaramillo Jaramillo, Juan Diego Villegas Álzate, Laura Herrera Almanza, Felipe Hernández Restrepo, Lina María Martínez Sánchez.
Esta obra está bajo una licencia https://creativecommons.org/licenses/by-nc/4.0/deed.es_ES






