
COVID-19: Parámetros Gasométricos al Ingreso y su Asociación con Mortalidad Hospitalaria
Nerina García Rosolen1, Carolina Zuanich1, Jorge Zaltsman1, Fabrina Capecce2, Pablo Donati3, Silvia B. González4
1Hospital de Rehabilitación Respiratoria María Ferrer, 2Hospital General de Niños Pedro de Elizalde, 3Facultad de Ciencias Veterinarias, Universidad de Buenos Aires, 4Asociación Bioquímica Argentina (ABA), Buenos Aires, Argentina
Dirección postal: Carolina Zuanich, Hospital de Rehabilitación Respiratoria María Ferrer, Dr. Enrique Finocchietto 849, 1270 Buenos Aires, Argentina
E-mail: mariaferrer_gases@buenosaires.gob.ar
Recibido: 18-V-2023 – Aceptado: 17-VII-2023
Resumen
Introducción: En los inicios de la pandemia por SARSCoV-2 la insuficiencia respiratoria aguda ha sido la causa más importante de hospitalización inmediata en los pacientes con COVID-19 que acudían a los servicios de urgencias, siendo mayor la gravedad en pacientes con comorbilidades y factores de riesgo preexistentes; en estos escenarios la hipoxemia ha sido asociada a mortalidad. Nuestro objetivo fue identificar parámetros obtenidos de los gases en sangre arterial (GSA) asociados a mortalidad en pacientes con COVID-19 al ingreso hospitalario.
Métodos: Se estudiaron retrospectivamente muestras de GSA obtenidos respirando aire ambiente (FiO2 21%) procesadas en el laboratorio clínico en un analizador ABL90 flex (Radiometer).
Resultados: La alcalosis respiratoria aguda fue el disturbio ácido base predominante. Considerando aquellos pacientes con insuficiencia respiratoria (paO2 < 60 mmHg) se observó hipoxemia “silenciosa” en 11/176 (6%) de los pacientes estudiados. En un análisis multivariado tres parámetros gasométricos al ingreso mostraron asociación positiva a mortalidad hospitalaria: paO2 (p = 0.053), índice paO2/pO2e (que expresa la paO2 ajustada a la paO2 esperada para la edad) (p = 0.047) y saturación fraccional de hemoglobina (OxiHb%) (p = 0.028).
Discusión: Los GSA generan un aporte clave en la comprensión de la fisiopatología del paciente COVID-19; en la evaluación inicial, seguimiento y pronóstico de esta enfermedad.
Palabras clave: COVID-19, hipoxemia, hipoxemia silenciosa, gases en sangre arterial.
Abstract
COVID-19: Association of gasometric parameters at admission with in-hospital mortality
Introduction: At the beginning of the SARS-CoV-2 pandemic, acute respiratory failure has been the most important cause of hospitalization in patients with COVID-19, being more severe in patients with comorbidities and risk factors. In these scenarios hypoxemia has been associated with increased mortality. Our objective was to identify parameters obtained from arterial blood gases (ABG) associated with mortality in patients with COVID-19 at hospital admission.
Methods: GSA samples obtained by breathing room air (FiO2 21%) processed in the clinical laboratory were retrospectively studied in an ABL90 flex analyzer (Radiometer).
Results: Acute respiratory alkalosis was the predominant acid-base disturbance. Considering those patients with respiratory failure (paO2 <60 mmHg), “silent” hypoxemia was observed in 11/176 (6%) of studied patients. In a multivariate analysis, three gasometric parameters at admission showed a positive association with hospital mortality: paO2 (p=0.053), paO2/pO2e index (which expresses the paO2 adjusted to the paO2 expected for age) (p=0.047) and fractional saturation of hemoglobin (OxiHb%) (p=0.028).
Discussion: GSA generate a key contribution in understanding the pathophysiology of the COVID-19 patient: in the initial evaluation, monitoring and prognosis of this disease.
Key words: COVID-19, hypoxemia, silent hypoxemia, arterial blood gas
Puntos Clave
En los inicios de la pandemia por SARS-CoV-2 la insuficiencia respiratoria aguda ha sido la causa más importante de hospitalización inmediata en los pacientes con COVID-19 y la hipoxemia ha sido asociada a mortalidad. Nuestro trabajo evaluó pacientes con COVID-19 mediante los gases en sangre arterial (GSA) al FiO2 21% a su ingreso hospitalario.
En un análisis multivariado, aplicando un modelo de regresión logística, paO2, índice paO2/pO2e (que expresa la paO2 ajustada a la paO2 esperada para la edad) y saturación fraccional de hemoglobina (OxiHb%), mostraron asociación positiva a mortalidad hospitalaria.
Los coronavirus en general producen enfermedades respiratorias leves; mientras que las graves fueron causadas por dos β-coronavirus: SARS-CoV en 2003 y MERS-CoV en 2012, hasta fines del 2019 que apareció el SARS-CoV-2 provocando la pandemia de la COVID-19 1-5.
Los pacientes con comorbilidades y factores de riesgo preexistentes como edad avanzada, enfermedad respiratoria crónica, diabetes, enfermedad cardiovascular, enfermedad renal crónica, obesidad y/o cáncer (entre otras causas de inmunocompromiso) fueron los más susceptibles para desarrollar COVID-19 grave, asociado a su vez con una elevada mortalidad hospitalaria6.
La insuficiencia respiratoria aguda ha sido la causa más importante de hospitalización inmediata en los pacientes con COVID-19 que acudían a los servicios de urgencias7. En publicaciones anteriores se ha asociado la hipoxemia con un aumento de la mortalidad intrahospitalaria6,8. La hipoxemia se define a partir de la presión parcial de oxígeno arterial (paO2) respirando aire ambiente (FiO2 21%) medida en un autoanalizador de gases en sangre (GSA). Asimismo, se observó un fenómeno, del que se ha hablado ampliamente, denominado “hipoxemia silenciosa”: pacientes que acudían a la guardia profundamente hipoxémicos con disnea mínima o ausente9.
Los GSA dan una medida precisa del intercambio gaseoso, evalúan el estado ventilatorio con la presión parcial de dióxido de carbono (paCO2), la oxigenación (paO2) y el equilibrio ácido-base y permiten evaluar la captación pulmonar de oxígeno (O2) con índices como el cociente arterio/alveolar (a/A%), el gradiente alveolar-arterial de O2 p(A-a) y el cociente paO2/FiO2 (PAFI), este último recomendado cuando la FiO2 es mayor al 40%10.
El objetivo de este estudio fue evaluar los resultados de los GSA en pacientes con COVID-19 al ingreso hospitalario e identificar parámetros asociados con la mortalidad hospitalaria.
Materiales y métodos
Estudio retrospectivo observacional de pacientes adultos (≥18 años) ingresados en el Hospital de Rehabilitación Respiratoria María Ferrer con diagnóstico confirmado de COVID-19 entre abril de 2020 a junio 2021.
A partir de las muestras de sangre arterial procedentes del Servicio de Urgencias y procesadas en el autoanalizador multiparamétrico ABL90 flex (Radiometer) en el laboratorio clínico, se seleccionaron aquellas correspondientes a pacientes COVID-19 respirando aire ambiente (FiO2 21%) y que debieron quedar hospitalizados según los criterios establecidos por la autoridad sanitaria11. Las muestras fueron obtenidas con jeringas comerciales de heparinato de litio liofilizado tamponadas con calcio. La infección por SARS-CoV-2 fue confirmada mediante rtqPCR en muestras de hisopados nasofaríngeos.
Se revisaron las historias clínicas y se extrajeron datos demográficos (edad, sexo) y clínicos: días desde el inicio de los síntomas (Dds), frecuencia respiratoria (FR), presencia o progresión de la disnea, comorbilidades (Cmb) y evolución hospitalaria (óbito si/no).
De la base de datos del autoanalizador se extrajeron los siguientes parámetros: pH (VR: 7.35-7.45), paCO2 (VR: 35-45 mmHg); paO2 (VR: 85-105 mmHg); OxiHb (VR: 94- 98%); bicarbonato (VR: 22-26 mEq/L); a/A (%); presión barométrica (mmHg); el gradiente alveolo-arterial p(A-a) se calculó a partir de su fórmula12. El cociente a/A% se consideró normal a partir de 85%. El p(A-a) se contrastó con el valor esperado para la edad según la fórmula13:
p(A-a) = (edad + 10) /4 (mmHg)
Para evaluar la hipoxemia medida en relación a la edad del paciente, se utilizó una de las fórmulas propuestas en la literatura13:
paO2e = 104 – (0.27 x edad)
Cuando el valor medido de paO2 es menor al paO2e se considera que el paciente tiene hipoxemia para la edad. Para valorar numéricamente dicha relación se construyó ad-hoc un Índice (Índice paO2):
Índice paO2 = paO2/paO2e
Siguiendo el criterio de diversos autores que definen a la hipoxemia silenciosa como presencia de hipoxemia arterial pronunciada sin dificultad respiratoria, en nuestro trabajo consideramos hipoxemia silenciosa cuando existe insuficiencia respiratoria (paO2 < 60 mmHg) sin disnea 9, 14.
Análisis estadístico: Para el análisis descriptivo, las variables cuantitativas se reportaron como media (X) y desviación estándar (DS) o mediana (Me) y rango intercuartílico (RI). El análisis bivariado para variables continuas se realizó con el test t de Student; las variables cualitativas se reportaron como frecuencias absolutas y relativas. Se realizaron diferentes modelos de regresión logística para evaluar la asociación entre los marcadores obtenidos a partir de los GSA y la mortalidad hospitalaria. Se incluyeron en el modelo como variables de ajuste la edad, el sexo, las comorbilidades y los días desde el inicio de los síntomas. Los modelos de competencia se evaluaron en términos del criterio de información de Akaike (AIC) de manera que, cuanto menor es el AIC, mejor es el modelo. La prueba de Hosmer-Lemeshow fue utilizada para estudiar la bondad de ajuste del modelo de regresión logística. El análisis estadístico se realizó con el Software estadístico STATA 13.0 (Stata Corporation, College Station, Texas; USA). Se consideró significativo con valores de p ≤ 0.05.
El estudio fue realizado en concordancia con las normativas éticas de la Declaración de Helsinki de 1975 y aprobado por el Comité de Ética en Investigación de la institución. Todos los pacientes ingresados al hospital durante el período de aislamiento epidemiológico dieron su conformidad verbal a la utilización de la información disponible en la historia clínica con fines académicos.
Resultados
De un total de 1229 muestras de GSA, 222 (18%) corresponden a pacientes COVID-19 a su ingreso hospitalario. Se descartaron 46 de ellos por falta de datos o por ser muestras obtenidas con el paciente recibiendo oxígeno suplementario, quedando para el análisis 176 determinaciones de GSA con FiO2 21%. La Tabla 1 describe las características clínicas y demográficas de los pacientes estudiados; la Tabla 2 describe las comorbilidades más frecuentes.
Del total de pacientes, 113 tenían comorbilidades (Tabla 1) siendo obesidad (IMC ≥ 30 kg/m2), diabetes, HTA y asma las más frecuentes, y 38.5% presentaba más de una comorbilidad (Tabla 2).
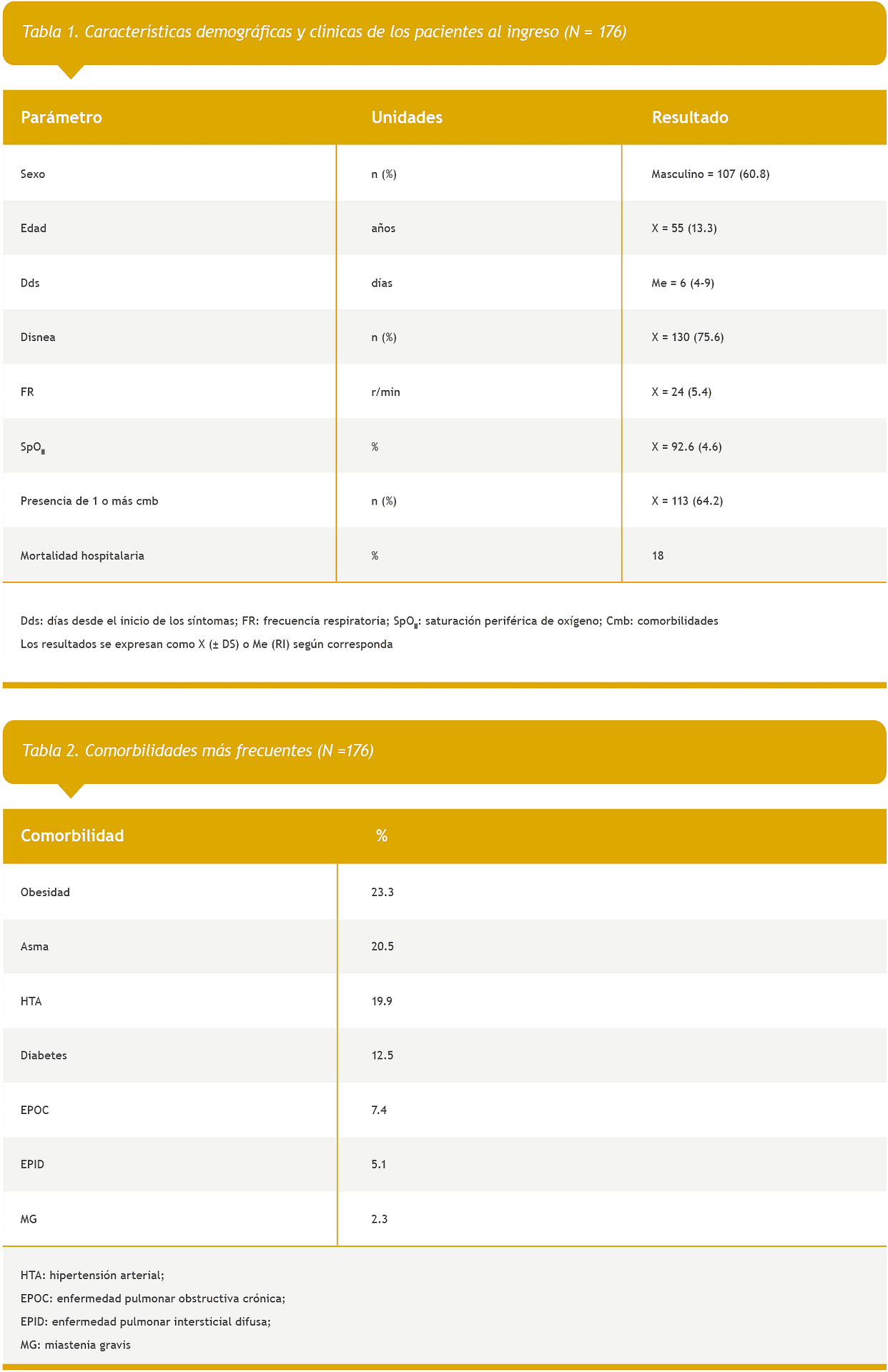
La Tabla 3 describe los resultados obtenidos a partir de los GSA respecto al estado ácido-base, el estado ventilatorio y de oxigenación arterial. Como puede observarse, 59% presentó hipocapnia y alcalosis respiratoria, pura o mixta; 87% presentó al ingreso paO2 por debajo del rango de referencia y 29% tenía insuficiencia respiratoria. Se observó que 21.6% de los pacientes con paO2 < 60 mmHg tuvieron hipoxemia silenciosa, representando el 6% del total de los estudiados.
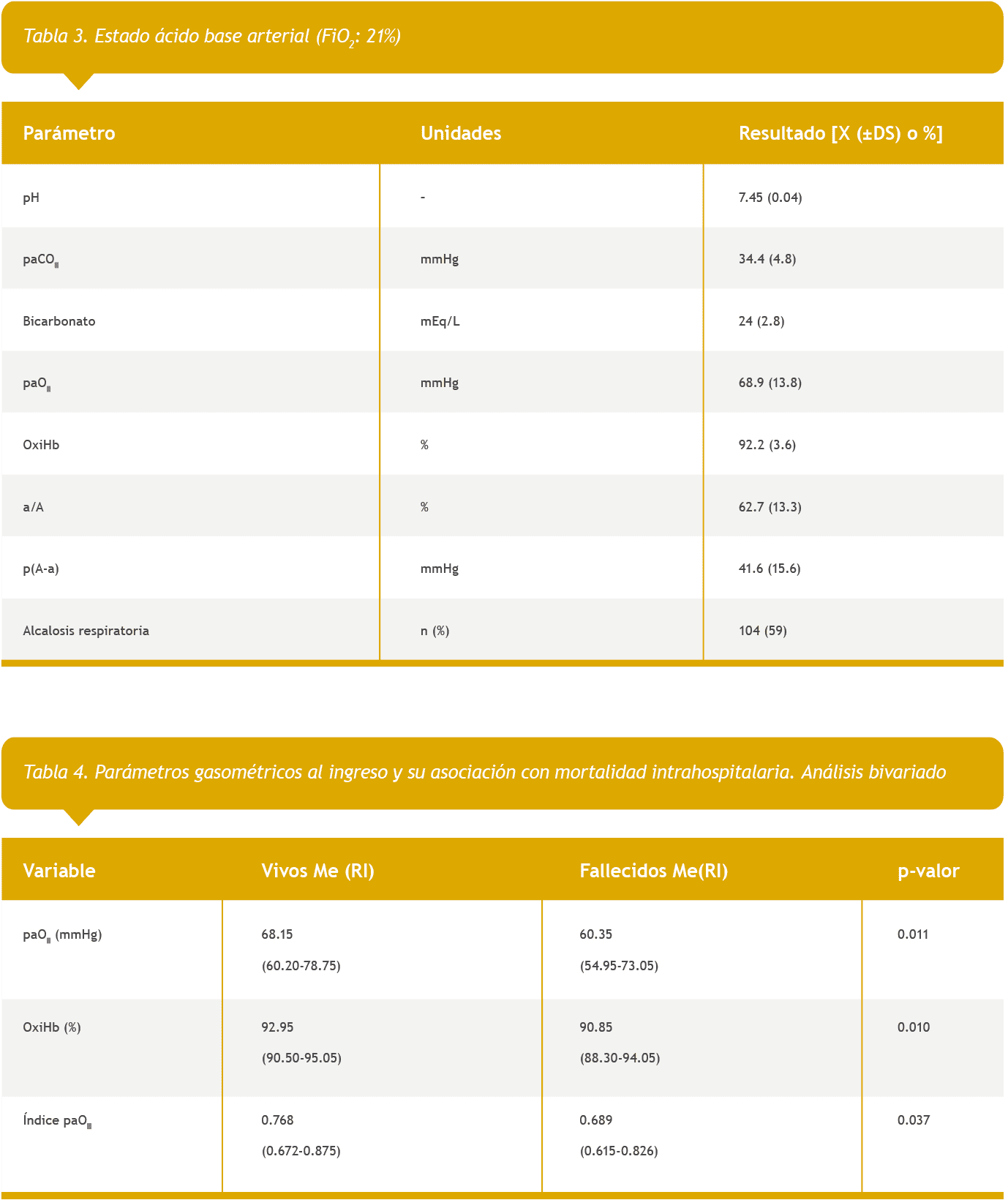
Respecto a los indicadores de intercambio gaseoso, el cociente a/A% fue patológico en el 93% y el p(A-a) en un 96% de los casos. En el análisis bivariado, disnea, presencia de comorbilidades y días desde el inicio de los síntomas no presentaron diferencia significativa entre aquellos que fallecieron de los que no (p = 0.376, 0.060 y 0.062 respectivamente).
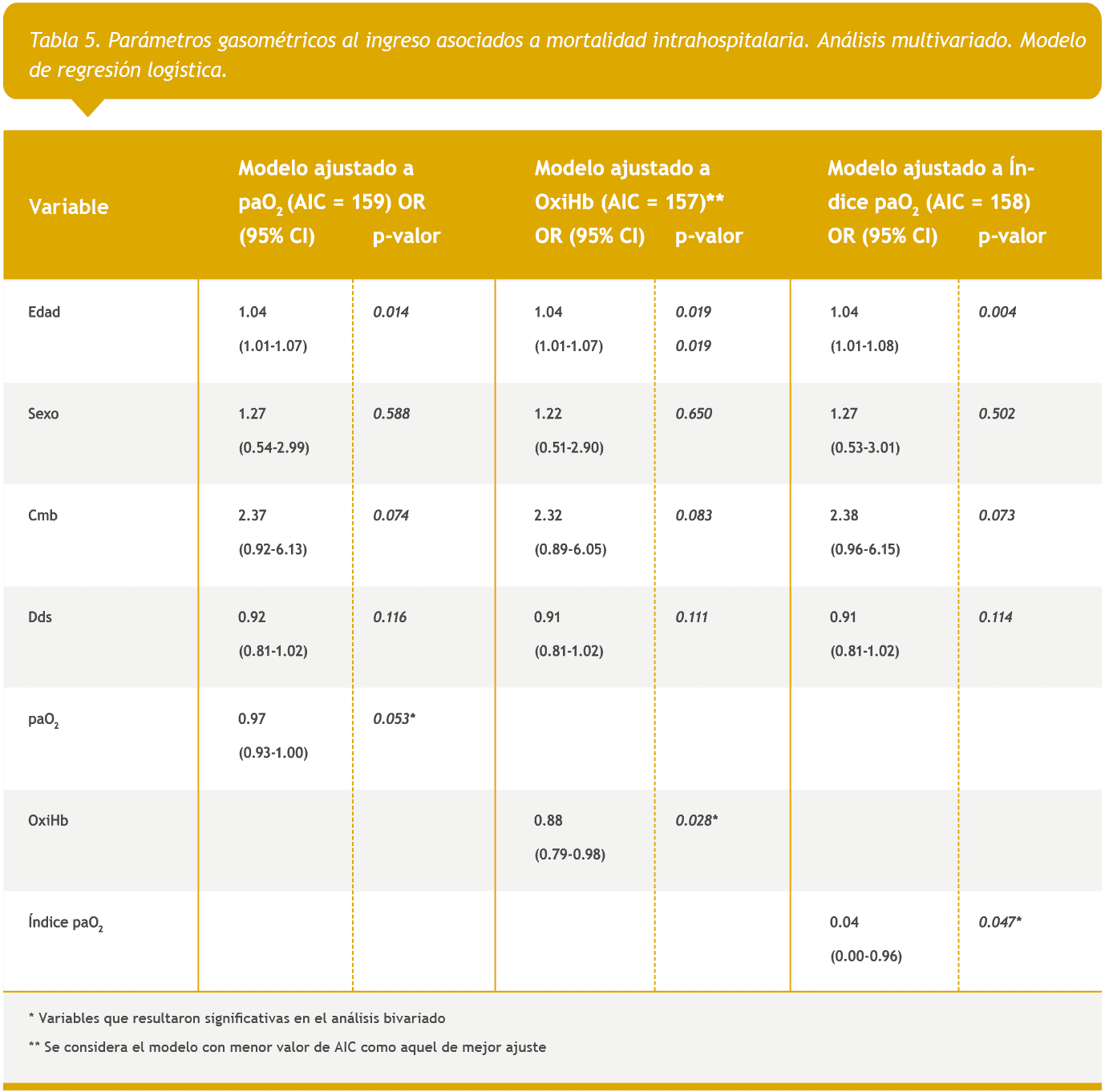
En las Tablas 4 y 5 se muestran los parámetros gasométricos con diferencia significativa contra mortalidad intrahospitalaria (análisis bivariado y multivariado, respectivamente).
El 27% de los pacientes estudiados requirió asistencia respiratoria mecánica. La mortalidad hospitalaria fue 18%; el 20% de los que fallecieron no tenían ningún factor de riesgo y/o comorbilidad.
Discusión
Desde la aparición del SARS-CoV-2 el equipo de salud se ha enfrentado al desafío de reconocer, comprender y tratar al paciente COVID-19, identificando precozmente a aquellos que pudieran evolucionar a formas más graves y de peor pronóstico.
Con el colapso provocado en las unidades de emergencia y la preocupación por la potencial evolución desfavorable, los pacientes eran asistidos rápidamente con O2 suplementario, monitoreados con oximetría de pulso y sin obtención de GSA en forma rutinaria.
En un corto tiempo se generaron numerosas publicaciones científicas aportando experiencias de los diferentes países. Diversos parámetros de laboratorio han sido estudiados como potenciales predictores en la evolución de la enfermedad, pero pocas investigaciones han hecho foco en los resultados de GSA. Existe gran heterogeneidad en el diseño de los trabajos publicados por lo que es difícil comparar los resultados obtenidos. Entre otras cosas, varían los criterios de inclusión, así como también difiere la categorización de la gravedad del COVID-19 según las guías de cada país donde se realizó el estudio; algunos no describen la FiO2 al momento de la toma de muestra de GSA y otros incluyen pacientes con oxigenoterapia ya instaurada (cánulas) que no permiten valorar la FiO2 con exactitud6, 7, 14-17. Más importante aún, en relación a nuestro estudio, son las palabras de M. Tobin: “…No existe, por supuesto, una definición esencialmente pura de hipoxemia, sino simplemente un uso…”9. Esta realidad se ve reflejada en la elección de los parámetros estudiados en los diferentes trabajos: algunos utilizan únicamente la saturación periférica como estimador de la oxigenación arterial. En la evaluación de la captación pulmonar de oxígeno es fundamental contar con los valores de paO2 como parámetro medido en un analizador de gases en sangre y existen diversas opiniones de expertos que han coincidido en la importancia de la utilización de la paO2 y paCO2 para evaluar y tratar al paciente COVID-19 14-15. Siguiendo estos lineamientos, evaluamos a los pacientes mediante la gasometría arterial respirando aire ambiente y antes de cualquier intervención. En el análisis de las paO2 observamos hipoxemia e insuficiencia respiratoria, reflejo del deterioro del intercambio gaseoso debido a la COVID-19. Alfano y col. por su parte, obtuvieron resultados similares en su cohorte (n = 211); no obstante, incluyeron en su análisis 82.6% de pacientes con oxigenoterapia al momento de la toma de GSA16.
Informes previos han relacionado la hipoxemia con una evolución adversa en el paciente COVID-19. Xie y col. estudiaron la SpO2 en 140 pacientes ya asistidos con cánula nasal, en los cuales identificaron la SpO2 ≤90% como marcador pronóstico de muerte6. Brouqui y col. encontraron que la combinación de hipoxemia e hipocapnia (paO2 ≤80mmHg y paCO2 ≤35mmHg según los autores) estuvo fuertemente asociado a mortalidad o requerimiento de cuidados intensivos18.
Por otro lado, la respuesta ventilatoria a la caída de la paO2 se describe con una curva hiperbólica, observándose un aumento exponencial de la ventilación cuando la paO2 cae por debajo de 60mmHg, lo que lleva a la hipocapnia y la alcalosis respiratoria9. Todos los que tenían una paO2 <60mmHg presentaron hipocapnia, y en coincidencia con otros reportes, el disturbio ácido base predominante fue la alcalosis respiratoria15-17,19. Es importante recordar que las infecciones sistémicas en general son una de las causas más importantes de alcalosis respiratoria por un estímulo directo de los quimiorreceptores centrales, siendo responsables de la hiperventilación observada comúnmente en los pacientes con sepsis. Las infecciones virales provocan típicamente inflamación y estimulación de los receptores periféricos con efecto en el centro respiratorio9,20 como ha sido reportado también en pacientes con COVID-19 16,17,19.
En la práctica clínica es habitual evaluar inicialmente al paciente con un pulsioxímetro, como herramienta de monitoreo de la oxigenación. Sin embargo, es importante conocer las limitaciones de dicho instrumento; entre ellas mencionamos que sus lecturas pueden no ser confiables en diversas circunstancias y puede subestimar la verdadera saturación en valores por debajo del 80%9,21. Si bien la hipoxemia es la causa más importante de una baja SpO2, la evaluación del estado de oxigenación del paciente por medio de ésta debe interpretarse cuidadosamente22,23. El desplazamiento de la curva de disociación de la hemoglobina podría ser un factor de confusión al interpretar la SpO2 y su relación con la paO2: mientras que la fiebre, presente en la COVID-19, disminuye la afinidad de la hemoglobina por el O2, la hipocapnia la aumenta9.Ambos factores alteran la relación esperada entre la saturación y la paO2 por lo que algunos autores postulan que la SpO2 no debería utilizarse por sí sola para evaluar la gravedad de la falla respiratoria23.
Por otro lado, en sujetos normales ocurre una disminución de la paO2 a lo largo de la vida debido a cambios en las propiedades mecánicas de los pulmones que llevan a un mayor desajuste ventilación-perfusión (V/Q) debido al proceso de envejecimiento24,25. Es por ello que en nuestro estudio evaluamos los valores de paO2 medidos según la paO2 esperada para la edad del paciente mediante el índice paO2. De esta manera, la hipoxemia expresada como índice paO2 resultó ser un predictor independiente de mortalidad.
Por otro lado, utilizar un autoanalizador con co-oximetría que mide espectrofotométricamente todas las fracciones de Hb, nos permitió obtener la verdadera saturación de O2, la OxiHb%. Ésta resultó ser, entre los parámetros estudiados, el mejor predictor independiente de mortalidad hospitalaria al presentar el menor valor AIC.
Analizando los indicadores de intercambio gaseoso, el p(A-a) elevado se encuentra en las alteraciones V/Q y el shunt intrapulmonar y descarta la hipoventilación como causa de hipoxemia13-15,26-28. En coincidencia con lo mencionado por Gattinoni y col en pacientes COVID-19, en nuestros pacientes el p(A-a) estuvo elevado29-30. El a/A% representa la fracción de aire alveolar que ha llegado a la arteria; como era esperable, la totalidad de nuestros pacientes hipoxémicos presentaron un a/A% patológico.
En nuestra cohorte en el análisis bivariado tanto la paO2 como el índice paO2 (construido ad hoc) y la OxiHb% mostraron diferencia significativa entre los que sobrevivieron y los que no. Luego, en el análisis multivariado se consideró sexo, edad, días desde el inicio de los síntomas y comorbilidades, a diferencia de otros autores que ajustan por edad y sexo6. En éste, si bien la paO2 no alcanzó la significancia estadística, el valor de p fue muy cercano a 0.05 (0.053) por lo cual observamos una fuerte tendencia de asociación positiva entre el descenso de la paO2 y la mortalidad hospitalaria.
La hipoxemia silenciosa se ha descrito como una disociación notable entre un bajo nivel de paO2 y ausencia de disnea. Se han postulado diversos mecanismos que la explicarían: una acción directa del virus sobre los quimiorreceptores involucrados en la sensibilidad al O2, el grado de sensibilidad a bajos niveles de O2 de los centros respiratorios entre individuos (principalmente por factores como comorbilidades y edad) y, el efecto de la paCO2 en la respuesta ventilatoria a la hipoxemia y en la aparición de disnea. También, como hemos mencionado anteriormente, si la evaluación del paciente se realizó mediante oximetría de pulso, la imprecisión de las lecturas a bajas saturaciones de oxígeno, así como la disminución de la afinidad de la hemoglobina por el O2 en el paciente febril, podrían explicar la desaturación9,14,31,32. Aunque mucho se ha hablado de la hipoxemia silenciosa, no hay una homogeneidad de criterio en cuanto a los valores de pO2 sobre los que se define. En nuestro trabajo, considerando solo aquellos pacientes con pO2 <60 mmHg al ingreso hospitalario, el 6% del total presentaba hipoxemia silenciosa. En cambio, si consideramos a todos aquellos con paO2 debajo del rango de referencia de nuestro laboratorio (pO2 < 85 mmHg) la proporción de hipoxemia silenciosa asciende a 19.3%. Otros autores como Brouqui y col., informan un 28.1% de hipoxemia silenciosa tomando como criterio una pO2 < 80 mmHg18.
Entre nuestros pacientes, el 75.6% refirió disnea al ingreso, siendo éste un porcentaje mayor que el comunicado por otros autores6,18. No observamos correlación entre disnea y mortalidad, coincidiendo con Brouqui, que concluye que la disnea al ingreso no sería un criterio de gravedad18.
Finalmente, en numerosos trabajos se habla de la asociación entre comorbilidades (enfermedad renal crónica, enfermedad respiratoria crónica, diabetes, enfermedad cardiovascular, obesidad o cáncer y edad avanzada) y mala evolución en pacientes COVID-196,15,18. En nuestra cohorte el 63.6% presentó uno o más de dichos factores de riesgo, siendo ésta una proporción mayor que la descrita en otras publicaciones y una alta proporción tenían asma, enfermedad pulmonar obstructiva crónica (EPOC) y enfermedad pulmonar intersticial difusa (EPID). Por otro lado, la edad promedio de nuestros pacientes es coincidente con reportes previos6,15.
Como limitaciones de nuestro estudio mencionamos que es un trabajo retrospectivo y observacional, y si bien el tamaño de la cohorte es similar a otras, probablemente con un número de pacientes mayor se podría haber obtenido un valor de p más categórico para la paO2 en el análisis multivariado6, 16. Por otro lado, el tipo de pacientes que mayoritariamente acude a nuestro hospital de neumonología no es equiparable a la población general, por lo cual nuestros resultados podrían no ser extrapolables a otras poblaciones. Es importante tener en cuenta que el parámetro disnea es subjetivo.
Finalmente, destacamos la información que ofrece una determinación habitual como los GSA como un aporte clave tanto en la comprensión de la fisiopatología del paciente COVID-19, en la evaluación clínica inicial y en el seguimiento posterior, así como en el pronóstico de esta enfermedad, colaborando en la toma de decisiones y en el empleo óptimo de los recursos. Entre los parámetros estudiados, la saturación fraccional de hemoglobina (OxiHb%) fue el mejor predictor independiente de mortalidad. Cuando la paO2 se ajustó mediante el índice paO2/paO2e, éste resultó ser un predictor independiente de mortalidad y podría ser otra herramienta para emplear en la práctica cotidiana. Por otra parte, la “hipoxemia silenciosa” es un fenómeno observado en los pacientes COVID-19 pero del que aún resta unificar criterios (tanto la definición de hipoxemia en sí como la de hipoxemia silenciosa). Sería de utilidad también estudiar su presencia en otras infecciones respiratorias con características semejantes al COVID-19 para evaluar su valor clínico y pronóstico.
Agradecimientos: Al Dr. Francisco Nacinovich por su minuciosa lectura y valiosos aportes al manuscrito.
Conflicto de intereses: Ninguno para declarar
Referencias Bibliográficas
Suarez Reyes A, Villegas Valverde C. Características y especialización de la respuesta inmunitaria en la COVID-19. Rev Fac Med (Méx) 2020; 63: 7-18.
Li X, Geng M, Peng Y, Meng L, Lu S. Molecular immune pathogenesis and diagnosis of COVID-19. J Pharm Anal 2020; 10: 102-8.
Li JY, You Z, Wang Q, et al. The epidemic of 2019-novel-coronavirus (2019-nCoV) pneumonia and insights for emerging infectious diseases in the future. Microbes Infect 2020; 22: 80-5.
Yuan M, Wu NC, Zhu X, et al. A highly conserved cryptic epitope in the receptor binding domains of SARS-CoV-2 and SARS-CoV. Science 2020; 368: 630-3.
Machhi J, Herskovitz J, Senan AM, et al. The natural history, pathobiology, and clinical manifestations of SARS-CoV-2 infections. J Neuroimmune Pharmacol 2020; 15: 359-86.
Xie J, Covassin N, Fan Z, et al. Association between hypoxemia and mortality in patients with COVID-19. Mayo Clin Proc 2020; 95: 1138-47.
Visca D, Migliori GB, Dinh-Xuan AT, et al. The role of blood gas analysis in the post-acute phase of COVID-19 pneumonia. Arch Bronconeumol 2022; 58:513-6.
Allado E, Poussel M, Valentin S, et al. The fundamentals of respiratory physiology to manage the COVID-19 pandemic: An overview. Front Physiol 2021; 11: 615690.
Tobin MJ, Laghi F, Jubran A. Why COVID-19 silent hypoxemia is baffling to physicians. Am J Respir Crit Care Med 2020; 202: 356-0.
Oliver P, Rodríguez O, Marín J, et al. Estudio de la oxigenación e interpretación de la gasometría arterial. Revisión (2014) Sociedad Española de Bioquímica Clínica y Patología Molecular Comité Científico. En: https://www.seqc.es/download/ doc/62/2845/951224035/858217/cms/estudio-de-laoxigenacion-e-interpretacion-de-la-gasometriaarterial-revision-2014.pdf/; consultado enero 2023.
Ministerio de Salud de la Nación. Evaluación inicial del paciente con infección respiratoria aguda y decisión del sitio de internación. En https://www.argentina.gob.ar/salud/coronavirus/evaluacion-inicial-ira; consultado enero 2023.
Toffaletti JG, Rackley CR. Monitoring oxygen status. Adv Clin Chem 2016; 77: 103-24.
Sharma S, Hashmi MF, Burns B. Alveolar Gas Equation. En: ttps://www.ncbi.nlm.nih.gov/books/NBK482268/ StatPearls. Treasure Island (FL): StatPearls Publishing; enero 2022; consultado enero 2023.
Dhont S, Derom E, Van Braeckel E, Depuydt P, Lambrecht BN. The pathophysiology of ‘happy’ hypoxemia in COVID-19. Respir Res 2020; 21: 198.
Sanghani H, Bansal S, Parmar V, Shah R. Study of arterial blood gas analysis in moderate-to-severe COVID-19 patients. Cureus 2022; 14: e26715.
Alfano G, Fontana F, Mori G, et al. Modena Covid-19 Working Group (MoCo19). Acid base disorders in patients with COVID-19. Int Urol Nephrol 2022; 54:405-10.
Duan J, Wang X, Chi J, et al. Correlation between the variables collected at admission and progression to severe cases during hospitalization among patients with COVID-19 in Chongqing. J Med Virol 2020; 92:2616-22.
Brouqui P, Amrane S, Million M, et al. Asymptomatic hypoxia in COVID-19 is associated with por outcome. Int J Infect Dis 2021; 102: 233-38.
Wu C, Wang G, Zhang Q, et al. Association between respiratory alkalosis and the prognosis of COVID-19 patients. Front Med (Lausanne) 2021; 8: 564635.
Palmer BF. Evaluation and treatment of respiratory alkalosis. Am J Kidney Dis 2012; 60: 834-8.
Jubran A. Pulse oximetry. Crit Care 2015; 19: 272.
Tobin MJ. Respiratory monitoring. JAMA 1990; 264:244-51.
Ottestad W, Søvik S. COVID-19 patients with respiratory failure: what can we learn from aviation medicine? Br J Anaesth 2020; 125: e280-e281.
Holland J, Milic-Emili J, Macklem PT, Bates DV. Regional distribution of pulmonary ventilation and perfusion in elderly subjects. J Clin Invest 1968; 47:81-92.
Cerveri I, Zoia MC, Fanfulla F, et al. Reference values of arterial oxygen tension in the middle-aged and elderly. Am J Respir Crit Care Med 1995; 152: 934-41.
Williams AJ. ABC of oxygen: assessing and interpreting arterial blood gases and acid-base balance. British Medical Journal 1998; 317: 1213-6.
Sánchez Casado M, Quintana Díaz M, Palacios D, et al. Relación entre el gradiente alveolo-arterial de oxígeno y la PaO2/FiO2 introduciendo la PEEP en el modelo. Medicina Intensiva 2012: 329-34.
Stein PD, Goldhaber SZ, Henry JW. Alveolar-arterial oxygen gradient in the assessment of acute pulmonary embolism. Chest 1995; 107: 139-43.
Gattinoni L, Chiumello D, Rossi S. COVID-19 pneumonia: ARDS or not? Crit Care 2020; 24: 154.
Gattinoni L, Chiumello D, Caironi P, et al. COVID-19 pneumonia: different respiratory treatments for different phenotypes? Intensive Care Med 2020; 46: 1099-102.
Machado-Curbelo C. Silent or ‘happy’ hypoxemia:An urgent dilemma for COVID-19 patient care. MEDICC Rev 2020; 22: 85-86.
Pérez-Padilla J, Thirión-Romero I, Aguirre-Pérez T, Rodríguez-Llamazares S. ¿Qué tan silenciosa es la hipoxemia en COVID-19? Neumol Cir Torax 2020; 79:69-70







