“Correlación entre la disminución de la función renal en pacientes diagnosticados con Leucemia Mieloide Crónica en fase crónica tratados con Imatinib y el número de copias del gen de fusión BCR-ABL1 al momento del diagnóstico”
ARTÍCULO ORIGINAL
Bioq. María Gabriela Giordana, Dr. Pablo Iribarne
Hospital Provincial Castro Rendón, Hospital Plottier, Neuquén, 2018.
Trabajo de Investigación Final para concluir la carrera de Especialidad en Hematología, Universidad Nacional de Córdoba.
Resumen
Objetivo: El tratamiento prolongado con inhibidores de tirosina kinasa (ITK) de primera generación, Imatinib, en pacientes que cursan Leucemia Mieloide Crónica (LMC) produce cambios en la función renal de los mismos. Nuestro objetivo fue correlacionar los cambios en la función renal de pacientes que padecen LMC tratados con Imatinib y determinar si estos cambios se asocian con el mayor número de copias del gen de fusión BCR-ABL1 al momento del diagnóstico.
Métodos: Estudio de cohorte prospectivo, incluyó 12 pacientes diagnosticados con LMC en fase crónica, por PCR cuantitativa a tiempo real (RT-qPCR). Fueron tratados con Imatinib durante los 2 primeros años. Se midió la concentración de Creatinina sérica (Crs) trimestralmente y por fórmula se determinó el Filtrado Glomerular (FG).
Resultados: Las medias de Crs y FG tuvieron un incremento y un descenso, respectivamente, con significancia estadística (p<0.05). Se asoció que los pacientes que desarrollaron Enfermedad Renal Crónica (ERC), luego de 2 años de tratamiento, fueron los que tuvieron al momento del diagnóstico el mayor número de copias del gen de fusión BCR-ABL1.
Conclusiones: Sugerimos que el tratamiento con Imatinib, disminuye la función renal de los pacientes, pudiendo desarrollar ERC y que esta disminución estaría relacionada con el mayor número de copias del gen de fusión BCR-ABL1 al momento del diagnóstico. Creemos que sería adecuado tratar a los pacientes que al diagnóstico tienen un alto número de copias del gen de fusión BCR-ABL1 y un bajo FG, con ITK de segunda generación, los cuales no afectan la función renal de los pacientes.
Palabras claves: Leucemia mieloide crónica, Imatinib, creatinina sérica, filtrado glomerular.
Summary
Objective: The prolonged treatment with first generation Tyrosine Kinase Inhibitors (TKI), Imatinib, in patients with Chronic Myeloid Leukemia (CML) result in changes on their renal function. Our objective was to correlate those changes of renal function in patients with CML treated with Imatinib and determinate if those changes can be associated with a higher number of copies of the chimeric gene BCR-ABL 1 at the moment of diagnosis.
Methods: Prospective cohort study, include 12 patients diagnosed with CML in chronic phase, through quantitative real time PCR (RT-qPCR). Treated with Imatinib during 2 first year. Seric creatinine (SCr) concentration was measured quarterly, and the glomerular filtration (GF) was estimated thorough formulas.
Results: Means of SCr and GF had an increased and a decreased, respectively, with statistical significance (p<0.05). There was a association between the patients that developed Chronic kidney disease (CKD), after 2 years of treatment, with those that had a higher number of copies of chimeric gene BCR-ABL1.
Conclusions: We suggest that the therapy with Imatinib, decreases renal function of thepatients, being able to develop CKD, and that this decrease is related with the higher number of copies of chimeric gene BCR-ABL 1 at the moment of diagnosis. We believe that would be appropriate to treat the patients who have, at the moment of diagnosis, a high number of copies of chimeric gene BCR-ABL1 and a low GF, with second generation TKI, which do not affect renal function of the patients.
Key words: Chronic myeloid leukemia, Imatinib, seric creatinine, glomerular filtration.
Introducción
La LMC es una neoplasia de células hematopoyéticas, que se origina en una célula madre hematopoyética a partir de una aberración cromosómica conocida como cromosoma de Philadelphia (producto de la translocación recíproca t(9;22)(q34;q11))que lleva a la formación de un gen quimérico, BCR-ABL1 (1). El producto de este gen es una oncoproteína (p210, en más del 95% de los casos de LMC) que mantiene activo el dominio tirosin-quinasa de ABL1, independientemente de las señales externas. Este desregula la actividad tirosin-quinasa intracelular y se produce el avance de la enfermedad en 3 fases bien caracterizadas (fase crónica, acelerada o crisis blástica) (2). La LMC suele afectar a la población de edad media, la aparición de la enfermedad se da entre los 45 y 55 años de edad. En la Argentina cada año se diagnostican 400 casos nuevos de LMC (3). El curso natural de esta enfermedad tiene una sobrevida media de 4 años (4). A partir del año 2000 se desarrolló el Imatinib, como el ITK de primera generación que tiene como blanco molecular específico la oncoproteína p210, el cual inhibe su actividad quinasa (5)(6). Años posteriores se desarrollaron ITKs de segunda generación (nilotinib y desatinib) los cuales se utilizan como terapéutica para pacientes que no responden al tratamiento con Imatinib. La introducción de los ITKs lograron una ventaja significativa en la sobrevida de los pacientes. Es importante conocer los efectos adversos que tienen estos fármacos para poder mejorar la calidad de vida de los pacientes, ya que en la actualidad los pacientes que padecen LMC son tratados de por vida con ITK (7)(8). Esto es debido a que los tratamientos, usados como monoterapias, no son capaces de eliminar las células madre hematopoyéticas leucémicas, responsables de mantener la enfermedad indefinidamente. Se estima que sólo el 20% de los pacientes tratados en fase crónica con ITKs logran las condiciones para discontinuar la terapia, pero menos de la mitad de ellos mantienen la remisión molecular luego de la suspensión (9). Están descriptos como efectos adversos, luego del tratamiento a largo plazo con Imatinib, diarrea e hipofosfatemia. En el uso a largo plazo de ITK de segunda generación, se observaron efectos vasculares adversos, como cardiopatía isquémica, isquemia cerebrovascular, también se registraron casos de derrames pleurales dentro de los 6 años de tratamiento (10)(11)(12). Todo esto hace que la calidad de vida de los pacientes se vea disminuida. Se informaron fallas renales agudas, como eventos raros y esto ocurrió en <1% de los pacientes tratados con Imatinib durante la fase crónica y crisis blástica de la enfermedad (13)(14). Se reportaron en varios informes que el tratamiento a largo plazo con Imatinib puede causar disminución en la estimación del FG (15)(16). Esto podría explicarse por el efecto inhibidor del Imatinib, no solo en la actividad BCR-ABL1 sino también en otras proteínas con actividad tirosin-quinasa, como el receptor del factor de crecimiento derivado de plaquetas (PDGF-R) y el c-kit. Se ha reportado que PDGFR-alfa se expresa en células intersticiales renales y en células mesangiales, PDGFR-beta se expresa en células mesangiales, células del epitelio glomerular y células intersticiales. Los resultados sugieren que el Imatinib podría afectar la función renal al actuar sobre estos receptores (17)(18).
La LMC se diagnostica a través de estudios citogenéticos y moleculares. Estos últimos pueden ser cualitativos (RT-PCR) y/o cuantitativos (RT-qPCR). El estudio BCR-ABL1 cuantitativo es una metodología de alta sensibilidad que permite cuantificar los transcriptos BCR-ABL1 respecto a un gen control (ABL) (1).
El objetivo de nuestro trabajo fue correlacionar la función renal de pacientes diagnosticados con LMC en fase crónica tratados con Imatinib, en un periodo de 2 años y determinar si estos cambios se asocian con el mayor número de copias del gen de fusión BCR-ABL1 al momento del diagnóstico.
Materiales y métodos
Realizamos un estudio de cohorte prospectivo, incluyó 12 pacientes diagnosticados con LMC en fase crónica, tratados en el Servicio de Hematología del Hospital Provincial Castro Rendón de la ciudad de Neuquén, en el período que comprende junio del 2015 hasta junio del 2016. El estudio se realizó previa autorización de la Comisión Asesora en Investigación Biomédica en Seres Humanos, de la provincia de Neuquén. Los pacientes firmaron un consentimiento informado, siendo esta una condición para ser incluidos en el estudio.
Los criterios de exclusión fueron: FG<60mL/min/1.73m2, glucemia>1.26mg/dL, diagnóstico previo de Diabetes Mellitus.
Los pacientes se diagnosticaron con LMC por RT-qPCR (LightCycler t (9; 22) Kit de cuantificación) y se informó el número de copias del gen de fusión BCR-ABL1 en forma de Cociente% (IS).
Fueron tratados con Imatinib durante los 2 primeros años.
Medimos las concentraciones de Crs (Método cinético Jaffe compensado), durante 8 trimestres consecutivos, luego del inicio de terapia con Imatinib y obtuvimos las medias. A partir de estos valores calculamos los FG, utilizando la ecuación MDRD-4 (Modificación de la dieta en la enfermedad renal), que la misma usa para el cálculo 4 variables: Crs, edad, sexo y raza. La ERC se definió como FG <60mL/min/1.73m2 en al menos 90 días (19)(20).
Luego observamos como variaron los valores del FG respecto al número de copias del gen de fusión BCR-ABL1 obtenidos al diagnóstico de la enfermedad. El número de copias del gen de fusión BCR-ABL1 se informa como Cociente % (IS). El cociente es entre el número de copias del gen de fusión BCR-ABL1 y el gen control ABL. El IS, del inglés International Scale, representa un método práctico y teóricamente adoptable por cualquier laboratorio, que posibilita la comparación de los resultados de RT-qPCR obtenidos en diferentes centros, de esta manera los médicos de cualquier parte del mundo pueden adoptar las guías internacionales de tratamiento para pacientes con LMC (21).
Los valores de Crs y los valores de FG, variables continuas fueron comparados por el test estadístico Students t. El valor p<0.05 fue considerado estadísticamente significativo.
Resultados
En total analizamos 20 pacientes diagnosticados con LMC en fase crónica y tratados desde el momento del diagnóstico con Imatinib, durante un periodo de 2 años. Luego de ese lapso de tiempo, algunos pacientes continuaron su terapéutica con Imatinib y otros cambiaron el tratamiento por un ITK de segunda generación, eso dependió de la respuesta al tratamiento inicial instaurado. Se descartaron 8 pacientes, ya que al momento del diagnóstico tenían 4 pacientes una Glucemia > 1,26 mg/dL, 1 paciente un valor de FG <60mL/min/1.73m2 y 3 pacientes tenían diagnóstico previo de Diabetes Mellitus. La mediana de edad al momento del diagnóstico y tratamiento con Imatinib fue 51 años (rango 18-77), la media de Crs fue 0,78mg/dL (rango 0,57-1,19mg/dL), la media del FG fue 89mL/min/1.73m2 (rango 61-141mL/min/1.73m2) (Tabla 1).
Tabla 1 Características de los pacientes en tratamiento con Imatinib (N=12)
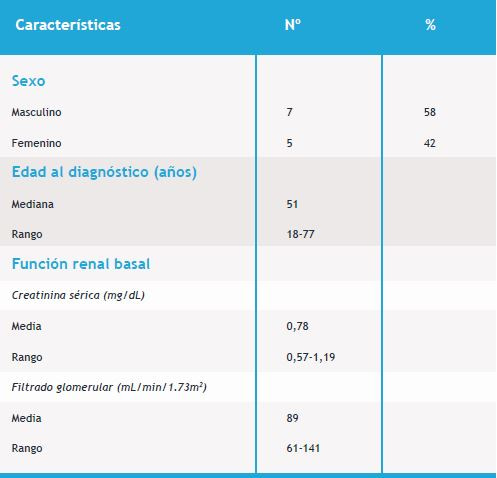
Observamos como varió secuencialmente la función renal luego de hacer el diagnóstico de LMC e instaurada la terapéutica con Imatinib. Los valores medios de Crs y de FG al momento del diagnóstico fueron 0,78mg/dL y 89mL/min/1.73m2, respectivamente. Los niveles de Crs fueron incrementándose gradualmente a lo largo del periodo de 2 años, divididos trimestralmente (8 trimestres) y mostraron diferencias estadísticamente significativas comparando los niveles iniciales con los que se obtuvieron luego de finalizar el tratamiento con Imatinib (p<0.05) (Figura 1). Examinamos los cambios secuenciales que se produjeron en el FG, en el mismo lapso de tiempo que analizamos los cambios en los valores de Crs. Se comprobó un descenso en el FG con diferencia estadísticamente significativa (p<0.05) desde el inicio del tratamiento con Imatinib hasta transcurridos los 2 años de tratamiento (Figura 2). Luego de 2 años de seguimiento, los valores medios de Crs y FG fueron 0,96mg/dL y 67mL/min/1.73m2.
Figura 1. Cambio secuencial de los niveles de Crs durante el tratamiento con Imatinib. Se observan diferencias estadísticamente significativa (p<0.05), calculado con el test Students t, entre el punto basal y el punto final, que corresponden al inicio del tratamiento y luego de 2 años del mismo, respectivamente.
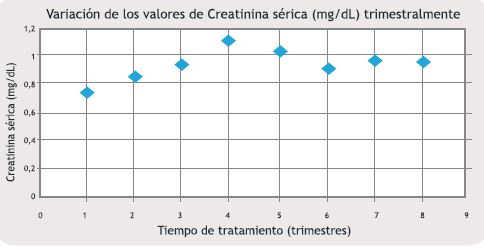
Figura 2. Cambio secuencial de los niveles de FG durante el tratamiento con Imatinib. Se observan diferencias estadísticamente significativa (p<0.05), calculado con el test Students t, entre el punto basal y el punto final, que corresponden al inicio del tratamiento y luego de 2 años del mismo, respectivamente.
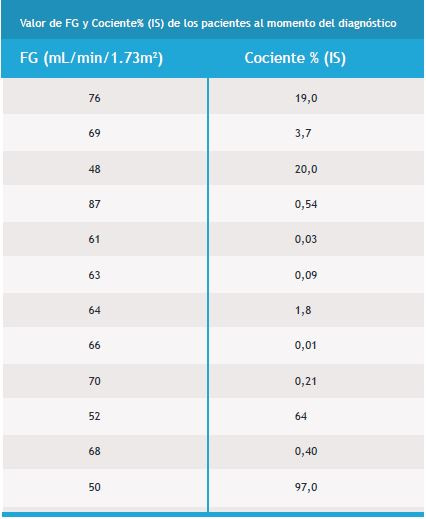
A lo largo del estudio 3 pacientes desarrollaron ERC, definiéndose esta como FG <60mL/min/1.73m2 en al menos 90 días. Al relacionar el número de copias del gen de fusión BCR-ABL1, el mismo informado como Cociente % (IS), al momento del diagnóstico, con los pacientes que desarrollaron ERC, vemos que los 3 tenían al momento del diagnóstico un valor de Cociente% (IS) >10%. Observamos que solo un paciente que al momento del diagnóstico de LMC tenía un Cociente% (IS) >10% no desarrolló ERC (Tabla 2).
Tabla 2. Se observan los FG luego de 2 años de tratamiento con Imatinib y el número de copias del gen de fusión BCR-ABL1 (informados como Cociente % (IS)) al momento del diagnóstico de LMC, de cada paciente.
Discusión
Observamos que los pacientes diagnosticados con LMC y tratados con Imatinib desde el comienzo de la terapéutica durante 2 años tuvieron un aumento en el valor de Crs, considerando el valor de Crs al diagnóstico y a los 2 años postratamiento (valor p<0,05). Con los valores de FG obtenemos la misma conclusión, los mismos, disminuyen luego de 2 años de tratamiento con Imatinib (p<0.05). En el grafico se observa como incrementa el valor medio de la Crs hasta que alcanza valores cercanos a 1.20mg/dL en el 4° trimestre del tratamiento, luego hay un decaimiento de los mismos y su comportamiento comienza a ser oscilatorio, teniendo valores cercanos a 1.00mg/dL. Vemos que el tratamiento con Imatinib en los primeros meses genera un aumento en los niveles de Crs, afectando la función renal de los pacientes tratados. Luego los valores de Crs se estabilizan, por lo que el daño renal no sigue avanzando. El mismo análisis lo hacemos cuando observamos el comportamiento del FG a través del tiempo. Allí vemos que en el 4° trimestre el valor medio del FG es <60mL/min/1.73m2, por lo tanto a partir de ese momento sí esto se mantuviera por al menos 90 días los pacientes desarrollarían ERC. Vemos que eso no sucede ya que los valores medios del FG se normalizan y su niveles oscilan entre 65-70mL/min/1.73m2. Solo 3 pacientes desarrollaron ERC, de los 12 analizados. Estos pacientes tenían al momento del diagnóstico un numero de copias del gen de fusión BCR-ABL1, informado como Cociente% (IS) >10. Nosotros observamos que habría una correlación entre el mayor número de copias del gen de fusión BCR-ABL1 al momento del diagnóstico y el desarrollo de ERC luego de ser tratados con Imatinib, por un periodo de 2 años. Un solo paciente al momento del diagnóstico tenía un numero de copias del gen de fusión BCR-ABL1 Cociente% (IS) >10, el cual no desarrolló ERC.
Por lo expuesto nosotros concluimos que el tratamiento con Imatinib como primera línea terapéutica a pacientes diagnosticados con LMC en fase crónica disminuiría la función renal, se puede evidenciar luego del 4° trimestre de tratamiento, midiendo la Crs y calculando el FG. Evidenciamos que los paciente que tuvieron al momento del diagnóstico de LMC un número de copias del gen de fusión BCR-ABL1 Cociente % (IS) >10, desarrollarían ERC debido a la terapéutica con Imatinib.
Nuestra población se comporta de manera similar a trabajos publicados (15)(16). El mecanismo molecular que actúa sobre el decaimiento del FG aun no está dilucidado, sin embargo algunos reportes sugieren que el efecto tóxico del Imatinib puede deberse a la inhibición de señal sobre el PDGF-R (22). Este receptor es expresado en glomérulos, arterias y células tubulares renales (18). Algunos trabajos sugieren que este receptor es importante en la reparación del daño renal (23). Se ha descripto que el Imatinib tiene mayor efecto sobre PDGF-R que sobre c-kit o BCR-ABL1. Esto conlleva a que el Imatinib inhiba la secreción de creatinina y esa inhibición incremente los niveles de Crs independientemente del daño glomerular (24).
Creemos que sería adecuado tratar a los pacientes que al diagnóstico tienen un alto número de copias del gen de fusión BCR-ABL1 (Cociente % (IS) >10) y un bajo FG (cercanos a valores de 60mL/min/1.73m2), con ITK de segunda generación, los cuales no afectan la función renal de los pacientes, según los trabajos publicados. Sugerimos estas consideraciones para pacientes que al momento del diagnóstico tengan comorbilidades como Diabetes Mellitus y/o afectación de la función renal. Recomendamos que se realice un estudio similar que abarque un número mayor de pacientes y que sean estudiados por un mayor período de tiempo, para que el mismo tenga mayor peso estadístico y puedan extrapolarse sus resultados a todos los pacientes diagnosticados con LMC en fase crónica, ya que estos pacientes reciben tratamiento de por vida y debemos procurar que la calidad de vida ellos no disminuya debido a la terapéutica.
Agradecimientos
Queremos agradecer al Servicio de Hematología del Hospital Castro Rendón por su colaboración y predisposición, y al Laboratorio del Hospital Plottier por facilitar a la autora María Gabriela Giordana que desarrolle el trabajo propuesto.
Referencias Bibliográficas
- Beligoy L, Bengio R, Enrico A, Freitas J, Larripa I, Pavlovsky C, Riva ME, Riveros D, Varela A, Ventriglia V. Leucemia Mieloide Crónica. Guías de diagnóstico y tratamiento. SAH. 2017:429-446
- Bianchini M, De Brasi C, Gargallo P, Gonzalez M, Bengio R, Larripa I. Specific assessment of BCR-ABL transcript overexpression and imatinib resistance in chronic myeloid leukemia patiens. Eur J Haematol. 2009; 82:292-300.
- Rohrbacher M, Hasford J. Epidemiology of chronic myeloid leukemia. Best practice and research: Clinical Haematology. 2009; 22: 295-302.
- Thompson P, Kantarjian H, Cortes J. Diagnosis and treatment of chronic myeloid leukemia in 2015. Mayo Clinic Proceedings. 2015; 90: 1440-1454.
- Hino A, Yoshida H, Tada Y, Koike M, Minami R, Masaie H,Ishikawa J. Changes from imatinib mesylate to second generation tyrosine kinase inhibitors improve renal impairment with imatinib mesylate in chronic myelogenous leukemia. Int J Hematol. 2016; 104: 605-611.
- Morishima Y, Ogura M, Nishimura M, Yazaki F, Bessho M, Mizoguchi H, et al. Efficacy and safety of imatinib mesylate for patients in the first chronic phase of chronic myeloid leukemia: results of a Japanese phase II clinical study. Int J Hematol. 2004; 80:261–6.
- Hochhaus A, Saglio G, Hughes TP, Larson RA, Kim DW, Issaragrisil S, et al. Long-term benefits and risks of frontline nilotinib vs imatinib for chronic myeloid leukemia in chronic phase: 5-year update of the randomized ENESTnd trial. Leukemia. 2016; 30:1044–54.
- Giles FJ, Mauro MJ, Hong F, Ortmann CE, McNeill C, Woodman RC, et al. Rates of peripheral arterial occlusive disease in patients with chronic myeloid leukemia in the chronic phase treated with imatinib, nilotinib, or non-tyrosine kinase therapy: a retrospective cohort analysis. Leukemia. 2013; 27:1310–5.
- Mahon FX, Rea D, Guilhot F, Huguet F, Nicolini F, Legros L, Charbonnier A, Guerci A, Varet B, Etienne G, Reiffers J, Rousselot P. Discontinuation of imatinib in patients with chronic myeloid leukaemia who have maintained complete molecular remission for at least 2 years: the prospective, multicentre Stop Imatinib trial. Lancet Oncol. 2010; 11: 1029-35.
- Kalmanti L, Saussele S, Lauseker M, Müller MC, Dietz CT, Heinrich L, et al. Safety and efficacy of imatinib in CML over a period of 10 years: data from the randomized CML-study IV. Leukemia. 2015; 29:1123–32.
- Pinilla-Ibarz J, Sweet K, Emole J, Fradley M. Long-term BCRABL1 tyrosine kinase inhibitor therapy in chronic myeloid leukemia. Anticancer Res. 2015; 35:6355–64.
- Steegmann JL, Baccarani M, Breccia M, Casado LF, GarcíaGutiérrez V, Hochhaus A, et al. European LeukemiaNet recommendations for the management and avoidance of adverse events of treatment in chronic myeloid leukaemia. Leukemia. 2016; doi:10.1038/leu.2016.104.
- Druker BJ, Sawyers CL, Kantarjian H, Resta DJ, Reese SF, Ford JM, et al. Activity of a specific inhibitor of the BCR-ABL tyrosine kinase in the blast crisis of chronic myeloid leukemia and acute lymphoblastic leukemia with the Philadelphia chromosome. N Engl J Med. 2001; 344:1038–42.
- Druker BJ, Talpaz M, Resta DJ, Peng B, Buchdunger E, Ford JM, et al. Efficacy and safety of a specific inhibitor of the BCRABL tyrosine kinase in chronic myeloid leukemia. N Engl J Med. 2001; 344:1031–7.
- Marcolino MS, Boersma E, Clementino NC, Macedo AV, MarxNeto AD, Silva MH, et al. Imatinib treatment duration is related to decreased estimated glomerular filtration rate in chronic myeloid leukemia patients. Ann Oncol. 2011; 22:2073–9.
- Yilmaz M, Lahoti A, O’Brien S, Nogueras-González GM, Burger J, Ferrajoli A, et al. Estimated glomerular filtration rate changes in patients with chronic myeloid leukemia treated with tyrosine kinase inhibitors. Cancer. 2015; 121:3894–904.
- Weisberg E, Manley PW, Breitenstein W, Brüggen J, CowanJacob SW, Ray A, et al. Characterization of AMN107, a selective inhibitor of native and mutant Bcr-Abl. Cancer Cell. 2005; 7:129–41.
- Floege J, Eitner F, Alpers CE. A new look at plateletderived growth factor in renal disease. J Am Soc Nephrol. 2008; 19:12–23.
- Levey AS, Bosch JP, Lewis JB, Greene T, Rogers N, Roth D. A more accurate method to estimate glomerular filtration rate from serum creatinine: a new prediction equation. Modification of diet in renal disease study group. Ann Intern Med. 1999; 130:461–70.
- Levey AS, Eckardt KU, Tsukamoto Y, Levin A, Coresh J, Rossert J, et al. Definition and classification of chronic kidney disease: a position statement from kidney disease: improving global outcomes (KDIGO). Kidney Int. 2005; 67:2089–100.
- Bianchini M, Larripa I. Cuantificación de los transcriptos BCR-ABL1 y evaluación de la respuesta molecular en Leucemia Mieloide Crónica. Hematología. 2014; 18:60-64.
- Buchdunger E, Cioffi CL, Law N, Stover D, Ohno-Jones S, Druker BJ, et al. Abl protein-tyrosine kinase inhibitor STI571 inhibits in vitro signal transduction mediated by c-kit and platelet-derived growth factor receptors. J Pharmacol Exp Ther. 2000; 295:139–45.
- Boor P, Ostendorf T, Floege J. PDGF and the progression of renal disease. Nephrol Dial Transplant. 2014; 29:54–62.
- Vidal-Petiot E, Rea D, Serrano F, Stehlé T, Gardin C, Rousselot P, et al. Imatinib increases serum creatinine by inhibiting its tubular secretion in a reversible fashion in chronic myeloid leukemia. Clin Lymphoma Myeloma Leuk. 2016; 16:169–74.










