Consenso sobre el uso de pruebas diagnósticas para SARS-CoV-2
Consideraciones generales
En la situación epidemiológica actual, el diagnóstico de laboratorio de SARS-CoV-2 (infección aguda) se basa en pruebas de detección directa del genoma viral por técnicas de biología molecular (RT-PCR, LAMP, etc.) basadas en la amplificación específica de regiones altamente conservadas del genoma de SARS-CoV-2.
Las pruebas serológicas detectan anticuerpos específicos antiproteínas del SARS-CoV-2, fundamentalmente las proteínas S y N, que son las más inmunogénicas. Algunas pruebas pueden incluir la detección de anticuerpos dirigidos a una región de la proteína S (RBD, receptor binding domain), responsable de la unión al receptor celular ACE2 (enzima convertidora de Angiotensina 2) al que se une SARS-CoV-2. La unión de estos anticuerpos específicos al RBD bloquea la unión al receptor celular y, por lo tanto, neutraliza la infectividad viral. Estos serían los denominados anticuerpos neutralizantes. Los anticuerpos anti-N de SARS-CoV-2 dan cuenta de la infección previa por este virus, pero no estarían relacionados con la neutralización de la infectividad viral. Existen varias pruebas serológicas diseñados con la proteína N ya aprobadas por ANMAT. De acuerdo con la información disponible hasta el momento, los niveles de anticuerpos anti-N podrían disminuir más rápidamente que los anticuerpos anti-S y los anti RBD. Adicionalmente se debe tener presente que las pruebas serológicas que incluyen otras proteínas del virus tienen mayor probabilidad de detectar anticuerpos para otros coronavirus. En el contexto clínico epidemiológico apropiado, una prueba serológica reactiva (habitualmente informada como positivo) puede ser interpretada como subrogante de infección pasada por COVID-19, incluso en personas que no hayan percibido síntomas.
En términos de aplicación clínica-diagnóstica, las pruebas serológicas no reemplazan a los métodos directos y no tienen utilidad para guiar la interrupción o finalización de las medidas de aislamiento y/o prevención y control de infecciones. Su muy baja sensibilidad durante la primera semana luego del inicio de los síntomas los vuelve una opción poco apropiada para su uso en el diagnóstico de personas con sospecha de infección activa por SARS-CoV-2 (1). La detección de anticuerpos sólo indica el contacto previo con el virus, pero no permite definir el momento en que ocurrió el contacto. Por ejemplo, un paciente que haya tenido contacto previo con el virus pero que posteriormente se infecte con otro patógeno circulante (influenza u otro agente etiológico) generará síntomas respiratorios, debido al antecedente previo, resultara positivo para anticuerpos anti SARS-CoV-2, lo cual pueden conducir a un diagnóstico erróneo; por esta razón, el uso de pruebas serológicas para la confirmación diagnóstica de SARS-CoV-2, debe ser cuidadosamente evaluado (24).
Adicionalmente, dado que su mayor sensibilidad entre la segunda y la quinta semana luego del inicio de los síntomas (1,2) podrían tener un rol en el diagnóstico retrospectivo de pacientes que se presenten con complicaciones tardías potencialmente asociadas a COVID-19 (ej: síndrome inflamatorio multisistémico asociado a COVID-19 en niños y niñas) y en la identificación de sujetos candidatos a ser donantes de plasma de convalecientes. Sin embargo, si pueden ser de suma utilidad para estimar la proporción de una población determinada que estuvo expuesta al virus.
La evidencia actualmente disponible muestra que la mayoría de los individuos inmunocompetentes desarrollará anticuerpos detectables entre los 7 a 21 días posteriores al inicio de los síntomas. En las curvas de la cinética de seroconversión se observa que -a diferencia de lo que ocurre en otras patologías infecciosas y con los métodos diagnósticos actualmente disponibles- la IgG se vuelve detectable prácticamente en simultáneo con la IgM (3). A la fecha la evidencia es insuficiente para recomendar el uso de pruebas de detección de IgG o IgM o de ambos en forma rutinaria para el diagnóstico, y la heterogeneidad significativa en términos de sensibilidad y especificidad de las distintas pruebas actualmente disponibles plantea un desafío adicional en la interpretación de sus resultados (1,2,4).
Aplicaciones clínicas de técnicas moleculares para el diagnóstico de COVID-19
Detección de SARS-CoV-2 en personas sintomáticas
El uso de técnicas moleculares basadas en la detección de genoma viral de SARS-CoV-2 en muestras respiratorias en la actualidad, RT-PCRrt, es el gold-standard para el diagnóstico de personas sintomáticas con sospecha de COVID-19 (5,6).
Los métodos moleculares son altamente sensibles y específicos, requieren de personal entrenado y de infraestructura de bioseguridad nivel II o infraestructura equivalente con cabinas de bioseguridad o cabinas de contención primaria para el procesamiento seguro de las muestras previa a la inactivación. La adecuada toma de muestra (en general hisopado nasofaríngeo, o muestras del tracto respiratorio inferior en pacientes en asistencia respiratoria mecánica) resulta fundamental para minimizar la posibilidad de falsos negativos (6).
Aunque hay evidencia de que SARS-CoV-2 puede detectarse en muestras respiratorias durante el período pre-sintomático de la infección e incluso en personas asintomáticas, el pico en la carga viral y la transmisibilidad parece ocurrir cerca del momento del inicio de los síntomas (7–11). La ocurrencia de una alta proporción de estudios de RT-PCR con resultados falsos negativos en muestras tomadas antes del inicio de los síntomas e incluso en el primer día de estado de la enfermedad ha sido demostrada (8,12). La toma de muestra para diagnóstico debe realizarse preferentemente en los primeros días desde el inicio de los síntomas y en caso de realizarse en forma muy temprana (primer día) y existir una elevada sospecha diagnóstica debería solicitarse una nueva muestra y repetirse la determinación. Por lo tanto, se desaconseja la realización de la prueba en personas asintomáticas, ya que la no detección del virus carece de valor y puede llevar a interpretaciones e indicaciones incorrectas. En la situación de contacto estrecho con caso positivo, si el individuo no presenta síntomas se recomienda cumplir estrictamente las medidas de aislamiento establecidas en las recomendaciones nacionales (https://www.argentina.gob.ar/salud/coronavirus-COVID-19/Identificacion-y-seguimiento-decontactos)
Interrupción o suspensión de las medidas de prevención y control de infecciones
Existe evidencia científica suficiente que demuestra que en la casi totalidad de los pacientes con formas leves de COVID-19 pueden discontinuarse tanto las medidas de aislamiento, como, las de prevención y control de infecciones en función de criterios clínicos (ej: al menos 10 días desde la aparición de los síntomas y al menos 72 horas de estabilidad o mejoría clínica), dado que estos pacientes, la probabilidad de aislar partículas virales con capacidad infectiva en cultivos celulares se reduce significativamente luego de la primera semana del inicio de los síntomas(13). En pacientes con formas graves hay evidencia de la posibilidad de que exista una excreción viral prolongada, motivo por el cual en estos pacientes se recomienda, el uso de técnicas moleculares para guiar la finalización del aislamiento (13). La toma de muestra en estos pacientes debe realizarse durante el período de convalecencia o cuando se haya establecido la mejoría clínica, recordando que la detección de virus en esta instancia no significaría necesariamente la presencia de virus infectivo, sino la de fracciones o segmentos genómicos que detecta la técnica. La viabilidad viral o el potencial de producir enfermedad debe ser evaluado por otro tipo de estudios (ej. cultivo en líneas celulares susceptibles y permisivas, y otros modelos de infección experimental).
Detección de SARS-CoV-2 en personas asintomáticas
Si bien existe controversia sobre el rol de las personas presintomáticas y asintomáticas en la transmisión de SARS-CoV-2 a escala poblacional (7,9,10,14), el tamizaje generalizado de personas asintomáticas a través de pruebas moleculares no resulta una estrategia eficiente, en especial en escenarios de alta demanda(15). Es importante destacar, que la presencia de una prueba molecular negativa en contactos estrechos asintomáticos de un caso confirmado en ningún caso puede implicar el no cumplimiento estricto de los 14 días de aislamiento preventivo y monitoreo de síntomas (16,17). El uso de métodos directos de diagnóstico en circunstancias como esta conlleva a un consumo de recursos injustificados, que pueden ser destinados a asegurar el aislamiento preventivo y seguimiento del paciente para monitoreo de la aparición de síntomas. Por tal motivo, la utilización de técnicas moleculares en la utilización de moleculares en el marco de evaluaciones prequirúrgicos, prepartos, derivaciones y traslados, y distintos tipos de estudios, debe ser cuidadosamente balanceada a fin de garantizar: 1) la disponibilidad de las pruebas para la confirmación diagnóstica, 2) el uso eficiente de la tecnología y 3) la adecuada interpretación del resultado, sobre todo la prueba no detecta SARSCoV-2.

El uso de esta prueba en otros escenarios debe ser adecuadamente evaluado haciendo un minucioso balance de eficiencia.
El desarrollo de nuevos métodos de biología molecular basados en la amplificación isotérmica mediada por bucle (LAMP) permiten que las cadenas de ADN recién copiadas formen estructuras en bucle que pueden amplificarse mucho más rápidamente que en la RT-PCR, requiriendo solo una hora de amplificación. Estos nuevos métodos han logrado aceptables niveles de sensibilidad y especificidad en comparación con la prueba gold-standart (25). Otro aspecto comparativo a tener en cuenta es que las LAMP requieren instrumental más sencillo para su ejecución y pueden realizarse en laboratorios de menor complejidad y esto permite realizar un mayor número de determinaciones al mismo tiempo. La toma de muestra requiere de personal entrenado y el procesamiento inicial de la misma exige disponer de una cabina de flujo de bioseguridad nivel II o infraestructura equivalente con cabinas de bioseguridad o cabinas de contención primaria para el procesamiento seguro de las muestras previa a la inactivación. La adecuada toma de muestra (en general de un único hisopado nasofaríngeo https://www.argentina.gob.ar/salud/coronavirus-COVID-19/laboratorio) resulta fundamental para minimizar la posibilidad de falsos negativos (6).

Pruebas de detección de antígenos
Las pruebas de detección de antígenos del SARS-CoV-2, los cuales pueden ser detectados en los primeros cinco días del comienzo de los síntomas, tienen menor sensibilidad que las pruebas de detección del genoma viral. Las pruebas determinan la presencia de los dominios S1 y S2 de la de la proteína S. Dependiendo de la prueba utilizada la detección de antígenos presenta una especificidad aceptable, sin embargo, su sensibilidad no permite descartar el caso, por lo tanto, se requiere de pruebas complementarias para un adecuado uso en salud pública. (23,24). El mayor desarrollo de esta tecnología y su utilización sobre plataformas del tipo “tipo test rápido” eventualmente podrá ser de utilidad en algoritmos de diagnóstico. La ventaja de estas pruebas es que en general requieren de menos 30 minutos para dar un resultado, pueden ser utilizadas directamente en puntos de atención (primer nivel de atención), con poco o sin ningún equipamiento adicional, poseen una muy adecuada especificidad y brindar acceso al diagnóstico para la atención de poblaciones que viven en lugares con barreras para uso de técnicas moleculares, contribuyendo a la interrupción comunitaria mediante el aislamiento de casos diagnosticados. Dentro de las desventajas, un resultado no reactivo (negativo) no permite descartar la infección por virus SARS-CoV-2 y requiere del uso de técnicas moleculares, algunas pruebas necesitan la incorporación de tecnología (ej. un lector prueba rápida por inmunofluorescencia). Las pruebas validación de sensibilidad mostraron resultados promedios al 83,3% (IC95% 66,4, 92,6) en la detección de casos, cuando fueron utilizadas dentro de los 11 días del inicio de los síntomas(28). Otros estudios de validación han reportado resultados de sensibilidad en orden del 84 al 97%, que dependen fundamentalmente de presencia de síntomas y del momento de la toma de muestras a partir del inicio de los mismos. (29).

La sensibilidad de las distintas pruebas rápidas para la detección de antígenos es variable a diferencia de la especificidad que se muestra consistentemente alta. Altas cargas virales (Ct97% y que al momento de implementarlo dicho desempeño sea verificado. El Centro Colaborador para pruebas diagnósticas, FIND (Foundation for Innovative New Diagnostics) para la OMS comprueba el desempeño de test moleculares e inmunológicos para uso en diagnóstico de SARS-CoV-2, en su página web se pueden consultar los desempeños de diferentes kits, https://www.finddx.org/covid-19/.
En lo que respecta a la bioseguridad y el empleo de las pruebas rápidas en puntos de atención, dada la realización de las mismas fuera de una cabina de contención, es necesario realizar una ponderación de riesgos en las prácticas específicas a realizar y disponer de las medidas que sean necesarias para mitigar cualquier riesgo posible. Debe asegurarse el correcto empleo de los equipos de protección de personal y el adecuado descarte de todo el material luego de su utilización.
Uso recomendado de diferentes metodologías según las siguientes variables
En base a sensibilidad, requerimientos de seguridad, equipamientos, entrenamiento de personal y opciones disponibles se propone que el uso de las pruebas se relacione con:
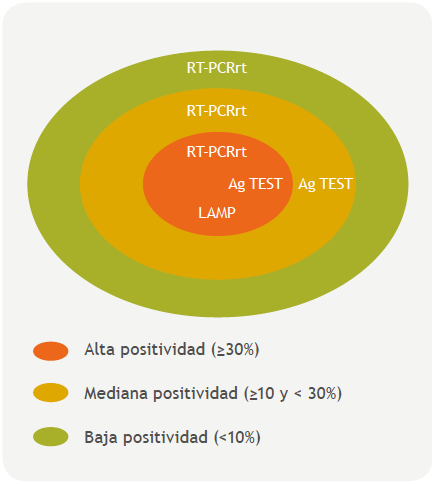
Áreas con transmisión local (comunitaria sostenida o por conglomerados de casos, con casos previamente confirmados por PCR), y/o áreas que experimentan un aumento en la positividad de confirmación de casos sospechosos (≥ 30%).
Áreas que comienzan con los primeros casos confirmados por RT-PCRrt y que presentan barreras geográficas para el acceso al diagnóstico por técnicas moleculares y/o en las que se implementen búsquedas activas territoriales de casos sospechosos/sintomáticos para el aislamiento oportuno (regiones alejadas de centros de diagnóstico molecular; barrios vulnerables, etc.).
Posibles aplicaciones de pruebas serológicas
La utilidad e interpretación de las pruebas serológicas deben ser correctamente utilizadas e interpretadas en función de la situación epidemiológica local, la performance de la metodología y la comunidad que se está estudiando. En este sentido, el diseño de algoritmos adecuados, combinando los tres pilares básicos para la interpretación de los hallazgos (clínica, laboratorio y epidemiología) es fundamental para contar con herramientas que permitan mitigar la expansión del virus en el territorio.
Estimar circulación viral comunitaria
El testeo longitudinal de una población determinada permite estimar la prevalencia e incidencia de exposición de la población al virus, incluso de aquellos individuos que hayan cursado la infección en forma asintomática(10).
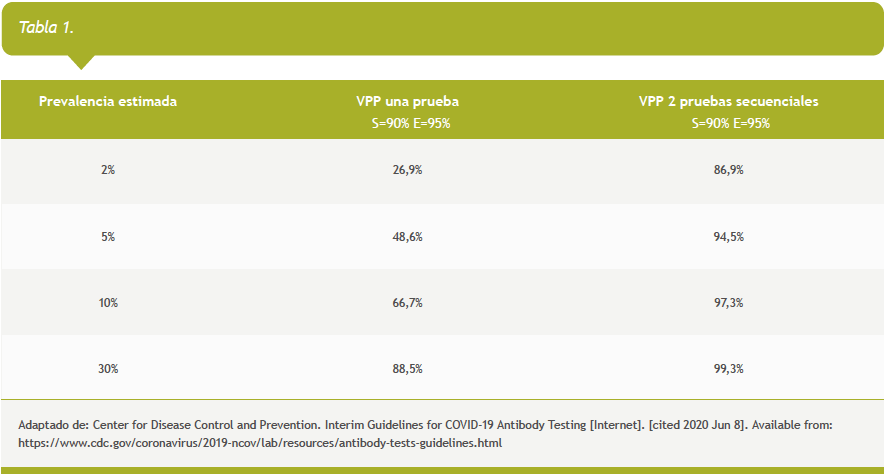
Datos provenientes de revisiones sistemáticas muestran que hay heterogeneidad significativa en la sensibilidad y especificidad de las distintas pruebas serológicas actualmente disponibles (1,2). Adicionalmente, debe tenerse en cuenta los que valores predictivos positivos (VPP) y negativo (VPN) de una prueba serológica individual realizado en forma de tamizaje dependen además de la prevalencia de la enfermedad en la población en la que se aplica. En este sentido, para una misma sensibilidad y especificidad, el valor predictivo positivo de una prueba de tamizaje reactiva cae significativamente si se aplica a una población de baja prevalencia.
Cuando se realice tamizaje con pruebas serológicas en poblaciones de baja prevalencia, puede considerarse el uso de algoritmos que incluyan testeo secuencial para aumentar el valor predictivo positivo (4).
Identificar posibles candidatos a donación de plasma de convalecientes
Partiendo de la premisa de que la inmunoterapia pasiva puede tener un rol en el tratamiento de personas con COVID-19, en la actualidad existen en el país múltiples estudios clínicos que evalúan la eficacia y seguridad del uso de plasma de convalecientes en este escenario (18). El uso de pruebas serológicas cuantitativas puede ayudar a identificar personas candidatas a donación de plasma.
A la fecha, se llevan adelante estudios de investigación para determinar la eficacia del plasma inmune en tratamiento de COVID-19. Estudios realizados en China determinaron que no existiría correlación entre los títulos de anticuerpos neutralizantes (por neutralización viral) en el plasma de convaleciente comparada con la detección cuantitativa de anticuerpos tipo IgG por otras técnicas serológicas, por lo tanto, la detección de anticuerpos tipo IgG totales contra SARS-CoV2 no demostraría la capacidad neutralizante del plasma (26). Sin embargo, y dependiendo del método serológico utilizado, hay publicaciones que demuestran muy buena su correlación, especialmente si utilizan la proteína S. En este sentido, en un documento recientemente publicado en Córdoba se demuestra que un 33% de los individuos recuperados de COVID-19 evaluados no desarrollaron anticuerpos neutralizantes y que, un 42% de ellos, tenían resultados reactivos por las técnicas serológicas para la detección de IgG anti SARS-CoV-2 (27). Aunque aún resta establecerse los protocolos para el eventual uso de la terapia basada en plasma de convaleciente, se recomienda cuando sea posible, realizar la determinación de anticuerpos neutralizantes en los mismos para su correcta utilización terapéutica.
Diagnóstico tardío o retrospectivo
Existe evidencia creciente sobre la asociación entre fenómenos inmunológicos y el antecedente de infección por SARS-CoV-2, en particular cuadros de síndrome inflamatorio multisistémico asociado a COVID 19 en niños y niñas (19–21). Dado que estos cuadros pueden presentarse con PCR negativa, el uso de pruebas serológicas debe considerarse como una herramienta adicional para el diagnóstico retrospectivo de COVID-19 en pacientes en los que se sospechen complicaciones tardías; o en quienes hayan tenido síntomas compatibles con COVID-19 pero se presenten tardíamente con PCR no detectable.
Identificar población susceptible para guiar campañas de vacunación
La posibilidad futura de una vacuna disponible plantearía un desafío en términos de poblaciones a las que sería prioritario inmunizar. El uso de pruebas serológicas de alta especificidad podría ayudar a identificar personas con serología negativa de grupos riesgo que sean candidatos a recibir la vacuna en una primera etapa.

Escenarios no recomendados para la aplicación de pruebas serológicas
Uso en comunidades cerradas o semicerradas
El uso de pruebas serológicas no está recomendado para guiar la organización en cohortes ni como requisito previo a la admisión o derivación en comunidades cerradas o semicerradas en forma rutinaria. En el escenario de brotes en comunidades cerradas o semicerradas en los que la prevalencia esperada en la población sea elevada, debe tenerse en cuenta que es esperable que el valor predictivo positivo de testeo serológico sea mayor que en otros escenarios de baja prevalencia (4,15).
Pasaportes de inmunidad
Algunos países plantearon la posibilidad del tamizaje serológico a escala poblacional para orientar el reinicio de actividades económicas priorizando el retorno de las personas con serología reactiva, partiendo del supuesto de que no pueden contraer ni transmitir la enfermedad.
Adicionalmente a la posibilidad de falsos positivos (especialmente en escenarios de baja prevalencia), es importante destacar que no existe a la fecha información suficiente para asumir que los individuos con serología reactiva presentan inmunidad duradera contra SARS-CoV-2, y que las pruebas serológicas NO deben ser empleadas para guiar el retorno a las actividades laborales o el uso de equipo de protección personal, excepto en el contexto de un ensayo clínico debidamente revisado y aprobado por un comité de ética independiente (4,22).

Referencias Bibliográficas
1. Deeks JJ, Dinnes J, Takwoingi Y, Davenport C, Spijker R, Taylor-Phillips S, et al. Antibody tests for identification of current and past infection with SARS-CoV-2. Cochrane Database of Systematic Reviews [Internet]. 2020 [cited 2020 Jul 15];(6). Available from: https://www.cochranelibrary.com/cdsr/doi/10.1002/14651858.CD013652/full
2. Bastos ML, Tavaziva G, Abidi SK, Campbell JR, Haraoui L-P, Johnston JC, et al. Diagnostic accuracy of serological tests for covid-19: systematic review and meta-analysis. BMJ [Internet]. 2020 Jul 1 [cited 2020 Jul 15];370. Available from: https://www.bmj.com/content/370/bmj.m2516
3. Long Q-X, Liu B-Z, Deng H-J, Wu G-C, Deng K, Chen Y-K, et al. Antibody responses to SARS-CoV-2 in patients with COVID-19. Nat Med. 2020 Apr 29;
4. Center for Disease Control and Prevention. Interim Guidelines for COVID-19 Antibody Testing [Internet]. [cited 2020 Jun 8]. Available from: https://www.cdc.gov/coronavirus/2019- ncov/lab/resources/antibody-tests-guidelines.html
5. Ministerio de Salud de la Nación. Nuevo coronavirus COVID-19 | Laboratorio [Internet]. [cited 2020 Jul 15]. Available from: https://www.argentina.gob.ar/salud/coronavirus-COVID-19/laboratorio
6. World Health Organization. Clinical management of severe acute respiratory infection (SARI) when COVID-19 disease is suspected – Interim guidance [Internet]. 2020 [cited 2020 Mar 18]. Available from: https://apps.who.int/iris/rest/bitstreams/1272156/retrieve
7. Arons MM, Hatfield KM, Reddy SC, Kimball A, James A, Jacobs JR, et al. Presymptomatic SARS-CoV-2 Infections and Transmission in a Skilled Nursing Facility. New England Journal of Medicine. 2020 Apr 24;0(0):null.
8. He X, Lau EHY, Wu P, Deng X, Wang J, Hao X, et al. Temporal dynamics in viral shedding and transmissibility of COVID-19. Nature Medicine. 2020 Apr 15;1–4.
9. Long Q-X, Tang X-J, Shi Q-L, Li Q, Deng H-J, Yuan J, et al. Clinical and immunological assessment of asymptomatic SARS-CoV-2 infections. Nature Medicine. 2020 Jun 18;1–5.
10. Lavezzo E, Franchin E, Ciavarella C, Cuomo-Dannenburg G, Barzon L, Del Vecchio C, et al. Suppression of a SARS-CoV-2 outbreak in the Italian municipality of Vo’. Nature. 2020 Jun 30;1–1.
11. Bullard J, Dust K, Funk D, Strong JE, Alexander D, Garnett L, et al. Predicting infectious SARS-CoV-2 from diagnostic samples. Clin Infect Dis [Internet]. [cited 2020 Jun 1]; Available from: https://academic.oup.com/cid/advance-article/doi/10.1093/cid/ciaa638/5842165
12. Kucirka, L. M., Lauer, S. A., Laeyendecker, O., Boon, D., & Lessler, J. (2020). Variation in False-Negative Rate of Reverse Transcriptase Polymerase Chain Reaction-Based SARS-CoV-2 Tests by Time Since Exposure. Annals of internal medicine, M20-1495. Advance online publication. https://doi.org/10.7326/M20-1495
13. Ministerio de Salud de la Nación. Nuevo coronavirus COVID-19 | Alta de caso de COVID19 [Internet]. 2020 [cited 2020 Jul 15]. Available from: https://www.argentina.gob.ar/salud/coronavirus-COVID-19/alta
14. Wei WE. Presymptomatic Transmission of SARS-CoV-2 — Singapore, January 23–March 16, 2020. MMWR Morb Mortal Wkly Rep [Internet]. 2020 [cited 2020 Apr 14];69. Available from: https://www.cdc.gov/mmwr/volumes/69/wr/mm6914e1.htm
15. World Health Organization. Laboratory testing strategy recommendations for COVID19 [Internet]. 2020 [cited 2020 Apr 14]. Available from: https://apps.who.int/iris/bitstream/handle/10665/331509/WHO-COVID-19-lab_testing2020.1-eng.pdf
16. Ministerio de Salud de la Nación. Identificación y seguimiento de contactos [Internet]. [cited 2020 Jul 3]. Available from: https://www.argentina.gob.ar/salud/coronavirus-COVID19/Identificacion-y-seguimiento-de-contactos
17. Center for Disease Control and Prevention. HEALTH DEPARTMENTS: Interim Guidance on Developing a COVID-19 Case Investigation & Contact Tracing Plan [Internet]. 2020 [cited 2020 Jul 15]. Available from: https://www.cdc.gov/coronavirus/2019-ncov/downloads/caseinvestigation-contact-tracing.pdf
18. Ministerio de Salud de la Nación. Donación de plasma de pacientes recuperados de COVID-19 [Internet]. 2020 [cited 2020 Jul 15]. Available from: https://www.argentina.gob.ar/coronavirus/donacion-de-plasma
19. Licciardi F, Pruccoli G, Denina M, Parodi E, Taglietto M, Rosati S, et al. SARS-CoV-2- Induced Kawasaki-Like Hyperinflammatory Syndrome: A Novel COVID Phenotype in Children. Pediatrics. 2020 May 21;
20. Viner RM, Whittaker E. Kawasaki-like disease: emerging complication during the COVID-19 pandemic. Lancet. 2020 06;395(10239):1741–3.
21. Ministerio de Salud de la Nación. Nuevo Coronavirus COVID-19 | Definición de caso [Internet]. 2020 [cited 2020 Apr 19]. Available from: https://www.argentina.gob.ar/salud/coronavirus-COVID-19/definicion-de-caso
22. World Health Organization. Advice on the use of point-of-care immunodiagnostic tests for COVID-19: scientific brief [Internet]. 2020 [cited 2020 Jun 8]. Available from: https://apps.who.int/iris/rest/bitstreams/1274536/retrieve
23. D’Cruz, R. J., Currier, A. W., & Sampson, V. B. Laboratory Testing Methods for Novel Severe Acute Respiratory Syndrome-Coronavirus-2 (SARS-CoV-2). Frontiers in cell and developmental biology, 8, 468. https://doi.org/10.3389/fcell.2020.00468
24. Organización Panamericana de la Salud. Directrices de laboratorio para la detección y el diagnóstico de la infección por el virus responsable de la COVID-19 [Internet]. [cited 2020 Jul 15]. Available from:https://iris.paho.org/handle/10665.2/52471
25. Hanson, K. E., Caliendo, A. M., Arias, C. A., Englund, J. A., Lee, M. J., Loeb, M., Patel, R., El Alayli, A., Kalot, M. A., Falck-Ytter, Y., Lavergne, V., Morgan, R. L., Murad, M. H., Sultan, S., Bhimraj, A., & Mustafa, R. A. (2020). Infectious Diseases Society of America Guidelines on the Diagnosis of COVID-19. Supplemmet G. Clinical infectious diseases : an official publication of the Infectious Diseases Society of America, ciaa760. Advance online publication. https://doi.org/10.1093/cid/ciaa760
26. Editor-in-Chief, Prof & Yu, Ligen. (2020). Handbook of COVID-19 Prevention and Treatment.
27. Documento Consenso Ministerio de Salud de la provincia Córdoba e Instituto de Virología, FCM, UNC, Junio 2020 disponible en: https://fcm.unc.edu.ar/wpcontent/uploads/2020/07/Documento-Consenso-NT-Cordoba-1-7-2020.pdf 28. Instituto Nacional de Salud, Colombia. Validación secundaria y verificación del desempeño de la prueba “STANDARD TM Q COVID-19 Ag Test Biosensor”. Disponible en: https://www.ins.gov.co/pruebas%20de%20antgenos/1.%20Informe%20de%20validaci%C3%B3n%20STANDARDTM%20Q%20COVID-19%20Ag%20Test%20Biosensor.pdf 29. Center for Disease Control and Prevention. Interim Guidance for Rapid Antigen Testing for SARS-CoV-2. Disponible en: https://www.cdc.gov/coronavirus/2019ncov/lab/resources/antigen-tests-guidelines.html





