Células madre de cordón umbilical: usos clínicos y perspectivas
Patricia Sosa Callejas (1),(2)* y María José Gimeno Longas (2)
(1) Unidad de Bioquímica y Biología Molecular, Departamento de Biología de Sistemas, Facultad de Medicina y Ciencias de la Salud, Universidad de Alcalá, 28871 Alcalá de Henares, Madrid, España. 2 Vidacord, S.L.
TECNOALCALÁ Campus UAH. Edificio ZYE C/ Punto net, 4 bajo dcha. 28805 – Alcalá de Henares
Cita: Sosa P, Gimeno MJ (2014) Células madre de cordón umbilical: usos clínicos y perspectivas. Dianas 3(1): e20140904. ISSN 1886-8746 journal.dianas.e20140904 URI http://hdl.handle.net/10017/15181
Editores: María José Carmena y Alberto Domingo, Departamento de Biología de Sistemas, Unidad de Bioquímica y Biología Molecular, Universidad de Alcalá, Alcalá de Henares, Madrid, España.
* Correspondencia: E-mail: patricia.sosacalle@gmail.com
Resumen
La sangre de cordón umbilical (SCU) se presenta como una fuente alternativa de progenitores hematopoyéticos (PH) frente a la medula ósea, pues posee determinadas características que resuelven los mayores problemas presentes en el uso de PH de médula ósea en terapias celulares. La facilidad y rapidez para obtener una muestra compatible, y la permisividad de incompatibilidad de HLA debido a su baja inmunogenicidad, han hecho que los investigadores de todo el mundo comiencen a usar los PH de la SCU, en lugar de los de médula para los trasplantes. Los bancos de SCU son los encargados de preservar las muestras, permitiendo la creación de una red mundial de donantes que ha aumentado el número de trasplantes no relacionados de manera exponencial a lo largo de los últimos años. El tipo de trasplante de SCU que se realice dependerá de la enfermedad que se quiera tratar, realizándose trasplantes autólogos para hemoglobinopatías adquiridas, tumores sólidos y enfermedades producidas por tóxicos o virus, y trasplantes alogénicos para hemoglobinopatías hereditarias. También en la medicina regenerativa se están produciendo grandes avances; por el uso de la SCU en diversas terapias para enfermedades como el Alzheimer, Parkinson o Huntington, y los nuevos estudios de determinación de los posibles usos de las células mesenquimales procedentes del cordón umbilical. Estas razones hacen del uso de la sangre de cordón uno de los descubrimientos más importantes de los últimos años.
Palabras clave: Célula madre, Trasplante hematopoyético, Sepax-2, CD34+, HLA
Introducción
Las células madre sanguíneas se denominan “progenitores hematopoyéticos”. Estas células son las precursoras de eritrocitos, leucocitos y plaquetas. La principal fuente de los progenitores hematopoyéticos (PH) ha sido siempre la médula ósea, no obstante, desde hace más de 20 años se conocen nuevas fuentes, la sangre periférica y la sangre de cordón umbilical. La obtención de los PH de médula ósea (MO) es un proceso invasivo, que implica la extracción en un quirófano con sus riesgos asociados. En sangre periférica no hay gran número de PH per se, es necesario realizar una movilización previa desde la médula ósea, lo que supone administrar factores de crecimiento en entorno hospitalario durante 5-7 días, para después extraer los PH de interés. La alternativa a estos dos procedimientos es la sangre de cordón umbilical, una fuente rica en PH, que se puede obtener sin riesgos para la madre ni para el feto en el momento del nacimiento del niño.
El trasplante de PH es, a día de hoy, una terapia consolidada ante multitud de enfermedades (enfermedades oncohematológicas, metabólicas, tumores sólidos, enfermedades autoinmunes…), tanto en niños como en adultos. Comenzó su desarrollo desde que se descubriera su utilidad en los años 60 [1].
En sus inicios, esta terapia se desarrolló para pacientes con cáncer hematológico, como alternativa tras tratamientos fallidos de quimioterapia y radiación, y ha evolucionado como terapia para otro tipo de desórdenes. [2]
Desafortunadamente, sólo el 30% de los pacientes tienen un donante HLA compatible, por ello, se empezó a pensar en la sangre de cordón (SCU) como opción válida para solucionar el problema de la baja cantidad de muestras compatibles. Estudios in vitro, realizados por Broxmeyer et al. [3] establecen que la sangre de cordón contiene un número suficiente de células madre hematopoyéticas para ser utilizado en trasplantes tanto autólogos (del propio paciente) como alogénicos (distintos individuos de la misma especie). Gracias a el uso del SCU como fuente de PH, se han realizado alrededor de 25.000 trasplantes de sangre umbilical en todo el mundo desde que Gluckman et al. realizaran el primer trasplante de SCU exitoso en un paciente con anemia de Falconi en 1989 [4].
El proceso de búsqueda de un donante compatible suele demorarse unos 4 meses, lo que puede producir un agravamiento de la enfermedad del paciente y, por tanto, evolucionar hacia un peor pronóstico a largo plazo aunque se reciba el trasplante. Los factores más importantes a tener en cuenta para realizar un trasplante son: el grado de histocompatibilidad entre el donante y el receptor, tipo y grado de enfermedad, peso del paciente, número de células nucleadas (CNT) y CD34+ (PH).
La histocompatibilidad viene determinada por la comparación de los haplotipos de HLA (antígeno leucocitario humano) localizados en el cromosoma 6. Los alelos para el HLA se clasifican en clase I (A,B, C), clase II (DRB1, DQB1, DPB1), en total 6; el grado de igualdad de HLA entre donante y paciente determinará una baja, media o alta aceptación del injerto.
Otro factor a tener en cuenta son las CNTs, pues se estima un mínimo de 2×10^7 de células por cada Kg de peso del receptor. En cuanto al número de células CD34+ necesarias para el trasplante, variará dependiendo de la disparidad de HLA que se tenga, es decir, cuanto mayor sea la disparidad de HLA, mayor cantidad de células madre CD34+ se necesitarán.
En el algoritmo de búsqueda de donantes compatibles, la primera opción son siempre los parientes del paciente (donante alogénico relacionado), si esta opción falla, se hace una búsqueda a nivel mundial de donantes anónimos (donante alogénico no relacionado). Debido al extremo polimorfismo del sistema HLA, solamente un 60% de los pacientes sin un donante familiar (36% de todos los pacientes) encuentran un donante no relacionado compatible. La dificultad en la búsqueda de un donante compatible es aún mayor en pacientes de etnias minoritarias, que viven en países no desarrollados y no tienen acceso a la donación pública ni privada. La creación de esta base de datos mundial ha favorecido un gran aumento del número de trasplantes no relacionados, favoreciendo así el acceso al tratamiento en miles de pacientes que carecen de donantes familiares.
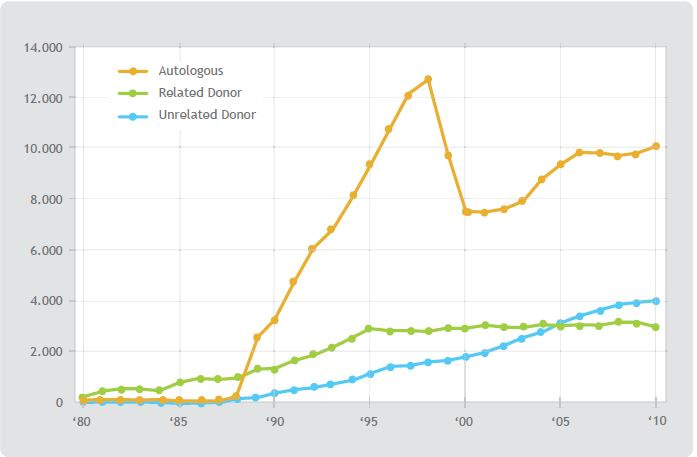
Figura 1 (primer imagen a la derecha). Actividad de transplantes en USA entre los años 1980 – 2010. Comparación entre transplantes autólogos, alogénicos con donantes relacionados, y alogénicos con donantes no relacionados. (www.cibentr.org)
Funcionamiento de un banco de sangre
Las muestras de SCU que llegan al banco de sangre deben pasar una serie de controles antes de ser criopreservadas. No todas las muestras que llegan pueden ser procesadas, han de cumplir criterios mínimos de volumen y celularidad: 45 ml para el volumen y 300 millones de CNTs.
Una vez superados estos puntos de control comienza el procesamiento de la muestra en condiciones de esterilidad. La separación de los distintos tipos celulares se realiza con tecnología de última generación, una plataforma de procesamiento celular denominada Sepax-2, que es capaz de separar las distintas fracciones celulares, CNTs, eritrocitos y el plasma, en un sistema cerrado que combina protocolos de centrifugación con sistemas de detección de fracciones sanguíneas y, que implica una reducción en volumen, el resultado es concentrado de CNTs en una bolsa de 20 mL, este producto constituye la fracción clínicamente útil de la unidad de SCU. La tasa de recuperación del Sepax-2 está entre el 80-90%, dependiendo del volumen de la unidad y de la presencia o no de coágulos, lo que mejora en más de un 20% el procesamiento manual que se venía haciendo antes.
Una vez procesada la muestra en la bolsa final, se realiza de nuevo un contaje para determinar la concentración de CNTs finales. Este valor nos da una estimación de la eficiencia de la tasa de recuperación del proceso.
Tras obtener estos datos se procede al último punto de control antes de la criopreservación de la unidad de SCU, la viabilidad y el recuento de células CD34+. Estos datos los obtendremos mediante citometría de flujo, para la viabilidad se utiliza ADD y, para el recuento de CD34+, se realiza un marcaje celular con anticuerpos CD34/45+, CD45/control, utilizando un kit comercial de Beckman-Coulter, Stem-Kit™ Reagents.
Se considera, de forma general, que en un trasplante van a ser necesarias entre 60.000 y 100.000 células CD34+ por Kg de paciente, por ello se establece un mínimo de 700.000 células CD34+ para que la muestra sea apta para la criopreservación.
Durante el proceso se recogen alícuotas para estudios posteriores: Los hematíes se utilizarán para realizar hemocultivos, aerobios, anaerobios y hongos (este análisis requiere un tiempo de incubación de 5 días para detectar presencia de microorganimos en el cultivo, por lo tanto, la idoneidad de la muestra no se determinará hasta la obtención de los resultados pasado el periodo de incubación); una alícuota del plasma se guardará para posteriores análisis víricos; una alícuotas de sangre del SCU como DNAteca para realizar las pruebas de histocompatibilidad.
La utilización de las unidades de SCU como terapia requiere además, tener un estudio de la serología vírica materna en el momento del parto. Por tanto, se analiza la sangre materna en busca de Hepatis B, Hepatitis C, Virus de la Inmunodeficiencia Humana, Sífilis y Citomegalovirus. Si alguna muestra fuese positiva, se procedería al análisis del plasma de la unidad de SCU por PCR. Si se detecta la presencia de virus activos, la muestra se ha de destruir.
El tipaje HLA de clase II (HLA-DR y -DQ), y eventualmente también el de clase I, se realiza por técnicas moleculares mediante PCR-SSP (amplificación PCR con primers específicos de secuencia) y su visualización mediante electroforesis en geles de agarosa teñidos con bromuro de etidio. Se considerarán como posibles candidatos a donación las unidades que coincidan en 4/6 antígenos del HLA con el receptor.
Fundamentos del Trasplante de Células Progenitoras Hematopoyéticas
El trasplante de PH tiene dos posibles objetivos: sustituir la hematopoyesis del paciente por ser total o parcialmente defectuosa, insuficiente o neoplásica; o para permitir un tratamiento antineoplásico con dosis muy elevadas que origina mielosupresión prolongada o definitiva [5].
En el trasplante de PH a partir de un donante sano, las células inmunocompetentes derivadas del injerto son capaces de establecer una potente respuesta inmunológica contra las células del receptor, lo que se denomina enfermedad injerto contra huésped (EICH). El paciente debe ser sometido a radiación total y/ó quimioterapia para disminuir su respuesta inmune, y en el caso de pacientes con cáncer, para destruir las células malignas. Posteriormente los PH se infunden al receptor y se administraran inmunosupresores para evitar la EICH.
La EICH es una de las causas de mortalidad más elevadas tras un trasplante, por ello es muy importante su control. La probabilidad de que se sufra una EICH dependerá de la disparidad o igualdad de HLA entre el donante y el receptor. Se ha visto que en el trasplante autólogo se eliminan los riesgos por EICH y el tratamiento con inmunosupresores, sin embargo, continúan los riesgos de fallo del injerto y aumenta la probabilidad de infección debido a la baja cantidad de células trasplantadas y a origen naive de sus linfocitos.
Tipos de trasplantes de SCU según el donante y usos clínicos
El trasplante de células madre hematopoyéticas en un procedimiento en el cual se sustituye por completo el sistema inmune y hematopoyético del paciente por las células de donante [6].
Los trasplantes hematopoyéticos pueden clasificarse según el origen de la muestra: medula ósea, sangre periférica y SCU. O de acuerdo con la relación entre el donante y el receptor: los trasplantes en los que los PH son obtenidos de un hermano gemelo univitelino, y por lo tanto con un HLA idénticos se denominan trasplantes singénicos; en el caso de que el donante sea un hermano consanguíneo que ha heredado ambos haplotipos del HLA idénticos a los del receptor, el trasplante se denomina alogénico. El injerto procedente de un donante relacionado con un HLA idéntico es el modelo ideal, sin embargo la posibilidad de encontrar un hermano HLA idéntico no es mayor de un 20-30%. En algunos casos el donante puede ser un familiar no compatible o parcialmente histocompatible (mismatched), a este tipo se le conoce como alogénicos parcialmente compatibles.
Pero un número muy importante de pacientes no cuentan con un donante familiar histocompatible por lo que se han organizado centros internacionales o nacionales cuyo objetivo es localizar donadores sin relación familiar que pudieran ser total o parcialmente histocompatibles con los pacientes. Estas instituciones son los bancos de medula ósea, y en la actualidad también los bancos de SCU. Esto nos permite realizar trasplantes total o parcialmente idénticos de donadores no relacionados. El último caso es cuando el donante y receptor de los PH son el mismo individuo, a este tipo de trasplante se conoce como autólogo.
El porcentaje de igualdad de HLA entre donante y paciente determinará la compatibilidad y el grado aceptación del injerto.
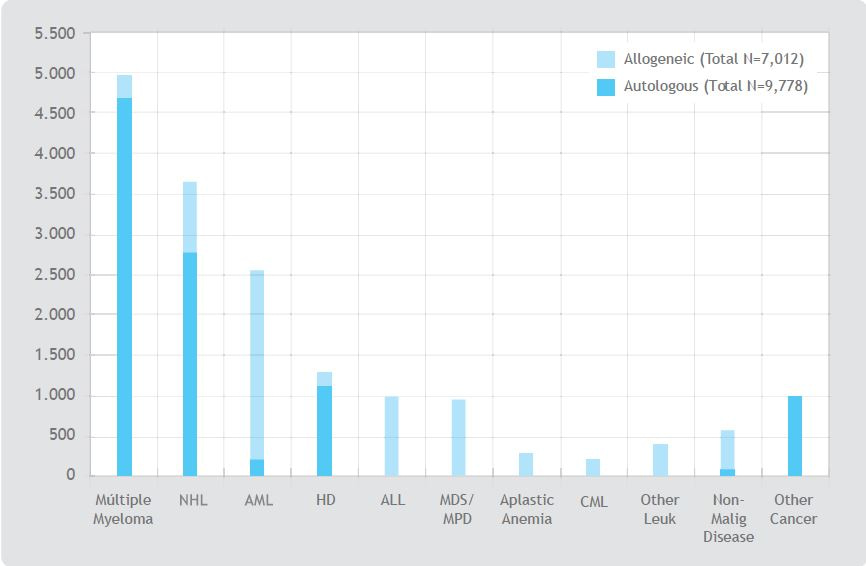
Figura 2 (segunda imagen a la derecha). Indicaciones para los transplantes de células madre hematopoyéticas en Estados Unidos. Center for International Bone Marrow transplant Research (www.cibmtr.org). NHL: Linfoma No Hodgkin, HD: Enfermedad de Hodgkin, AML: Leucemia linfoblástica aguda, MDS/MPD: Síndromes mielodisplásicos, CML: Leucemia mielocítica crónica.
Como se puede observar en la figura.2 el tipo de trasplante varía según la enfermedad del paciente, los trasplantes autólogos se utilizan para leucemias (aguda mieloblástica o linfoblástica), aplasia medular adquirida, tumores sólidos (retinoblastoma, neuroblastoma…), enfermedades producidas por tóxicos, irradiación, virus… a su vez los trasplantes alogénicos se utilizan para tratar leucemias (aguda, crónica y síndrome mielodisplásico), linfomas (Hodgkin y no Hodgkin) y enfermedades hematopoyéticas (anemias, inmunodeficiencias, enfermedad hereditaria metabólica…).
Aún se siguen investigando posibles utilidades de la SCU, pues no sólo contiene células madre hematopoyéticas, sino también células endoteliales, mesenquimales, células dendríticas, células reguladoras de los linfocitos T y natural killers.
En medicina regenerativa se están llevando a cabo una serie de ensayos para estudiar las posibles aplicaciones de la SCU. Entre ellos destacan ensayos para parálisis cerebral, autismo, diabetes, esclerosis múltiple, daños cerebrales por traumatismos… encontrándose estos en las primeras y segundas fases de investigación. Por otra parte, ya se están utilizando los trasplantes de SCU en tratamientos experimentales para enfermedades como el Alzheimer, daño hepático, coronario y espinal…
Ventajas y desventajas de la SCU frente a la MO y la sangre periférica
El aumento de uso de la sangre de cordón frente a la medula ósea o la sangre periférica se debe a las cualidades ventajosas de este.
Una de las ventajas más importante de la sangre de cordón es la forma de obtención de los PH y la disponibilidad. La extracción de los PH de la sangre de cordón es el método más sencillo puesto que no se necesita una intervención quirúrgica, como en la medula ósea; ni el uso de factores de crecimiento para la movilización de sangre, como en la obtención de PH en sangre periférica; la extracción se realiza mediante una punción del cordón umbilical tras el parto, por lo que además de ser un método sencillo también es indoloro y no existe riesgo alguno para la madre ni el feto. Esta facilidad de obtención de la muestra y rápida disponibilidad de la misma soluciona el problema del agravamiento de la enfermedad en la búsqueda de un donante compatible.
Otra ventaja muy importante de los trasplantes con SCU es que permiten un alto grado de disparidad de HLA, debido a la mayor tolerancia inmunológica. En un trasplante de SCU se permite hasta 3/6 o 4/6 de incompatibilidad de HLA, mientras que en un trasplante de MO la incompatibilidad de HLA permitida es de 5/6 o 6/6. Se ha observado que en los trasplante SCU con HLA idéntico se producen alrededor de un 14% de EICH, y en los trasplantes de MO este porcentaje aumenta hasta un 24% [7], lo cual nos indica que esta mayor tolerancia inmunológica también ha hecho posible una reducción en la incidencia y la gravedad de la enfermedad injerto contra huésped (EICH) comparado con las otras modalidades de trasplante. [3]
A pesar de las múltiples ventajas del trasplante de SCU también es necesario conocer sus limitaciones para poder proporcionar el mejor tratamiento para el paciente. Ya que debido a alguna de sus características es posible que el trasplante de PH de medula ósea o sangre periférica sea más efectivo que el de PH procedentes de sangre de cordón.
La principal limitación a tener en cuenta a la hora de realizar un trasplante de SCU es el bajo número de células madre que posee, debido a que son necesarias alrededor de 2×10^7 células nucleadas del cordón por cada kg de peso del receptor [4], lo que va a provocar en uso limitado de los trasplantes de SCU en adultos de más de 60Kg. Esta baja cantidad de células nucleadas va a generar además, una lenta reconstitución hematológica y del sistema inmune, produciéndose por ello un alto riesgo de mortalidad relacionada con el trasplante [8]. Este problema fue observado por Rocha e investigadores de Eurocord y el Registro Internacional de trasplantes de Medula [9] cuando realizaron un experimento en el que realizaban un análisis multivariable con pacientes que recibieron trasplantes de medula y de cordón.
Observaron que a pesar de una disminución del riesgo de sufrir EICH agudo o crónico por parte de los pacientes que recibieron el trasplante de SCU, pasado un mes presentaban una recuperación más lenta del número de plaquetas y neutrófilos que los pacientes con trasplante de médula, demostrando así que el prendimiento del injerto con SCU es más lento que el de médula ósea.
Otras desventajas importantes del trasplante con SCU son la posibilidad de trasmisiones de enfermedades hereditarias, y la imposibilidad de realizar un segundo trasplante.
Para solucionar aspectos no resueltos como reducir la mortalidad ó potenciar el prendimiento del injerto, se están probando distintas estrategias, como el trasplante doble de cordón umbilical, la inyección intraósea y la expansión ex vivo. Entre ellos destaca el doble trasplante de cordón umbilical, muchos grupos e investigación han publicado sus resultados utilizando esta técnica [10,11,12]; estos estudios muestran que pacientes en condiciones mieloablativas seguidas de una transfusión doble de SCU está asociado a una aceptable aumento en el prendimiento del injerto y una mayor supervivencia, a pesar de una aumento en la probabilidad de sufrir EICH [2]. En el caso de la infusión intra-ósea se soluciona la perdida de PH debido al desprendimiento del injerto, pues con esta técnica pueden ser retenidos en otros órganos tras la inyección; además gracias al contacto inmediato de los linfocitos con las células memoria efectoras y menor contacto con las células presentadoras de antígeno se va a generar un menor número de casos de EICH [13]. En el caso de la expansión “ex vivo” se producirá un prendimiento más rápido del injerto, generándose un aumento de los PH de la SCU.
Usos potenciales del cordón umbilical: células mesenquimales
Las células mesenquimales (MSCs) poseen una gran capacidad proliferativa in vitro y bajo condiciones apropiadas de cultivo se puede inducir su diferenciación en múltiples linajes, incluidos hueso (osteoblastos), grasa (adipocitos) y cartílago (condrocitos) [14]. La fuente principal de MSCs es el tejido de cordón umbilical (TCU), aunque también puede obtenerse en menor medida de la medula ósea.
Dentro del cordón umbilical podemos localizar células mesequimales en diferentes regiones, lo que les marca características diferenciales. En el epitelio amniótico, la región más externa del cordón, las MSC tienen algunas características de células epiteliales, forma aplanada y positividad para citoqueratinas. En la región perivascular, la región más próxima al vaso sanguíneo en el cordón, encontramos MSC con características de las células musculares lisas, morfología fusiforme, positividad para desmina… estas características en las células de ambas regiones les confieren una mayor especialización y por lo tanto un menor potencial de diferenciación. Por último, en la región intervascular, localizada entre la región perivascular y el epitelio amniótico, encontramos células fusiformes, citoqueratina negativas, estas MSC están menos especializadas y por lo tanto tienen un mayor potencial de diferenciación.
Estudios recientes sugieren que las MSC podrían diferenciarse en tipos celulares no pertenecientes a los tejidos esqueléticos, como células nerviosas, células del hígado y células endoteliales que formarían vasos sanguíneos. Estos resultados aún no están confirmados ya que podrían ser debidos a productos químicos usados para el crecimiento celular en los medios de cultivo, y por lo tanto sería un artefacto, pero si se confirmarán abrirían un nuevo campo de estudio para la medicina regenerativa. Sin embargo, este área de estudio no está tan desarrollado como el de la SCU, y todos los estudios que encontramos sobre los usos clínicos de las MSCs son experimentales.
Algunos de los estudios con células mesenquimales que se están realizando en la actualidad son:
- Reparación de cartílago y hueso, gracias a la capacidad de las MSC en diferenciarse hacia osteoblastos y condrocitos.
- Reparación de tejido cardiaco y vascular: algunos estudios indican que las MSC podrían promover neovascularización, no por ellas mismas, sino colaborando con otras células, por ejemplo, incrementando la concentración de proteínas que estimulan el crecimiento de las células precursoras endoteliales. Reparando así daños vasculares producidos por ataques al corazón o isquemias.
- Enfermedades inflamatorias y autoinmunes, algunos estudios sugieren que las MSCs podrían ser capaces de reducir la velocidad de multiplicación de las células del sistema inmune en el cuerpo gracias a su capacidad inmunomoduladora… lo que reduciría la inflamación y ayudaría a evitar el rechazo de trasplantes y las enfermedades autoinmunes. (eurostemcell.org).
Otro posible uso que se está investigando es el cotrasplante de SCU con MSC. En la tabla 1 observamos como la cantidad de unidades formadoras de colonias aumenta si se cotrasplantan de CD34+ y MSC, con respecto a un trasplante de CD34+ únicamente. Estos datos nos indican que las MSC podrían facilitar el prendimiento de los PH, aumentando la velocidad del injerto.
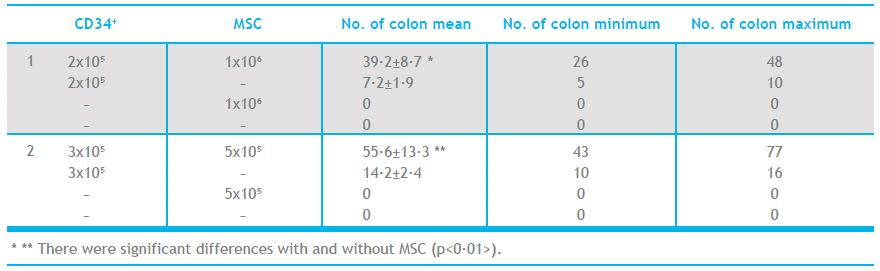
Tabla 1 (tercer imagen a la derecha). Comparación del número de colonias en un bazo irradiado de ratón tras un trasplante de CD34+ y MSC 11 días después. Hematology 2009 VOL 14 nº 3 125
Con los datos anteriormente expuestos podría concluirse, a pesar de la falta de estudios que determinen definitivamente la superioridad de la SCU como fuente de células madre, y de la necesidad de nuevas estrategias para mejorar la recuperación hematológica y el prendimiento, que el cordón umbilical es una fuente de células efectivas para el tratamiento de hemopatías, especialmente en pacientes sin un donante relacionado compatible, permitiendo un trasplante rápido y eficaz que mejore el pronóstico del receptor.
Por tanto, la preservación de muestras de SCU en los bancos de sangre va a permitir, no sólo la posibilidad de un tratamiento 100% compatible para los pacientes que necesiten trasplantes hematológicos, sino la continuación de multitud de investigaciones en medicina regenerativa para futuras terapias, contribuyendo finalmente a una mejora en la calidad de vida a nivel mundial.
Agradecimientos
Quiero agradecer a mis compañeras de Vidacord, y en especial a mi tutora, su generosidad y paciencia al enseñarme a trabajar con estas muestras tan especiales.
REFERENCIAS BIBLIOGRÁFICAS
1. Pasquini, M.C, Wang. Z. 2011. Current use and outcome of hematopoietic stem cell transplantation: CIBMTR Summary Slides 2011
2. Barriga, F et al. 2012. Hematopoyetic stem cell transplantation: clinical use and perspectives. Biol Res. 45:307-316, 2012
3. Brown, J. and Boussiotis, V.A. 2008. Umbilical Cord Blood Transplantation: Basic Biology and Clinical Challenges to immune Reconstitution. Clin Immunol, 127(3): 286–297.
4. Butler, M. G and Menitove, J. E. 2011. Umbilical cord blood banking: an update. Stem Cell Biology. 28:669–676
5. Gaytan Morales, F et al. 2011. Protocolo de trasplante de células progenitoras hematopoyéticas. Departamento de oncología pediátrica. Hospital infantil Federico Gómez, Mexico.
6. Copelan, E. A. 2006. Hematopoietic stem-cell transplantation. N Engl J Med 354:1813-1826.
7. Barker, J.N, Davies, S.M, DeFor T, Ramsay, N.K, Weisdorf, D.J, Wagner, J.E. 2011. Survival after transplantation of unrelated donor umbilical cord blood is comparable to that of human leukocyte antigen-matched unrelated donor bone marrow: results of a matched-pair analysis. Blood 97:2957–2961.
8. Gluckman, E, Rocha V, Boyer-Chammard A, Locatelli F, Arcese W, Pasquini R, Ortega J, Souillet G, Ferreira E, Laporte JP, Fernandez M, Chastang C. 1997. Outcome of cord-blood transplantation from related and unrelated donors. Eurocord Transplant Group and the European Blood and Marrow Transplantation Group. N Engl J Med 1997; 337:373–381.
9. Rocha, V, Wagner, J.E Jr, Sobocinski, K.A, Klein, J.P, Zhang, M.J, Horowitz, M.M, Gluckman E. 2000. Graft-versus-host disease in children who have received a cord-blood or bone marrow transplant from an HLA-identical sibling. Eurocord and International Bone Marrow Transplant Registry Working Committee on Alternative Donor and Stem Cell Sources. N Engl J Med 2000;342:1846–1854
10. Barker, J.N, Weisdorf, D.J, Defor, T.Em Blazar, B.R, Miller, J. S, Wagner, J.E. 2003. Rapid and complete donor chimerism in adult recipients of unrelated donor umbilical cord blood transplantation after reduced-intensity conditioning. Blood 102:1915-1919
11. Brunstein, C.G, Gutman, J.A, Weisdorf, D.J, Woolfrey, A.E, Derfor, Gooley, T.A, , Verneris, M.R, Appelbaum, F.R, Wagner, J.E, Delaney, C. 2010. Allogeneic hematopoietic cell transplantation for hematologic malignancy: relative risks and benefits of double umbilical cord blood. Blood 116:4693-4699
12. Gutman, J.A, Turtle, C.J, Manley, T.J, Heimfeld, S, Bernstein, I.D, Riddell, S.R, Delaney, c. 2010. Single-unit dominance after double-unit umbilical cord blood transplantation coincides with a specific CD8+ T-cell response against the nonengrafted unit. Blood 115:757-765
13. Frassoni et al. Lancet. 2008. Direct intrabone transplant of unrelated cord-blood cells in acute leukaemia: a phase I/II study. Oncol 9: 831
14. Broxmeyer, H.E. 2010. Umbilical Cord Transplantation: Epilogue. Semin Hematol. 97–103







