Capacidad de los laboratorios nacionales de referencia en Latinoamérica para detectar mecanismos de resistencia emergentes
Alejandra Corso2, Leonor Guerriero2, Fernando Pasterán2, Paola Ceriana2, Raquel Callejo3, Mónica Prieto3, Ezequiel Tuduri1, Horacio Lopardo4, Carlos Vay5, Jorgelina Smayevsky6, Marta Tokumoto7, Jorge Matheu Álvarez8, Pilar Ramón Pardo8, Marcelo Galas2 y participantes del LAEQAS
Rev. Panam Salud Pública. 2011;30(6):619–26
1Estos datos fueron presentados parcialmente como póster en: 3rd Edition World Healthcare Associated Infection Forum (27–29 de junio de 2011; Annecy, Francia) y en la Conferencia Internacional sobre Prevención y Control de Infecciones (29 de junio al 2 julio de 2011; Ginebra, Suiza).
2Administración Nacional de Laboratorios e Institutos de Salud (ANLIS) “Dr. Carlos G. Malbrán”, Instituto Nacional de Enfermedades Infecciosas (INEI), Departamento de Bacteriología, Servicio
Antimicrobianos, Buenos Aires, Argentina. La correspondencia debe dirigirse a Alejandra Corso. Correo electrónico: acorso@anlis.gov.ar
ANLIS “Dr. Carlos G. Malbrán”, INEI, Departamento Bacteriología, Servicio Bacteriología Especial, Ciudad Autónoma de Buenos Aires (CABA), Argentina.
RESUMEN
Objetivo. Evaluar la capacidad de 17 laboratorios nacionales de referencia que participan en el Programa Latinoamericano de Control de Calidad en Bacteriología y Resistencia a los Antimicrobianos (LA-EQAS) para detectar mecanismos de resistencia emergentes, a saber: resistencia de enterobacterias a carbapenemes por presencia de Klebsiella pneumoniae carbapenemasa (KPC); resistencia de enterobacterias a carbapenemes por presencia de metalobetalactamasas (MBL) tipo IMP, y resistencia intermedia a vancomicina de aislamientos de Staphylococcus aureus (VISA).
Métodos. Se enviaron los siguientes tres aislamientos a los 17 laboratorios participantes del LA-EQAS: Klebsiella pneumoniae OPS-161 productor de KPC, Enterobacter cloacae OPS-166 productor de IMP y S. aureus OPS-165 con resistencia intermedia a vancomicina.
Se evaluó la interpretación de las pruebas de sensibilidad y detección del mecanismo de resistencia y el tamaño de los halos de inhibición (método de difusión por discos) o valor de la concentración inhibitoria mínima (CIM).
Resultados. La concordancia en la detección de los mecanismos de resistencia fue de 76,4%, 73,3% y 66,7% con respecto a la cepas K. pneumoniae OPS-161, E. cloacae OPS-166 y S. aureus OPS-165, respectivamente. La concordancia entre las zonas de inhibición obtenidas por los laboratorios participantes y los rangos establecidos por el laboratorio coordinador fue aceptable en los tres aislamientos, ya que alcanzó 90,8%, 92,8% y 88,9%, respectivamente, para cada cepa.
Conclusiones. La concordancia global en la detección de los mecanismos de resistencia KPC, MBL y VISA fue de 72,1%. Consideramos que los laboratorios nacionales de referencia de América Latina son capaces de reconocer estos mecanismos de resistencia emergentes y se espera que en el futuro la concordancia alcance su nivel máximo.
Palabras clave: Control de calidad; farmacorresistencia microbiana; enterobacteriaceae; Klebsiella pneumoniae; Staphylcoccus aureus; control de medicamentos y narcóticos; ensayos de aptitud de laboratorios; América Latina.
En 1996, la Organización Panamericana de la Salud (OPS) organizó la Red Latinoamericana de Vigilancia de la Resistencia a los Antimicrobianos (ReLAVRA) con el fin de obtener datos microbiológicos fidedignos, oportunos y reproducibles para mejorar la atención del paciente y de fortalecer la vigilancia mediante programas de garantía de calidad sostenibles (1). Esta Red brinda información clave para elegir el tratamiento empírico de las infecciones y diseñar estrategias locales y regionales de utilización de antimicrobianos (2). Para asegurar y mantener la calidad de los resultados, es fundamental disponer de procedimientos para evaluar continuamente la calidad de las pruebas y el desempeño del personal de laboratorio.
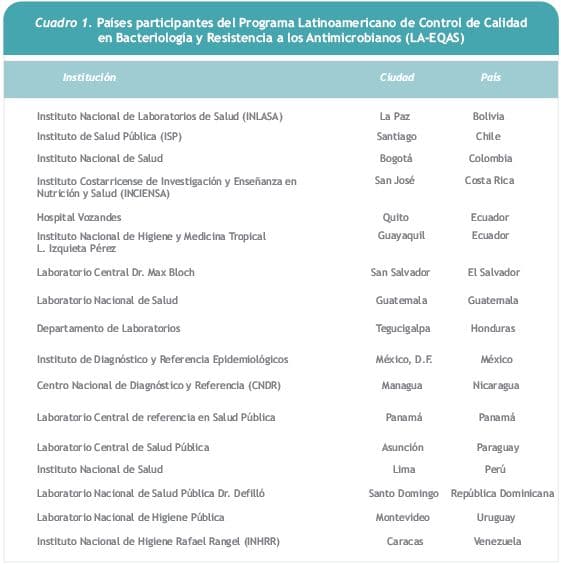
Con ese fin, en el año 2000 se inició el Programa Latinoamericano de Control de Calidad en Bacteriología y Resistencia a los Antimicrobianos (LA-EQAS), en el cual actualmente participan 17 laboratorios de 16 países de la Región (Cuadro 1) y es coordinado por el Servicio de Antimicrobianos del Instituto Nacional de Enfermedades Infecciosas, ANLIS Dr. Carlos G. Malbrán, Buenos Aires, Argentina (laboratorio coordinador). El laboratorio coordinador se desempeña además como laboratorio de referencia en la Región para las pruebas de sensibilidad a los antimicrobianos.
En las 17 encuestas del LA-EQAS realizadas entre 2000 y 2010 se enviaron un total de 170 aislamientos bacterianos de 65 especies y 29 mecanismos de resistencia a los antimicrobianos (3). Entre las tareas más complejas del LAEQAS están el fortalecimiento de la detección e informe de los mecanismos de resistencia de mayor dificultad diagnóstica y la capacitación sobre la detección de resistencias emergentes.
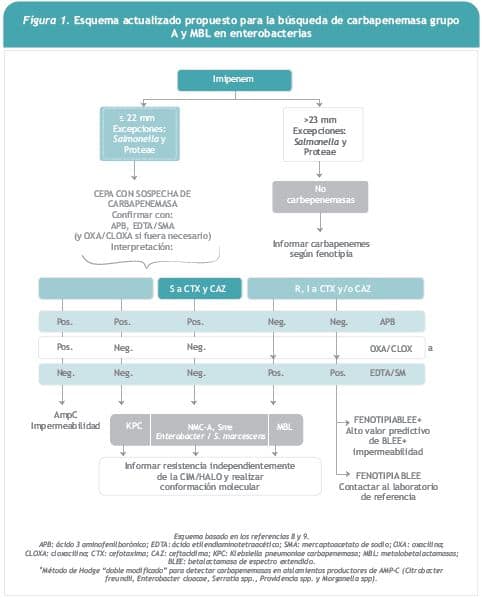
Frente a la reciente aparición de aislamientos de enterobacterias productoras de Klebsiella pneumoniae carbapenemasa (KPC) y metalobetalactamasas (MBL) en América Latina, el laboratorio coordinador difundió un documento de alerta nacional con el propósito de promover la búsqueda de esas carbapenemasas (4–12). En ese documento se propuso un algoritmo basado en un tamizaje inicial que utiliza las zonas de inhibición de imipenem y el efecto inhibitorio del ácido 3-aminofenilborónico (APB) sobre las serinocarbapenemasas del grupo A (KPC) y de agentes quelantes de zinc sobre las MBL (Figura 1) (13–16). Simultáneamente se detectaron en Argentina y Brasil los primeros aislamientos de Staphylococcus aureus con resistencia intermedia a vancomicina (VISA) (17–19).
Ante la aparición de tales mecanismos de resistencia y su diseminación potencial en América Latina, en la encuesta 17 del LA-EQAS (2010) se envió un panel de cepas para evaluar la capacidad de detección e informe de la resistencia de enterobacterias a carbapenemes por presencia de KPC y de MBL tipo IMP, y la VISA
MATERIALES Y MÉTODOS
Este es un estudio de carácter prospectivo, observacional y descriptivo.
Caracterización fenotípica y molecular de los aislamientos
La estructura y funcionamiento del LA-EQAS, el criterio de selección de los aislamientos, la colección y procesamiento de resultados, la evaluación de indicadores de calidad e informe de resultados se realizaron de acuerdo a lo publicado previamente (3). En la encuesta 17 se enviaron 10 aislamientos (OPS-161 a OPS-170) para la identificación bacteriana y las pruebas de sensibilidad a los antimicrobianos. El panel contenía tres aislamientos con mecanismos mergentes: K. pneumoniae OPS-161 (KPC) y Enterobacter cloacae OPS-166 (MBL tipo IMP) para evaluar la detección de carbapenemasas y S. aureus OPS-165 (VISA) (11, 12, 18). El perfil de sensibilidad a los antimicrobianos se determinó e interpretó por el método de difusión y concentración inhibitoria mínima (CIM) según las normas del Instituto de Estándares Clínicos y de Laboratorio (CLSI, por su sigla en inglés) (15, 20–22) y según el algoritmo para la búsqueda de carbapenemasas (Figura 1) (13–16). La resistencia a tigeciclina se interpretó según las normas del Comité Europeo sobre Pruebas de Susceptibilidad a los Antimicrobianos (EUCAST, por su sigla en inglés) 2010 (23).
La caracterización molecular de las cepas K. pneumoniae OPS-161 y E. cloacae OPS-166 se efectuó mediante la técnica de reacción en cadena de la polimerasa (PCR) y secuenciación (6, 11, 24, 25). Los resultados de la secuenciación confirmaron la presencia de los genes blaKPC-2 en la cepa OPS-161 y blaPER-2 y blaIMP-8 en la cepa OPS-166. La CIM de imipenem y meropenem frente a la cepa K. neumoniae OPS-161 fue de 4ug/mL y 8ug/mL, respectivamente, que se redujo a 0,25ug/mL en presencia de APB (0,3 mg/mL concentración final).
El aislamiento presentaba resistencia a cefotaxima (CIM 32 ug/mL), gentamicina (CIM 32 ug/mL) y ciprofloxacina (CIM 64 ug/mL), y sensibilidad a tigeciclina (CIM 1 ug/mL). La CIM de imipenem y meropenem frente a la cepa E. cloacae OPS-166 fue de 1 ug/mL, que se redujo a menos de 0,125 ug/mL en presencia de ácido etilendiaminotetraacéico (EDTA) (0,4 mM concentració final). El aislamiento presentaba resistencia a ertapenem (CIM 2 ug/mL), gentamicina (CIM ?16 ug/mL), cloranfenicol (CIM >= 128 ug/mL), trimetoprima/sulfametoxazol (CIM 32 ug/mL) y a todas las penicilinas, cefalosporinas y monobactames, debido a la portació de betalactamasa de espectro extendido (BLEE) tipo PER-2.
La cepa S. aureus OPS-165 era un aislamiento hospitalario resistente a meticilina con ausencia de halo de inhibición para oxacilina y cefoxitina; presentaba fenotipo de resistencia VISA (CIM 4–8 ug/mL) con CIM de vancomicina de 4 ug/mL, que corresponde a resistencia intermedia (18). Este valor de CIM fue reproducible en dilución en agar, macrodilución en caldo, Vitek2 (bioMerieux) métodos de gradiente E-test (bioMerieux) y MICE (Oxoid). El fenotipo VISA fue confirmado por Macro E-test y E-test GRD VAN/TEI. Este aislamiento presentaba resistencia a gentamicina (CIM >= 16 ug/mL), rifampicina (CIM >= 32 ug/mL), eritromicina (CIM >= 8 ug/mL), clindamicina (CIM >= 8 ug/mL) y ciprofloxacina (CIM >= 8 ug/mL) y sensibilidad a teicoplanina (2 ug/mL), minociclina (CIM menor oigual a 0,5 ug/mL), nitrofurantoía (CIM 32 ug/mL), trimetoprima/sulfametoxazol (CIM 2 ug/mL) y linezolid (CIM 2 ug/mL).
Evaluación e indicadores de calidad de las pruebas de sensibilidad
Los parámetros evaluados fueron la interpretación de las pruebas de sensibilidad y detección del mecanismo de resistencia y el tamaño de los halos de inhibición o el valor de la CIM.
Como indicadores de calidad se usaron la concordancia en la interpretación y la concordancia en la medida de los halos de inhibición con los rangos de referencia establecidos por el laboratorio coordinador. En el caso de las pruebas por dilución, se consideró correcta la concordancia en la interpretación. La concordancia esencial se definió como el valor de la CIM informada por el laboratorio coordinador ± 1 dilución.
Para establecer los rangos de las zonas de inhibició se aplicaron los principios estadíticos del documento de consenso regional (26), como sigue: los rangos aceptables de los halos de inhibición se obtuvieron del análisis estadístico de al menos 30 repeticiones de la prueba. Para la evaluación del tamaño de los halos de las pruebas de sensibilidad, se consideró aceptable la media aritmética ± 2 desviaciones estádar obtenida con un mínimo de ± 3 mm. En el caso de aislamientos sin halo se consideró aceptable la ausencia de zona de inhibición (6 mm).
Se evaluaron los errores en la interpretación de las pruebas de sensibilidad, que se clasificaron en menor (discrepancia relacionada con la categorí de interpretacióa intermedia); grave (clasificación de una cepa sensible como resistente), y muy grave (clasificación de una cepa resistente como sensible) (27).
La concordancia esperada en la interpretación de las pruebas de sensibilidad para un laboratorio de referencia es >= 90,0%, y para los rangos de los halos de inhibición, >= 80,0%.
RESULTADOS
Detección de KPC en la cepa K.pneumoniae OPS-161
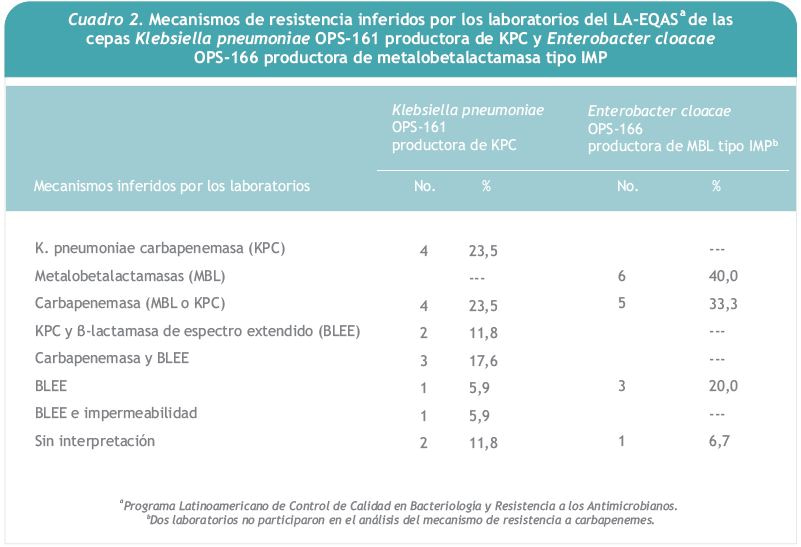
Se consideraron respuestas correctas el informe de KPC o carbapenemasa (con o sin informe de BLEE). De los 17 laboratorios, 13 (76,4%) informaron correctamente la presencia de carbapenemasa; de ellos, 6 (46,1%) informaron KPC por observación de efecto inhibitorio entre carbapenemes y APB (Cuadro 2). Siete laboratorios (41,2%) infirieron la presencia de carbapenemasa, sin especificar el tipo, con base en la zona de inhibición de imipenem menor o igual a 22 mm y el resultado positivo del método de Hodge. A pesar de que la cepa no era portadora de BLEE, cinco laboratorios dedujeron erróneamente la presencia simultánea de BLEE y KPC o BLEE y carbapenemasa al observar una inhibición moderada por ácido clavulánico, característica de la familia KPC.
De los 4 laboratorios (23,5%) que no detectaron carbapenemasa, 2 indicaron un mecanismo incorrecto: BLEE o BLEE más impermeabilidad; los 2 restantes no enviaron comentario. La concordancia en la interpretación de las pruebas de sensibilidad varió según el antibiótico analizado: 100% para cefotaxima, ciprofloxacina y gentamicina; 80,0% para tigeciclina, y 71,4% para imipenem y meropenem. La mayoría de los errores detectados en la interpretación estuvieron asociados a los carbapenemes. En el informe de la sensibilidad a imipenem hubo dos errores muy graves y dos menores, y con respecto a meropenem, uno muy grave y dos menores. En el informe de tigeciclina hubo un error menor.
La Figura 2 muestra los rangos de referencia para las pruebas de difusión. La concordancia de los halos de inhibición con el rango de referencia fue de más de 80,0% para todos los antibióticos.
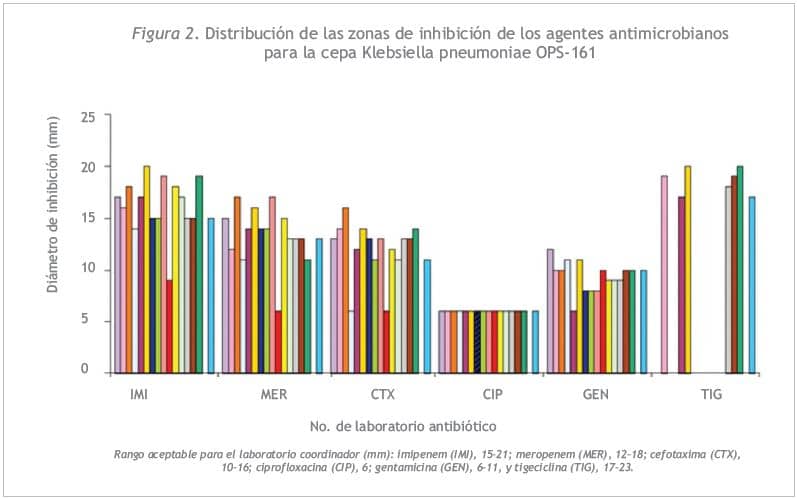
Detección deMBL en cepa de E. cloacae OPS-166
En dos laboratorios esta cepa carecía de MBL por pérdida del plásmido, probablemente debido a repiques sucesivos después de la apertura. Estos dos laboratorios no fueron incluidos en los análisis de los carbapenemes. En la detección del mecanismo de resistencia se consideraron respuestas correctas el informe de MBL o carbapenemasa.
Once laboratorios (73,3%) informaron correctamente esta cepa como portadora de carbapenemasa, de ellos, 6 (40,0%) informaron la presencia de MBL según la inhibición observada entre los discos de EDTA y los carbapenemes; los 5 restantes (33,3%) informaron la presencia de carbapenemasa sin especificar el tipo, con base en un halo de imipenem menor o igual a 22 mm y el resultado positivo del método de Hodge (cuadro 2). Tres laboratorios (20,0%) informaron únicamente la presencia de BLEE y el laboratorio restante no indicó el mecanismo de resistencia.
La concordancia en la interpretación de las pruebas de sensibilidad fue de 100% para ceftazidima y cefotaxima; 84,6% para imipenem; 88,9% para ertapenem; 69,2% para meropenem, y 38,5% para amikacina, respecto de la cual hubo seis errores menores y dos graves. En el informe de la sensibilidad a imipenem hubo un error muy grave y uno menor; en el de meropenem, dos muy graves y dos menores, y en el de ertapenem uno menor. No hubo errores con respecto a ceftazidima ni cefotaxima.
En la Figura 3 aparecen los rangos de referencia para las pruebas de difusión de la cepa E. cloacae OPS-166. Las zonas de inhibición estuvieron dentro de los rangos esperados para todos los antibióticos. El porcentaje de concordancia de los halos de inhibición con el rango de referencia fue de más de 80,0% para todos los antibióticos.
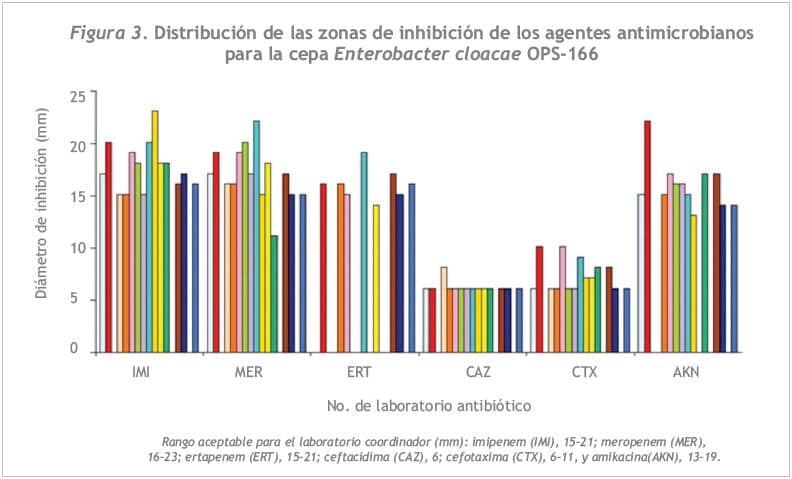
Detección de resistencia intermedia a vancomicina en la cepa S. aureus OPS-165
Este aislamiento tenía una CIM de 4 ug/mL frente a vancomicina, que corresponde a resistencia intermedia, interpretació que se considerócorrecta, al igual que los valores de CIM 4 ug/mL y 8 ug/mL. De los 17 laboratorios, 15 evaluaron la CIM a vancomicina. De ellos, 10 (66,7%) informaron correctamente la CIM intermedia y cinco, sensible (33,3%), ya que obtuvieron valores de CIM de 2 ug/mL e incurrieron, por lo tanto, en errores menores. La mayoría de los laboratorios que evaluaron la CIM (13/15) tuvieron una concordancia esencial de 86,7%. Los métodos empleados para la determinación de la CIM a vancomicina fueron E-test (12 laboratorios), métodos automatizados (2 laboratorios) y dilución en agar (1 laboratorio).
La concordancia en la interpretación de las pruebas de sensibilidad fue de 100% para rifampicina y trimetoprima/sulfametoxazol, 94,1% para gentamicina y 90,9% para linezolid. Todos los laboratorios detectaron e informaron correctamente la cepa como resistente a meticilina. Hubo dos errores graves, uno con respecto a gentamicina y otro con linezolid.Los rangos de referencia para las pruebas de difusión de la cepa S. aureus OPS-165 se presentan en la Figura 4. Las zonas de inhibición estuvieron dentro de los límites esperados para todos los antibióticos ensayados, aunque tres laboratorios informaron valores superiores al rango de referencia para trimetoprima/sulfa-metoxazol y dos laboratorios, para cefoxitina y gentamicina. La concordancia de los halos de inhibición con el rango de referencia fue de más de 80,0% para todos los antibióticos.
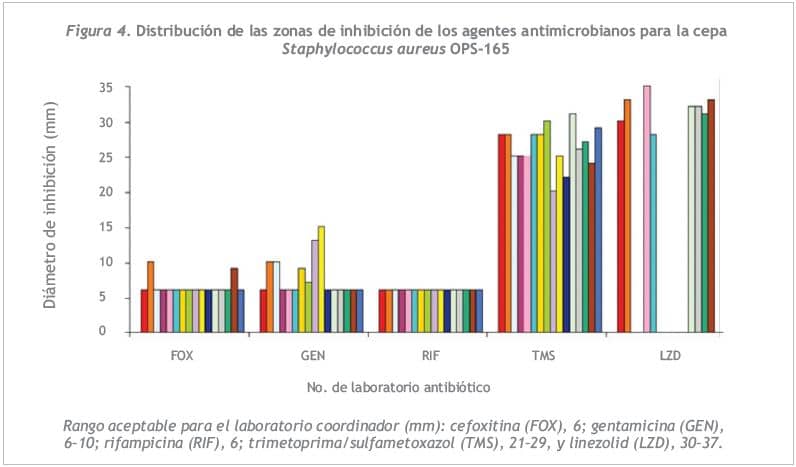
DISCUSIÓN
La necesidad de detectar de manera precisa los mecanismos de resistencia, como carbapene-masas y VISA, se debe fundamentalmente a la asociación de estos mecanismos con procesos infecciosos graves, cuyo tratamiento tiene alta probabilidad de fracasar.
El panel presentado a los laboratorios participantes fue de alta complejidad, ya que por primera vez deberían detectarse tres mecanismos nuevos en América Latina.
La concordancia en la detección de KPC, MBL y VISA fue de 76,4%, 73,3% y 66,7%, respectiva-mente.
Las carbapenemasas KPC y MBL han tenido alto impacto epidemiológico debido a su potencial de diseminación dentro de los hospitales y en la comunidad (10, 12, 28). La zona de inhibición de imipenem menor o igual a 22 mm o el valor de CIM mayor o igual 1 ug/mL por un método de referencia, junto con el efecto inhibitorio del APB y el EDTA, constituyen pasos claves para detectar cepas sospechosas de producir carbapenemasas (5, 11, 13–15). Los problemas que surgieron en la encuesta para detectar KPC en la cepa K. pneumoniae OPS-161 pueden atribuirse a que 11 laboratorios (64,7%) no contaban con discos de APB. Para suplir el déficit, en agosto de 2010, la OPS distribuyó discos de ABP a los 17 laboratorios del LA-EQAS. La concordancia en la detección de MBL en la cepa E. cloacae OPS-166 fue 73,3%. La dificultad en la detección de este mecanismo se debió a que solamente seis laboratorios (40,0%) hicieron la prueba con el disco de EDTA.
Una de las causas más frecuentes de infecciones hospitalarias y de la comunidad corresponde a infecciones por S. aureus. La vancomicina es el fármaco de elección para tratar a los pacientes con infecciones por cepas de S. aureus resis-tente a meticilina. No obstante, está bien documentado que una CIM mayor o igual a 2 ug/mL puede predecir una mala respuesta al tratamiento con vancomicina (29, 30).
Por otra parte, el método de difusión por discos no permite diferenciar la sensibilidad disminuida a vancomicina (22). La concordancia en la detección de resistencia intermedia a vancomicina en la cepa S. aureus OPS-165 fue de 66,7%, ya que cinco laboratorios informaron incorrectamente este aislamiento como sensible.
Con la excepción de dos laboratorios, todos evaluaron la CIM de la vancomicina. Los laboratorios deben incorporar la evaluación de la CIM de vancomicina a su labor cotidiana, ya que a medida que aumenta el valor de 0,5 a 2 se incrementa el fracaso terapéutico. A nivel general, la concordancia entre las zonas de inhibición y en los rangos de referencia obtenidos por los laboratorios participantes fue muy buena con respecto a los tres aislamientos: 90,8%, 92,8% y 88,9% para K. pneumoniae OPS-161, E. cloacae OPS-166 y S. aureus OPS-165, respectivamente. En los tres casos se superó el valor esperado para un laboratorio de referencia (mayor o igual a 80,0%).
A raíz de esta encuesta, se detectó que algunos laboratorios de referencia carecían de discos de APB y EDTA para la búsqueda de carbapenemasa, y que gran parte de ellos no cuentan con la técnica de PCR para detectar los genes implicados en los principales mecanismos de resistencia. Se espera que en el futuro próximo, y a partir de la incorporación de los discos de APB y EDTA, la CIM de vancomicina y la capacitación continua, mejore la detección de mecanismos de resistencia y se logre una concordancia de más de 90,0% en la interpretación de las pruebas de sensibilidad. Asimismo, se espera que los laboratorios de referencia incorporen gradualmente la técnica de PCR para detectar los genes de resistencia relevantes para la práctica clínica.
CONCLUSIÓN
El LA-EQAS resultó ser una excelente herramienta para determinar que los laboratorios nacionales de referencia de América Latina están preparados para detectar mecanismos de resistencia emergentes, como MBL, KPC y VISA.
La concordancia global en la detección de los tres mecanismos fue de 72,1% y la concordancia global en las zonas de inhibición fue 90,8%.
Es imprescindible que los laboratorios de microbiología clínica realicen cotidianamente la búsqueda de carbapenemasas y la detección de VISA. Tanto la sub-estimación como la sobre-estimación de estos mecanismos redundan en malas decisiones clínicas y epidemiológicas, con consecuencias los pacientes y la institución.
En particular, las carbapenemasas tienen una gran capacidad de propagación y requieren del máximo esfuerzo de todos los integrantes del equipo de salud para lograr su contención.
La dinámica de propagación y la aparición de nuevos mecanismos de resistencia hacen imprescindible que los laboratorios de referencia estén preparados para detectar y actuar rápidamente frente a cambios epidemiológicos.
—————–
Comité Colaborador de Expertos del LA-EQAS. Horacio Lopardo, Carlos Vay, Jorgelina Smayevsky y Marta Tokumoto.
Participantes del LA-EQAS. Bolivia, Esther Damiani y Giovanni García; Chile, María Soledad Prat y Aurora Maldonado; Colombia, María Elena Realpe; Costa Rica, Hilda Bolaños, Antonieta Jiménez y Elena Campos; Ecuador, Jeannette Zurita y Carmen Pesantes; El Salvador, Zandra Fuentes; Guatemala, Mercy Lucia Cabrera Morales; Honduras, Carmen Morales; México, Irma Hernandez Monroy; Nicaragua, Javiera Mejía; Panamá, Raquel Bolaños; Paraguay, Mario Fabián Martínez Mora; Perú, Rosa Sacsaquispe Contreras; República Dominicana, Loyda González; Uruguay, Teresa Camou; Venezuela, Reyna Ovalles y Daniel Marcano.
Agradecimientos. Agradecemos el apoyo de la Agencia de los Estados Unidos para el Desarrollo Internacional mediante el subsidio LAC-G-00-04-00002-00 otorgado a la Organización Panamericana de la Salud, y de la Agencia Española de Cooperación Internacional para el Desarrollo, a través de la línea de subsidio 230138.
Referencias Bibliográficas
1. Schmunis G, Salvatierra-Gonzalez R. Birth of a public surveillance System: PAHO combats the spread of antimicrobial resistance in Latin America. The APUA Newsletter Vol. 24 No 1, 2006.
2. Chaitram JM, Jevitt LA, Lary S, Tenover F, The WHO Antimicrobial Resistance Group. The World Health Organization´s External Quality Assurance System Proficiency Testing Program has improved the accuracy of antimicrobial susceptibility testing and reporting among participating laboratorios using NCCLS Methods. JCM. 2003;41:2372–7.
3. Corso A, Pasterán F, Ceriana P, Guerriero L, Callejo R, Prieto M, et al. Programa Latinoamericano de Control de Calidad en Bacteriología y Resistencia a los Antimicrobianos (LA-EQAS): siete años de experiencia. Rev Panam Infectol. 2008;10(4 Supl 1):S26–37.
4. Villegas MV, Lolans K, Correa A, Suarez CJ, Lopez JA, Vallejo M, et al. First detection of the plasmid-mediated class A carbapenemase KPC-2 in clinical isolates of Klebsiella pneumoniae from South America. Antimicrob Agents Chemother. 2006; 50(8):2880–2.
5. Marcano D, Pasterán F, Rapoport M, Faccone D, Ugarte C, Salgado N, et al. First isolation of a VIM-producing Klebsiella pneumoniae from a seven-year-old child in Venezuela. J Infect Dev Ctries. 2008;2(3):241.
6. Pasteran F, Otaegui L, Guerriero L, Radice G, Maggiora R, Rapoport M, et al. Klebsiella pneumoniae carbapenemase–2, Buenos Aires, Argentina. Emerg Infect Dis. 2008;14:1178–80.
7. Hawser SP, Bouchillon SK, Hoban DJ, Hackel M, Johnson JL, Badal RE. Klebsiella pneumoniae isolates possessing KPC beta-lactamase in Israel, Puerto Rico, Colombia and Greece. Int J. ntimicrob Agents. 2009;34(4):384–5.
8. Peirano G, Seki LM, Val Passos VL, Pinto MC, Guerra LR, Asensi MD. Carbapenemhydrolysing beta-lactamase KPC-2 in Klebsiella pneumoniae isolated in Rio de Janeiro, Brazil. J Antimicrob Chemother. 2009;63(2):265–8.
9. Pasteran F, Corso A. Alerta: diseminación de KPC en Argentina. Actualización mayo de 2010. Buenos Aires: Programa Nacional de Control de Calidad en Bacteriología (Argentina), Instituto Nacional de Enfermedades Infecciosas, ANLIS. “Dr. Carlos G. Malbrán”; 2010.
10. Cuzon G, Naas T, Truong H, Villegas MV, Wisell KT, Carmeli Y, et al. Worldwide diversity of Klebsiella pneumoniae that produce beta-lactamase blaKPC-2 gene. Emerg Infect Dis. 2010;16(9):1349–56.
11. Gómez S, Rapoport M, Togneri A, Viegas-Caetano J, Faccone D, Corso A, et al. Emergence of metallo-B-lactamases in Enterobacteriaceae from Argentina. Diagn Microbiol Infect Dis. 2011;69(1):94–7.
12. Gomez SA, Pasteran FG, Faccone D, Tijet N, Rapoport M, Lucero C, et al. Clonal dissemination of Klebsiella pneumoniae ST258 harboring KPC-2 in Argentina. Clin Microbiol Infect. 2011 Jun 11. doi: 10.1111/j.069 1.2011.03600.x.
13. Pasteran F, Mendez T, Guerriero L, Rapoport M, Corso A. Sensitive screening tests for suspected class A carbapenemasa production in species of Enterobac-teriaceae. J Clin Microbiol. 2009;47:1631–9.
14. Pasteran F, Mendez T, Rapoport M, Guerriero L, Corso A. Controlling false-positive results obtained with the Hodge and Masuda assays for detection of class a carba-penemase in species of Enterobacteriaceae by Incorpora-ting Boronic Acid. J Clin Microbiol. 2010;48:1323–32.
15. Clinical and Laboratory Standards Institute 2010. Performance Standards for Antimicrobial Susceptibility Testing; Twentieth Informational Supplement (June 2010). M100-S20-U. Wayne, PA, USA.
16. Lee K, Lim YS, Yong D, Yum JH, Chong Y. Evaluation of the Hodge test and the imipenem-EDTA double-disk synergy test for differentiating metallo-beta-lactamaseproducing isolates of Pseudomonas spp. And Acinetobacter spp. J Clin Microbiol. 2003;41:4623–9.
17. Oliveira GA, Dell’Aquila AM, Masiero RL, Levy CE, Gomes MS, Cui L, et al. Isolation in Brazil of nosocomial Staphylococcus aureus with reduced susceptibility to vancomycin. Infect Control Hosp Epidemiol 2001;22:443/8.
18. De Paz M, Staneloni M, Ceriana P, Visus M, Greco G, Corso A, et al. Primer caso de Staphylococcus aureus con resistencia intermedia a vancomicina (VISA) aislado en Argentina. X Congreso Argentino de la Sociedad Argentina de Infectología 2010, Mar del Plata. Mayo 2010.
19. Errecalde L, Ceriana P, Gagetti P, Erbin M, Corso A, Duarte A, et al. Primer aislamiento en Argentina de Sta-phylococcus aureus meticilino resistente de la comuni-dad (CAMRSA) con sensibilidad intermedia a vancomicina (VISA) y no sensibilidad a Daptomicina (NSDAP). Presen-tación póster. XII Congreso Argentino de Microbiología, VI Congreso de la Sociedad Argentina de Bacteriología, Micología y Parasitología Clínica—SADEBAC, I Congreso de Microbiología Agrícola y Ambiental. CABA.17–20 octubre.
20. Clinical and Laboratory Standards Institute 2010. Performance Standards for Antimicrobial Disk Susceptibility Test; Tenth Edition. Approved Standard. Document M2-A10.Wayne, PA, USA.
21. Clinical and Laboratory Standards Institute 2010. Methods for Dilution Antimicrobial Susceptibility Tests for Bacteria that Grow Aerobically; Eighth Edition. Approved Standard. Document M7-A8.Wayne, PA, USA.
22. Clinical and Laboratory Standards Institute 2010. Performance Standards for Antimicrobial Susceptibility Testing; Twentieth Informational Supplement. M100-S20.
Wayne, PA, USA.
23. European Committee on Antimicrobial Susceptibility Testing. Breakpoint tables for interpretation of MICs and zone diameters. 2010.
24. Melano R, Corso A, Petroni A, Centron D, Orman B, Pe-reyra A, et al. Multiple antibioticresistance mechanisms including a novel combination of extended–spectrum B-lactamases in a Klebsiella pneumoniae clinical strain isolated in Argentina. J Antimicrob Chemoter. 2003;53:36–42.
25. Sanger S, Micklen S, Coulson A. DNA sequencing with chain-terminating inhibitors. Proc. Natl. Acad. Sci USA. 1977;74:5463–7.
26. Organización Panamericana de la Salud/Organización Mundial de la Salud. Anexo OPS/DPC/CD/274/03. Comité de Expertos para definir estándares de evaluación del desempeño en el antibiograma (Kirby-Bauer)—áreas de inhibición o interpretación. Santiago, Chile, 24 al 26 de febrero de 2003. Informe Anual Regional de los Países Participantes en la Red de Monitoreo/Vigilancia de la Resistencia a los Antibióticos. Buenos Aires, Argentina. 10 al 13 de mayo, 2003.
27. Lovgren M, Talbot JA, Brandileone MC, Casagrande ST, Agudelo CI., Castañeda E, et al. Evolution of an international external quality assurance model to support laboratory investigation of Streptococcus pneumoniae. Developed for the SIREVA Project in Latin America, from 1993 to 2005. JCM. 2007;45:3184–90.
28. Kumarasamy KK, Toleman MA, Walsh TR, Bagaria J, Butt F, Balakrishnan R, et al. Emergence of a new antibiotic resistance mechanism in India, Pakistan, and the UK: a molecular, biological, and epidemiological study. Lancet Infect Dis. 2010;9:597–602.
29. Liu C, Bayer A, Cosgrove S, Daum R, Fridkin S, Gorwitz R, et al. Clinical practice guidelines by the Infectious Diseases Society of America for the treatment of methicillin-resistant Staphylococcus aureus infections in adults and children: Clin Infect Dis. 2011;52(3):285–92.
30. Rybak MJ, Lomaestro BM, Rotschafer JC, Moellering RC Jr, Craig WA, Billeter M, et al. Vancomycin therapeutic guidelines: a summary of consensus recommendations from the Infectious Diseases Society of America, the American Society of Health-System Pharmacists, and the Society of Infectious Diseases Pharmacists. J Clin Infect. Diseases. 2009;49:325–7.











