Anticuerpos anti-SARS-CoV-2: Evaluación del desempeño clínico de un método automatizado
Dario Jacobsen1, Diego Gonzalez1,2, Juan Jamardo3, Lucas Pugliese4, Carolina Ibar4, Federico Fortuna4, Verónica Ceres4, Belky Garzon3, María Eugenia Gómez1, Laura Giraudo4, Ayelen Balbi1, Eliana Duarte4, Analy Fritzler1, Beatriz Perazzi1,2, Elsa Carrizo5, Damian Zopatti6, Emilia Caro7, Esteban M. Repetto1,8, Graciela Reboredo9, Bibiana Fabre1,2.
1Universidad de Buenos Aires. Facultad de Farmacia y Bioquímica. Departamento de Bioquímica Clínica, Catedra de Bioquímica Clínica I. Buenos Aires, Argentina.
2Universidad de Buenos Aires. Facultad de Farmacia y Bioquímica. Instituto de Fisiopatología y Bioquímica Clínica (INFIBIOC). Buenos Aires, Argentina.
3Laboratorio de Endocrinología Dpto de Bioquímica Clínica. Hospital de Clínicas José de San Martin.
4Universidad de Buenos Aires. Facultad de Farmacia y Bioquímica. Residencia en Bioquímica Clínica.
5Coordinadora de Salud Misionar
6Universidad de Buenos Aires. Hospital de Clínicas José de San Martin. Dirección de Estadística y Archivo Médico.
7Laboratorios Biogenar
8Universidad de Buenos Aires. Consejo Nacional de Investigaciones Científicas y Técnicas (CONICET). Facultad de Farmacia y Bioquímica. Buenos Aires, Argentina.
9 Directora del área de Infectología de Misionar.

Introducción
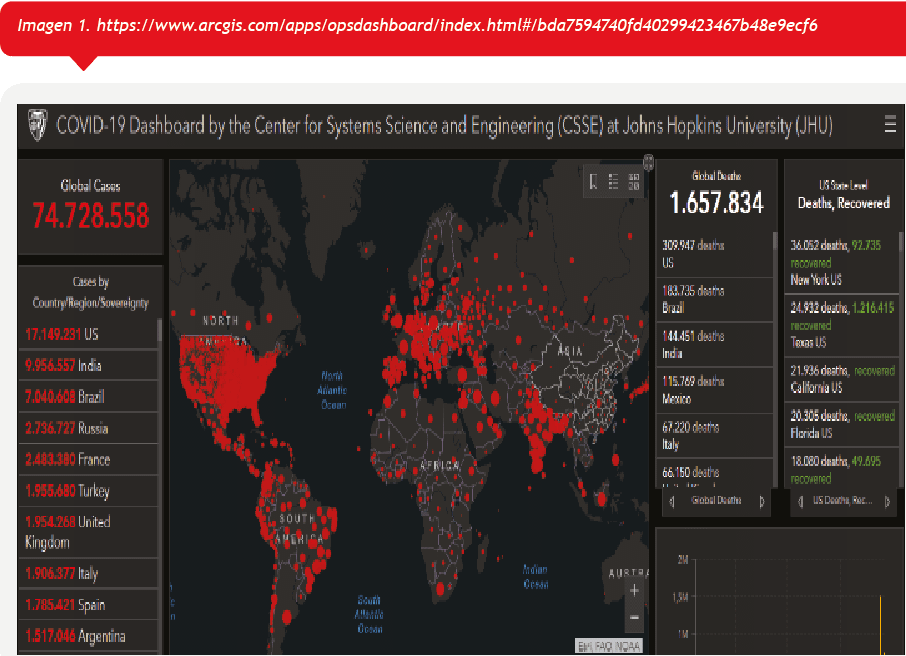
La enfermedad por coronavirus 2019 (COVID-19), ocasionada por el virus SARS-CoV-2 (coronavirus del síndrome respiratorio agudo grave tipo 2), se identificó por primera vez en diciembre de 2019 en la ciudad de Wuhan, capital de la provincia de Hubei, en la República Popular de China, al reportarse casos de un grupo de personas enfermas con un tipo de neumonía desconocida. La Organización Mundial de la Salud (OMS) la reconoció como una pandemia el 11 de marzo de 2020 hasta el 16 de diciembre de 2020, se ha informado de más de 74 millones de casos de la enfermedad en 254 países y territorios en el mundo (los cinco países con mayor número de infectados son Estados Unidos, India, Brasil, Rusia y Francia) con más de 1,6 millones de muertes (los cinco países con mayor cantidad de fallecidos son Estados Unidos, Brasil, India, México e Italia), más de 51,9 millones de casos de personas recuperadas (los cinco países con mayor número de personas recuperadas son India, Estados Unidos, India, Brasil, Rusia y Turquía). (Imagen 1)
Manifestaciones Clínicas
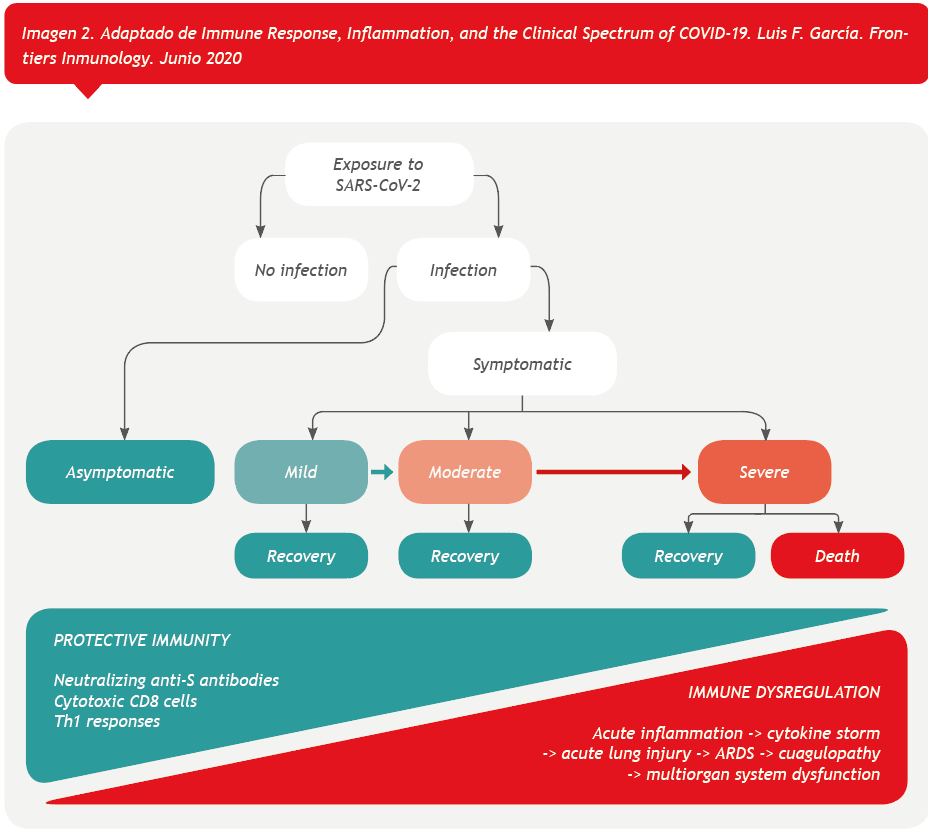
El proceso patológico de COVID-19 presenta un amplio espectro de manifestaciones clínicas, que van desde infecciones asintomáticas hasta infecciones leves (tipo resfriado común), moderadas y finalmente graves (15%); este último frecuentemente requiere hospitalización en Unidades de Cuidados Intensivos para asegurar soporte respiratorio asistido y otros tratamientos médicos hasta la recuperación, o muerte, del paciente. El amplio espectro de manifestaciones clínicas encontradas en pacientes con COVID-19 se ha asociado con factores de riesgo como el sexo y la edad. La diabetes, las enfermedades cardiovasculares o las enfermedades, o los tratamientos que afectan al sistema inmunológico, generan el mayor riesgo de enfermedad grave y muerte. Sin embargo, se estima que casi el 80% de todas las infecciones permanecen indocumentadas, ya sea porque los pacientes están asintomáticos o presentan síntomas muy leves. Desde el punto de vista epidemiológico, estas personas aparentemente infectadas pueden tener bajas cargas virales, mientras siguen diseminando el virus y, por lo tanto, pueden ser responsables de epidemias silenciosas, que conducen a la infección en personas más susceptibles que eventualmente desarrollarán una enfermedad clínica, o de contribuir al establecimiento de la inmunidad colectiva. El diagnóstico oportuno y preciso de la infección por SARS-CoV-2 es la piedra angular del tratamiento apropiado para los pacientes y es crucial para limitar la propagación del virus, especialmente porque los sujetos asintomáticos o levemente sintomáticos pueden ser responsables de la transmisión del virus. Por lo tanto, las pruebas asumen una relevancia crítica para garantizar una respuesta eficaz al brote de COVID-19. (Imagen 2)
Diagnóstico de la Infección por SARS-CoV-2
El método de referencia actual para el diagnóstico etiológico de la infección por SARS-CoV-2 es la detección del material genético del virus (ARNv) mediante la técnica de retro transcripción y amplificación por la reacción en cadena de la polimerasa (en tiempo real) en muestras del tracto respiratorio.
Respecto de los tests de detección de antígenos virales, éstos confirman la presencia del virus al detectar sus proteínas (antígenos), pero se ha demostrado en pruebas realizadas en pacientes con sospecha de infección por SARS-CoV-2, que podrían producir una alta tasa de falsos negativos en la práctica clínica.
La medición de anticuerpos específicos anti-SARS-CoV-2 en particular IgM e IgG, podría utilizarse como un método no invasivo adicional, pero, no sería de utilidad en el diagnóstico.
Respuesta de Anticuerpos en la Infección por SARS-CoV-2
La respuesta humoral consiste principalmente en la producción de anticuerpos contra la proteína S, bloquea la unión del virus a las células ACE2 + susceptibles.
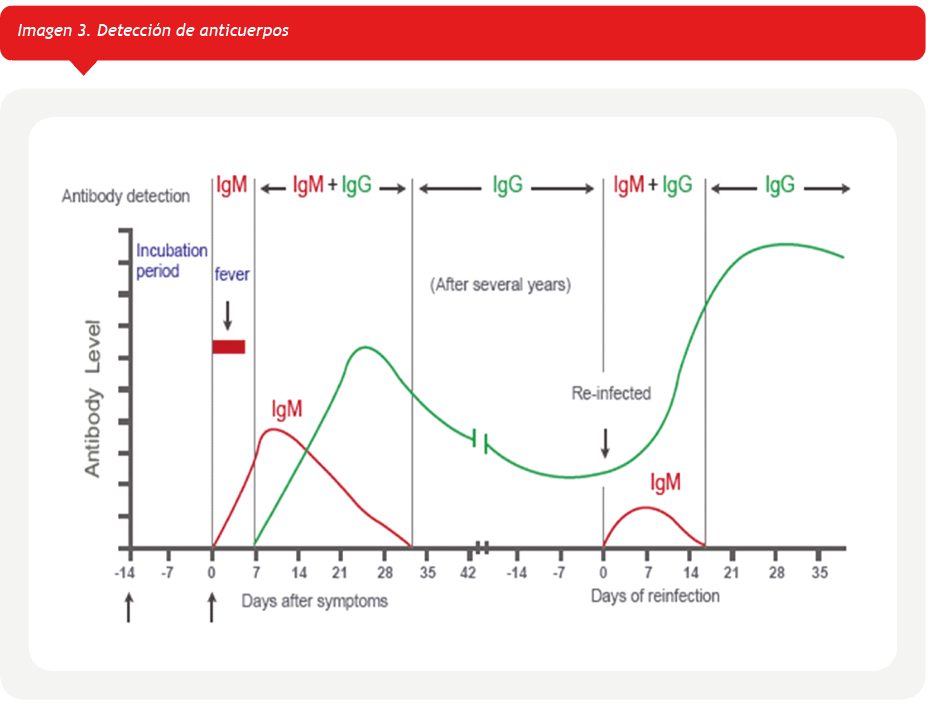
Los anticuerpos IgM e IgA pueden detectarse temprano durante la 1ª semana del inicio de los síntomas, mientras que los IgG pueden detectarse alrededor de 14 días después del inicio de los síntomas; sin embargo, dado el poco tiempo transcurrido desde el comienzo de la pandemia de COVID-19, no se sabe cuánto tiempo permanecerán activos los niveles protectores de estos anticuerpos bloqueadores.
En diferentes publicaciones se observa heterogeneidad en la sensibilidad de los anticuerpos durante el curso de la infección, pero en la mayoría de las mismas se evalúa su desempeño en la población norteamericana, europea o asiática por lo que desconocemos el desempeño en nuestro medio.
El valor diagnóstico de las pruebas serológicas para COVID-19 aún no está completamente definido, se debe señalar que el estudio de los anticuerpos contra diferentes antígenos del SARS-CoV-2, en diferentes poblaciones y en diversos momentos durante la pandemia, sería una forma importante de comprender la dinámica de transmisión y la seroprevalencia.
La respuesta de anticuerpos en pacientes infectados por SARS-CoV-2 continúa en investigación y la utilidad clínica de los test comercializados para detectar anticuerpos se encuentra en discusión. (Imagen 3)
La tendencia de los laboratorios a incorporar metodología automatizada en las últimas décadas se ha debido, en parte, a la búsqueda de mejores rendimientos analíticos (y clínicos) con respecto a métodos manuales o semicuantitativos, a expensas de mayores costos de procesamiento. En tiempo de pandemia, por otra parte, evaluar el desempeño clínico de los métodos disponibles para detectar anticuerpos anti SARS-CoV-2 se ha vuelto un tema fundamental en el laboratorio clínico, ya que el aporte de estas evaluaciones ha influido en el plan de acción tomado por las autoridades sanitarias para definir políticas de salud adecuadas en diferentes países.
Teniendo en cuenta todo esto nuestro objetivo fue evaluar el desempeño clínico de los reactivos Maglumi™ 2019-nCov IgM (CLIA) y Maglumi™ 2019-nCov IgG (CLIA) en pacientes del Laboratorio Biogenar y en personal de salud perteneciente al Hospital de Clínicas “José de San Martin” de la Ciudad de Buenos Aires, Argentina.
Materiales y métodos
Los reactivos Maglumi™ 2019-nCov IgM (CLIA) y Maglumi™ 2019-nCov IgG (CLIA) fueron evaluados entre los meses de julio y agosto del 2020 en el laboratorio de Endocrinología del Hospital de Clínicas “José de San Martin” con el apoyo de Gematec S.R.L., Laboratorio Biogenar y Mision-ar.
Estos reactivos fueron diseñados para la detección cualitativa en forma automatizada de anticuerpos específicos para SARS-CoV-2 presentes en suero y plasma de origen humano en el autoanalizador Maglumi 800.
En este estudio se realizó la evaluación de un panel de sueros compuesto por:
Individuos SARS–CoV-2 positivos clasificados por un método de PCR Real time en hisopado nasofaríngeo. El panel incluye sueros obtenidos en diferente tiempo trascurrido entre la toma de ambas muestras.
Individuos SARS-CoV-2 negativos clasificados por un método PCR Real time en hisopado nasofaríngeo. Cada suero fue obtenido en un tiempo cercano a la toma de muestra del hisopado. Los pacientes no presentaban antecedentes de resultados positivos por PCR.
Muestras pre-pandémicas: Sueros conservados a -20°C cuya toma de muestra fue anterior al surgimiento de la pandemia COVID-19 en nuestro país.
En total, se evaluaron 106 muestras de pacientes PCR positivos y 61 de pacientes PCR negativos, incluyendo en este último grupo 5 muestras prepandémicas. La composición del panel se esquematiza en el siguiente gráfico (Imagen 4):
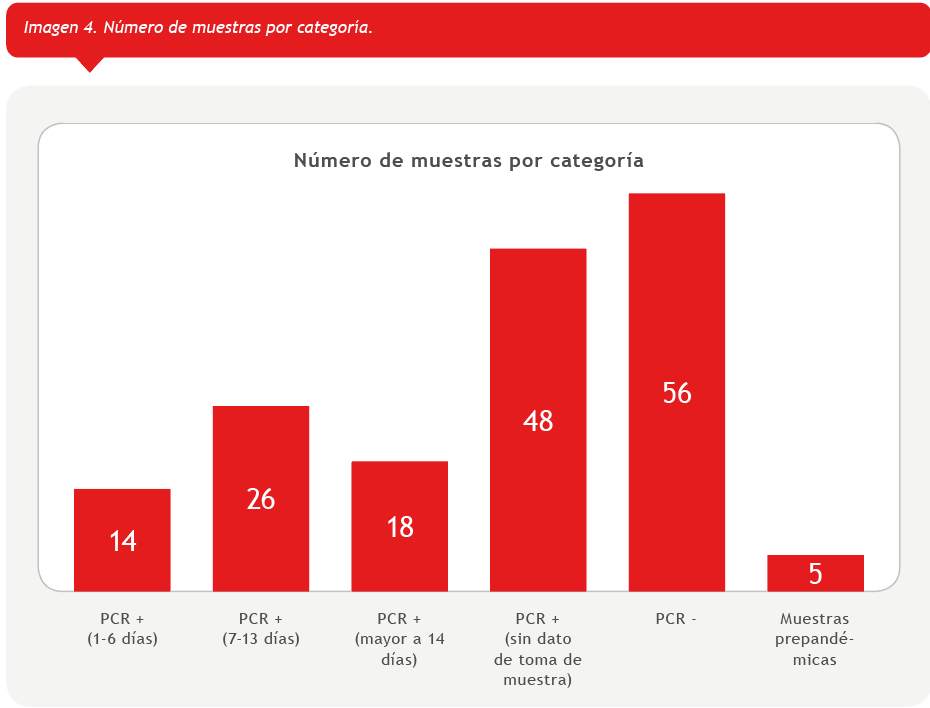
El número y composición de las muestras fueron seleccionados para proporcionar estimaciones e intervalos de confianza que permiten evaluar el desempeño clínico del test en un contexto de emergencia, según recomendaciones de FDA (2) y CLSI (3). Para cada anticuerpo se definió la concordancia positiva (sensibilidad) y concordancia negativa (especificidad) junto a los intervalos de confianza, según el método descripto en la guía EP-12 CLSI (3). Además, se determinó el índice Kappa de Cohen y su intervalo de confianza para evaluar concordancia general entre ambos métodos. También se combinaron los resultados IgM/IgG con el fin de evaluar mejoras en el desempeño respecto al análisis de ambos anticuerpos por separado. Para tal fin se clasificaron las muestras como positivas cuando al menos un anticuerpo supera el valor de corte.
Las muestras fueron analizadas en el entorno del laboratorio clínico por técnicos y Bioquímicos respetando las recomendaciones declaradas por el fabricante. Al evaluar los resultados se debe considerar que fueron obtenidos en muestras de suero y no son indicativos del desempeño en otras matrices como plasma o sangre entera.
Resultados
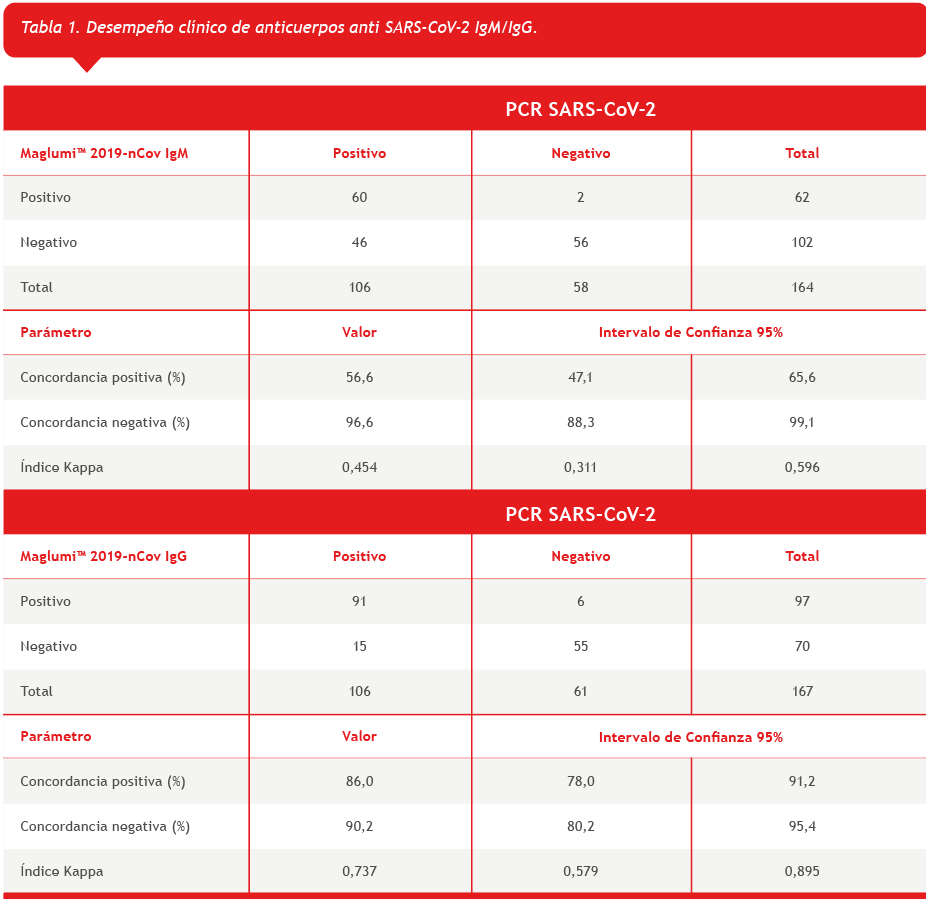
El reactivo Maglumi™ 2019-nCov IgM presentó una concordancia positiva de 56,6 % (IC 47,1 – 65,6%) y una concordancia negativa de 96,6 % (IC 88,3 – 99,1%) con los resultados de RT-PCR para SARS-CoV-2. Mientras que Maglumi™ 2019-nCov IgG presentó una concordancia positiva de 86,0 % (IC 78,0 – 91,2%) y una concordancia negativa de 90,2 % (IC 80,2 – 95,4 %). Estos resultados se describen en la tabla 1.
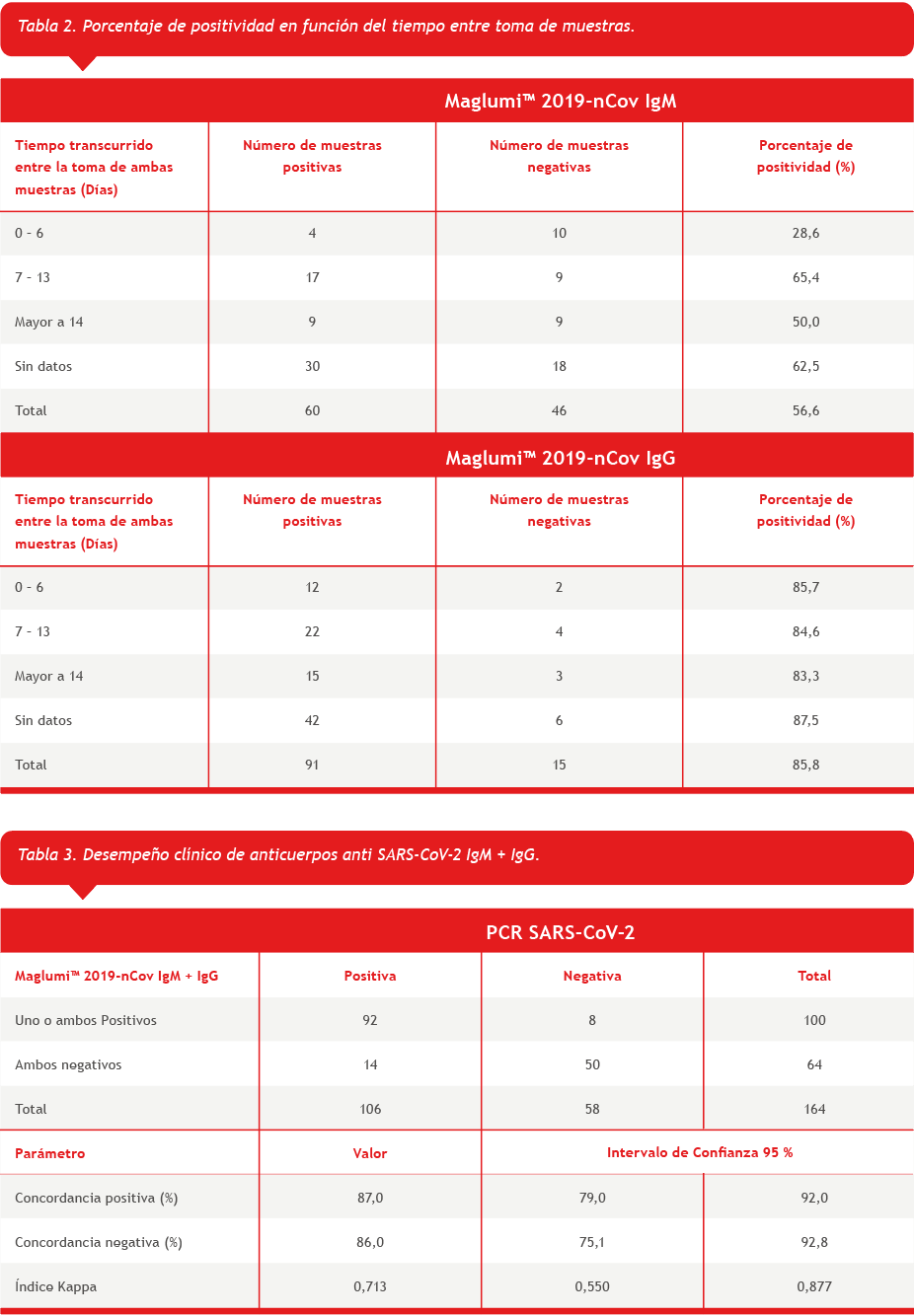
El análisis de porcentaje de positividad de las 106 muestras en función del tiempo transcurrido entre la toma de muestra del hisopado nasofaríngeo y el suero se resume la tabla 2.
Si se combina el resultado de ambos anticuerpos se obtiene una concordancia positiva de 87,0 % (IC 79,0 – 92,0 %) y una concordancia negativa de 86,0 % (IC 75,1 – 92,8%). Estos resultados se describen en la tabla 3.
Discusión
En la validación de Maglumi™ 2019-nCov IgM el fabricante declara una sensibilidad del 78,6%, evaluando un total de 89 muestras con resultados positivos para PCR (4). En base a los resultados obtenidos comprobamos que la sensibilidad fue inferior en nuestra población, según el diseño experimental propuesto. No obstante, se verificó la especificidad de 97,5% declarada por el fabricante quien evaluó un total de 200 muestras negativas. Respecto al acuerdo general, los anticuerpos IgM presentaron una fuerza de concordancia moderada con un valor Kappa de 0,45. Los datos obtenidos demuestran un riesgo de obtener resultados negativos para anticuerpos IgM en pacientes que podrían presentar un resultado de PCR positivo y encontrarse en infección activa. Esto podría ser producto de la relación entre el desempeño del test, la cinética de aparición de anticuerpos y la respuesta inmunológica de cada individuo, factores que actualmente continúan en etapa de investigación.
En la validación de Maglumi™ 2019-nCov IgG el fabricante declara una sensibilidad del 91,0 %, evaluando un total de 91 muestras con resultados positivos para PCR (5). En base a los resultados obtenidos se verificó la sensibilidad declarada por el fabricante. No obstante, se obtuvo una especificidad menor, siendo la declarada por el fabricante 97,3 % al evaluar un total de 750 muestras. Respecto a la concordancia general los anticuerpos IgG presentaron un alto grado de acuerdo con un valor Kappa de 0,74, lo que fundamentaría su utilidad para estudios de seroprevalencia en nuestra población.
Al evaluar los resultados combinados, el valor de sensibilidad fue igual al obtenido para IgG ya que solo una muestra PCR positiva presentó un valor de IgM positivo/IgG negativo. En la especificidad combinada se evidenció un valor inferior al obtenido cuando se analiza cada anticuerpo de forma individual lo que es esperable ya que, en condiciones de pandemia, se acepta disminuir la especificidad para aumentar la sensibilidad del ensayo. El fabricante declara en la validación un valor de sensibilidad combinada entre 89,9 – 95,6 % y especificidad combinada del 96,5%. En este estudio se obtuvo similar sensibilidad, aunque menor especificidad. Según los resultados obtenidos los valores de IgM se deben analizar en conjunto con los resultados de IgG para mejorar la sensibilidad de la prueba, aumentando su valor a un 87 % (IC 79,0 – 92,0%) a expensas de disminuir levemente la especificidad del ensayo.
En la actualidad, la respuesta de anticuerpos en pacientes infectados por SARS-CoV-2 como hemos visto continua en investigación y la utilidad clínica de los tests de anticuerpos se encuentra en discusión. El uso extendido se limita a estudiar la seroprevalencia de la población, información que será importante para comprender el alcance de la pandemia. Los riesgos de obtener resultados falsos negativos podrían limitarse a individuos que fueron testeados en etapas tempranas de la infección, que cursen enfermedad leve o se desconoce su respuesta inmunológica al virus. Estos eventos continúan en estudio.
Conclusión
En el presente estudio se evaluó el desempeño clínico de los reactivos Maglumi™ 2019-nCov IgM/IgG en nuestra población. Se verificó la sensibilidad de IgG y se obtuvo una especificidad inferior a la declarada por el fabricante. IgM presentó una sensibilidad inferior al valor declarado por el fabricante, aunque se verificó el valor de especificidad informado. En este caso, es necesario analizar el resultado en conjunto con los valores obtenidos para IgG con el fin de aumentar la sensibilidad.
En resumen, concluimos que los reactivos serían útiles para el estudio de seroprevalencia en nuestra población teniendo en cuenta las consideraciones que se han discutido a lo largo del trabajo.
Referencias Bibliográficas
Lu H., Stratton C.W., Tang Y.W. Outbreak of pneumonia of unknown etiology in Wuhan China: the mystery and the miracle. J Med Virol. 2020.
Hui D.S., E I.A., Madani T.A., Ntoumi F., Kock R., Dar O. The continuing 2019-nCoV epidemic threat of novel coronaviruses to global health – the latest 2019 novel coronavirus outbreak in Wuhan, China. Int J Infect Dis. 2020; 91:264–266.
Gorbalenya A.E.A. Severe acute respiratory syndrome-related coronavirus: the species and its viruses–a statement of the Coronavirus Study Group. BioRxiv. 2020 doi: 10.1101/2020.02.07.937862.
https://www.arcgis.com/apps/opsdashboard/index.html#/bda7594740fd40299423467b48e9ecf6.
https://www.worldometers.info/coronavirus/
Jiumeng Sun 1, Wan-Ting He 1, Lifang Wang 2, Alexander Lai 3, Xiang Ji 4, Xiaofeng Zhai 1, Gairu Li 1, Marc A Suchard 4, Jin Tian 5, Jiyong Zhou 6, Michael Veit 7, Shuo Su 8. COVID-19: Epidemiology, Evolution, and Cross-Disciplinary Perspectives.Trends Mol Med. 2020 May;26(5):483-495. doi: 10.1016/j.molmed.2020.02.008. Epub 2020 Mar 21.
Chen T,Wu D, ChenH, YanW, Yang D, Chen G, et al. Clinical characteristics of 113 deceased patients with coronavirus disease 2019: retrospective study. BMJ. (2020) 368:m1091. doi: 0.1136/bmj.m1091
Wu C, Chen X, Cai Y, Xia J, Zhou X, Xu S, et al. Risk factors associated characteristics of coronavirus) with acute respiratory distress syndrome and death in patients with coronavirus disease 2019 pneumonia in Wuhan, China. JAMA Intern Med. (2020). doi: 10.1001/jamainternmed.2020.0994. [Epub ahead of print]
Fauci AS, Lane CH, Red?eld RR. Covid-19–navigating the uncharted. N Engl J Med. (2020) 382:1268–9. doi: 10.1056/NEJMe2002387.
Li R, Pei S, Chen B, Song Y, Zhang T, Yang W, et al. Substantial. undocumented infection facilitates of novel coronavirus (SARS-CoV2). Science. (2020) 368:489– 31.
Huang AT, Garcia-Carreras B, Hitchings TDM, Yang B, Katzelnick L, Rattigan MS, et al. A systematic review of antibody mediated immunity to coronaviruses: antibody kinetics, correlates of antibody responses with severity of disease. medRxiv [Preprint]. (2020). doi: 10.1101/2020.04.14.20065771
Guo L, Ren L, Yang S, XiaoM, Chang D, Yang F, et al. Pro?ling early humoral response to diagnose novel coronavirus disease (COVID-19). Clin Infect Dis. (2020). doi: 10.1093/cid/ciaa310. [Epub ahead of print]
Theel ES, Slev P, Wheeler S, Couturier RM, Wong JS, Kadkhoda K. The role of antibody testing for SARS-CoV-2: is there one? J Clin Microbiol. (2020). doi: 10.1128/JCM.00797-20. [Epub ahead of print].
Okba NMA, Muller AM, Li W, Wang C, Geurtsvan Kessel HC, Corman MV, et al. SARS-CoV-2 speci?c antibody responses in COVID-19 patients. medRxiv. (2020). doi: 10.1101/2020.03.18.20038059
Deeks JJ, Dinnes J, Takwoingi Y, Davenport C, Spijker R, Taylor-Phillips S, Adriano A, Beese S, Dretzke J, Ferrante di Ruano L, Harris IM, Price MJ, Dittrich S, Emperador D, Hoo.L, Leeflang MMG, Van den Bruel A. Antibody tests for identification of current and past infection with SARS-CoV-2. Cochrane Database of Systematic Reviews 2020, Issue 6. Art. No.: CD013652. DOI: 10.1002/14651858.CD013652.
Policy for Coronavirus Disease-2019 Tests During the Public Health Emergency (Revised). Immediately in Effect Guidance for Clinical Laboratories, Commercial Manufacturers, and Food and Drug Administration Staff Document issued on the web on May 11, 2020.
CLSI. User Protocol for Evaluation of Qualitative Test Performance; Approved Guideline—Second Edition. CLSI document EP12-A2. Wayne, PA: Clinical and Laboratory Standards Institute; 2008.
271 2019-nCoV IgM-en-EU, V2.0, 2020-03. Snibe Ref 130219016M
272 2019-nCoV IgG-en-EU, V2.0, 2020-03. Snibe Ref 130219015M









