Utilidad de la fracción libre de antígeno prostático específico como factor pronóstico del estadio patológico en pacientes de prostatectomía radical
Viveros Elías J.M., Rojas Buendía L., Solares Sánchez M.E., Lamm Wiechers L., Morales Montor J.G., Pacheco Gabhler C. y Calderón Ferro F.
División de Urología, Hospital General “Dr. Manuel Gea González”, SS, México D.F.
Correspondencia: Dr. José Manuel Viveros Elías. Hospital General “Dr. Manuel Gea González”. Servicio de Urología. Calzada de Tlalpan 4800, Col. Toriello Guerra. Delegación Tlalpan. 14000 México D.F.
Tel.: 5665-3511 ext. 173. Fax: 5665-7681.
Resumen
Antecedentes. La combinación de calificación de Gleason, examen digital rectal (EDR) y APE total (APE-T) son los principales factores pronósticos de extensión extracapsular. Sin embargo, 1/3 de los tumores clínicamente localizados están subestadificados. Un bajo porcentaje de la fracción libre de APE (APE-FL) se relaciona con tumores más agresivos.
Evaluamos la utilidad del APE-FL para pronosticar el estadio patológico de cáncer prostático clínicamente localizado.
Material y métodos. Se estudió a 137 pacientes sometidos a prostatectomía radical (1991-2005); 34 contaban con APE-T (2.5-10) y APE-FL. Evaluamos edad, EDR, APE-T, APE-FL y calificación de Gleason preoperatorios, así como la extensión extracapsular a vesículas seminales o ganglios, invasión perineural y calificación de Gleason postoperatorios.
Resultados. Observamos enfermedad localizada en 59%, extensión extracapsular en 32%, invasión a vesículas seminales en 9% y a ganglios en 3%. Los valores promedio de APE-FL en casos de enfermedad confinada al órgano fue 16% y 12% en tumores localmente avanzados; con APE-FL ? 15% en 50% y 86%, respectivamente. El riesgo de estadio localmente avanzado con APE-FL ? 15% fue 3 veces mayor, en comparación con la APE-FL >15%.
Conclusión. Nuestros resultados con 34 pacientes se correlacionan con los informados mundialmente.
Cuando el APE-FL es APE-FL menor o igual al 15% se asocia con un estadio patológico peor. Se encontró una estrecha relación, sin alcanzar significación estadística.
Sugerimos basarse en los valores de APEFL, junto con los de APE-T, EDR y calificación de Gleason preoperatorios para pronosticar el estadio patológico con mayor precisión.
Palabras clave: próstata, cáncer, APE, antígeno prostático específico, fracción libre, calificación de Gleason, prostatectomía radical.
Summary
Background
Total prostatic-specific antigen (t-PSA), Gleason score and digital rectal exam (DRE) are the main predictors of extracapsular extension. However, up to 1/3 of the clinically localized tumors can be sub-staged. Low percent free PSA (f-PSA) has been associated to aggressive tumors.
We evaluated the use of f-PSA to predict the pathological stage in patients with clinically localized prostate cancer.
Materials and Methods
One hundred and thirty seven patients with clinically localized prostate cancer underwent radical prostatectomy from April 1991 to July 2005. In 34 patients we evaluated age, DRE, t-PSA, f-PSA and Gleason score preoperatively, and extracapsular extension, seminal vesicles or lymph node involvement, Gleason score and neural invasion postoperatively.
Results
Organ confined disease was observed in 59%, extracapsular extension in 32%, seminal vesicles invasion in 9% and lymph node invasion in 3%. Mean f-PSA values for organ confined and locally advanced cancer were 16% and 12%, with f-PSA menor o igual al 15% in 50% and 86%, respectively. The risk of non-organ confined disease was 3 times higher with f-PSA menor o igual al 15%, compared to f-PSA > 15 percent.
Conclusions
Our results with 34 patients correlate to those reported in world literature. A worse pathological outcome is associated to f-PSA menor o igual al 15%. A strong association was found without reaching significance. We suggest the use of f-PSA in conjunction with t-PSA, DRE and Gleason score to predict the pathological outcome.
Key Words: prostate cancer, PSA, percent free PSA, prostatic specific antigen, Gleason score, radical prostatectomy.
Introducción
El adenocarcinoma de próstata ocupó el primer lugar en número de diagnósticos de cáncer en Estados Unidos, con 189,000 nuevos casos en 2002.1
En México, en población masculina, en el año 2000 ocupó el segundo lugar en frecuencia (sólo después del áncer de piel) alcanzando un 17% de todas las neoplasias diagnosticadas. En México, en el mismo año, se informó de 5,397 nuevos casos, los que corresponden a una tasa de 11 por cada 100,000 hombres vivos. Esta neoplasia causó 3,852 muertes, con una tasa de mortalidad de 12 por cada 100,000 hombres.2
En los últimos quince años se ha observado un incremento en la incidencia del cáncer de próstata debido al uso del antígeno prostático específico (APE) para su diagnóstico. A su vez, también se ha detectado un aumento en el diagnóstico de tumores patológicamente organoconfinados, desde la introducción del APE, en comparación con los casos diagnosticados por examen digital rectal (EDR).
Lo anterior se debe a técnicas quirúrgicas más precisas y a un diagnóstico más temprano, gracias al escrutinio con APE.1,3 A finales de la década de los 1990 se demostró que el uso del porcentaje de la fracción libre del APE (APE-FL) es útil cuando el APE total (APE-T) se encuentra entre 4 y 10; además, en fecha reciente se comprobó que también es de utilidad diagnóstica cuando el APE-T se encuentra entre 2.5 y 4.5
El uso de nomogramas y factores preoperatorios permite hacer una mejor selección de los pacientes que serán sometidos a prostatectomía radical, con la finalidad de excluir a los de alto riesgo de recurrencia; para evitar la morbilidad agregada que confiere la cirugía (principalmente disfunción eréctil e incontinencia urinaria).8
El grado patológico (calificación de Gleason) de las biopsias, el estadio clínico (examen digital rectal) y el APE total preoperatorios son los principales factores pronósticos de signos patológicos adversos y recurrencia en pacientes de prostatectomía radical.8 Sin embargo, por lo menos un tercio de los pacientes con tumores clínicamente localizados se encuentran subestadificados. 10,11 Una mejor estadificación clínica podría ayudar en la selección del mejor tratamiento para cada paciente y evitar la morbilidad asociada con un procedimiento quirúrgico innecesario.
El objetivo del estudio fue evaluar la utilidad delporcentaje de APE-FL para pronosticar carcinoma de próstata localmente avanzado o invasión perineural en pacientes sometidos a prostatectomía radical retropúbica por carcinoma de próstata clínicamente organoconfinado.
Material y Métodos
Se realizó un análisis retrospectivo de los expedientes de 137 pacientes, a quienes se practicó prostatectomía radical retropúbica, entre Abril de 1991 y Julio de 2005, por adenocarcinoma de próstata (confirmado histológicamente por biopsia transrectal) clínicamente organo confinado.
Los criterios de inclusión fueron: determinación preoperatoria de APE-FL, APE-T entre 2.5 y 10, y no haber recibido radioterapia u hormonoterapia neoadyuvante, ni tratamiento con finasteride en los 6 meses previos a la medición del APE. La técnica de determinación del APE fue radioinmunoanálisis (RIA).
Las variables analizadas fueron: edad, APE-T, APE-FL, tacto rectal, calificación de Gleason y presencia de invasión perineural preoperatorios; así como extensión extracapsular, invasión a vesículas seminales y ganglios linfáticos regionales, calificación de Gleason e invasión perineural postoperatorios.
Se definió como tumores organoconfinados a los que no tenían extensión extracapsular, márgenes quirúrgicos positivos, invasión a vesículas seminales ni metástasis a ganglios linfáticos regionales y se clasificaban como localmente avanzados con cualquiera de estos factores. El análisis estadístico se realizó mediante pruebas de estadística descriptiva, con base en medidas de tendencia central y dispersión, determinación de sensibilidad, especificidad y x2 (ji cuadrada) de Mantel-Haenszel, con el paquete estadístico EPI6.
Resultados
Se incluyó en el estudio a 34 pacientes con expediente y estudios pre y postoperatorios completos.
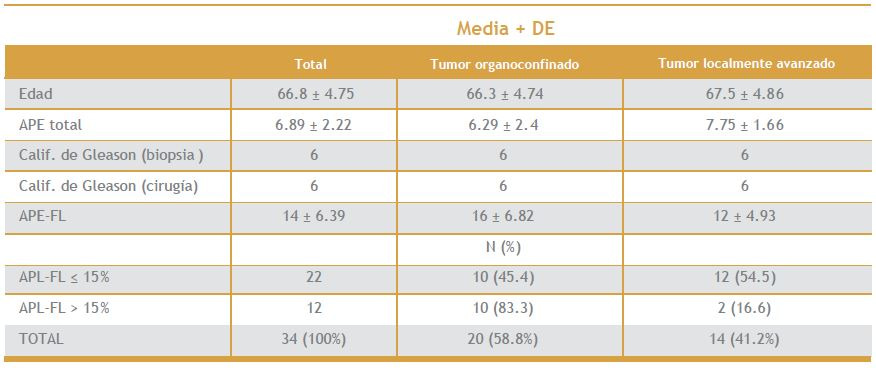
Tabla 1 (primer tabla a la derecha). Características clínicas de los 34 pacientes sometidos a prostatectomía radical
La edad promedio de fue de 66.8 años (59-75; DE 4.75) (tabla 1). El estadio clínico más frecuente fue T1c (n = 9), seguido de T2a (n = 9), T2b (n = 3) y T2c (n = 3), que correspondieron al 55.8%, 26.4%, 8.8% y 8.8%, respectivamente (figura 1). Se encontró enfermedad organoconfinada en 58.8% (20) y localmente avanzada en 41.2% de los casos;14 en 3 (8.8%) de éstos se encontró invasión a vesículas seminales, en 11 (32.3%) hubo extensión extracapsular y 1 (2.9%) tenía invasión a ganglios linfáticos (figura 2). Además, en 20 (59%) pacientes se detectó invasión perineural (figura 3). El APE-T inicial promedio fue de 6.29 (DE 2.4) para los organoconfinados y de 7.75 (DE 1.66) para los localmente avanzados. El porcentaje de APE-FL promedio fue de 16% (DE 6.82) para los organoconfinados y de 12% (DE 4.93) para los localmente avanzados; se observó que 86% de los pacientes con cáncer de próstata localmente avanzado tenía APEFL de 15% o menor. Mediante análisis estadístico, se encontró una asociación entre APE-FL menor o igual al 15% y la enfermedad localmente avanzada 3 veces mayor, con riesgo relativo de 2.0 (intervalo de confianza 0.69-5.8) y razón de momios de 3.0 (intervalo de confianza 0.52-19.09); aunque al realizarse la prueba de x2 de Mantel- Haenszel (1.94) no alcanzó significación estadística (p = 0.16). Considerando un punto de corte del APE-FL de 15% se obtuvo sensibilidad de 84% y especificidad de 45%, con valor pronóstico positivo de 50% y valor pronóstico negativo de 75% (figura 3). Entre los pacientes con APE-FL mayor a 15% se observó que 83.3% tenía tumores organoconfinados y 16.7% enfermedad localmente avanzada. En el grupo con APE-FL menor o igual a 15%, el 54.5% de los pacientes presentó enfermedad localmente avanzada.
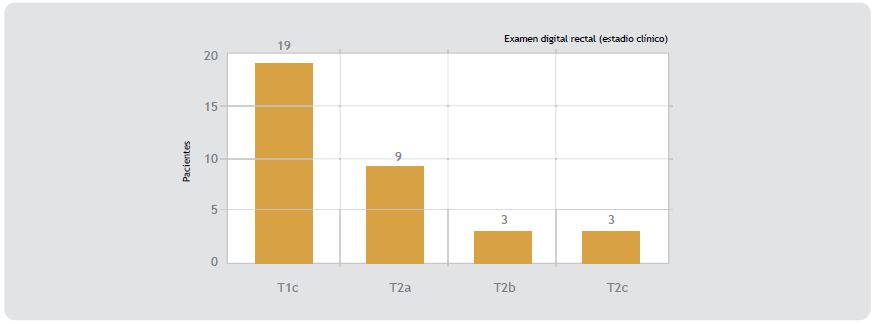
Figura 1 (Segunda imagen a la derecha). Estadio clínico preoperatorio.El estadio clínico preoperatorio (EDR) de los 34 pacientes estudiados fue T1c en 19, T2a en 9, T2b en 3 y T2c en 3, correspondiente a 55.8%, 26.4%, 8.88% y 8.88%, respectivamente.
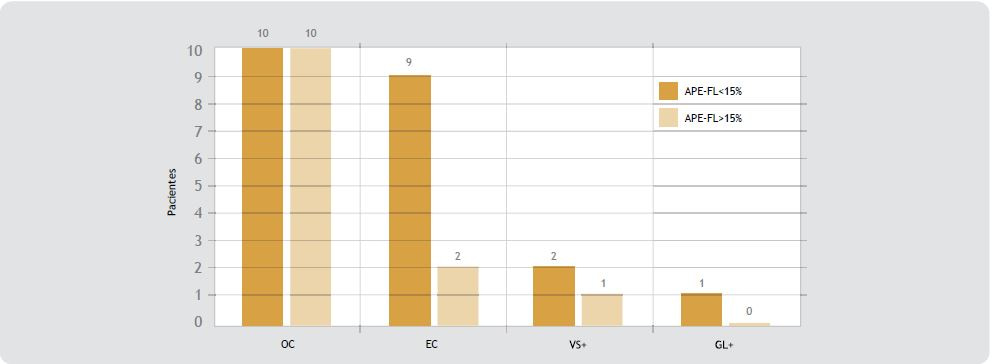
Figura 2. Reporte histopatológico prostatectomía radical. Se encontró igual proporción de pacientes organoconfinados en ambos grupos, mientras que predominó el APE-FL <15% en los localmente avanzados. OC= organoconfinado, EC= extensión extracapsular, VS+= invasión a vesículas seminales, GL+= invasión a ganglios linfáticos regionales.
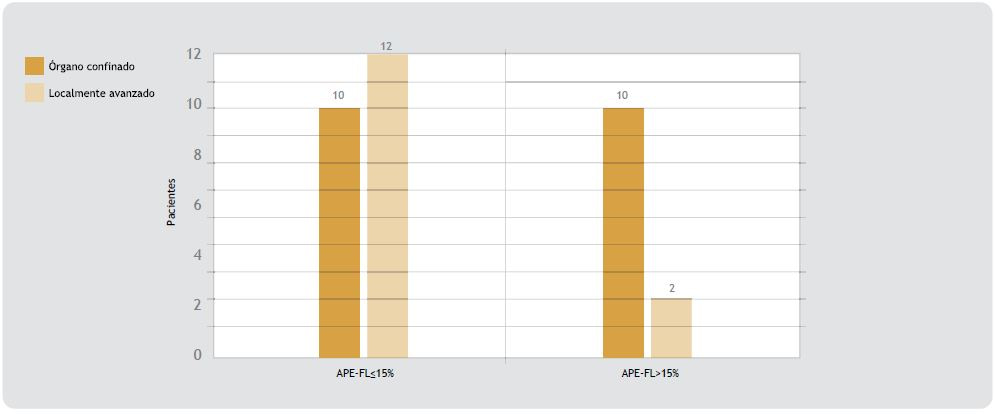
Figura 3. Relación APE-FL y estadio patológico. Se encontró mayor proporción de pacientes con tumores organoconfinados en el grupo con APE-FL > 15%, aunque la diferencia no fue estadísticamente significativa. P=0.16, RM 3.0 (IC 0.52-19.09), RR 2.0 (IC 0.69-5.8), sensibilidad de 84%, especificidad de 45%, VPP 50%, VPN de 75 por ciento.
Al analizar la asociación entre APE-FL menor o igual a 15% y la invasión perineural postoperatoria, se encontró una asociación 2 veces mayor (intervalo de confianza 0.37-11.02) en los pacientes con APEFL ?menor o igual al 15%, sin significación estadística (p = 0.35).
Comentarios
En Estados Unidos, la supervivencia general a 5 años de pacientes con diagnóstico de cáncer de próstata es de 81%.9 El pronóstico a largo plazo para pacientes después de prostatectomía radical y la toma de decisiones terapéuticas dependen de un pronóstico preciso del estadio y grado patológicos previos a la cirugía. El potencial curativo del tratamiento quirúrgico es mayor cuando el tumor se encuentra organoconfinado.10 A los pacientes con cáncer de próstata clínicamente organoconfinado (APE-T <20, EDR S T2c), edad menor a 75 años y esperanza de vida mayor a 10 años (dependiendo de comorbilidades) se les ofrece tratamiento potencialmente curativo, ya sea prostatectomía radical o radioterapia. En la mayoría de estos casos, el pronóstico es bueno, en términos de supervivencia enfermedad específica. Lai y cols. informaron sobre supervivencia de 94-98% cáncer específica a 10 años, en 11,429 pacientes a los que se practicó prostatectomía radical en nueve regiones geográficas del programa SER (US Surveillance, Epidemiology and End Results) en 2001. Sin embargo, en una serie de 2,782 pacientes a quienes se realizó la misma operación por enfermedad clínicamente localizada, Amling informó que un alto porcentaje de pacientes (41%) sufrió recurrencia bioquímica (elevación del APE) a 10 años.6,7 Aunque el APE total (APE-T) se utiliza ampliamente como marcador tumoral en la detección temprana, estadificación y seguimiento de pacientes con carcinoma de próstata, no es sirve para el pronóstico de enfermedad organoconfinada o no organoconfinada en pacientes con tumores clínicamente localizados.4,21 El uso del porcentaje de APE-FL ha resultado eficaz para la detección temprana de cáncer de próstata; sin embargo, su utilidad para pronosticar estadio patológico y grado de diferenciación es controversial. Aun más, se desconoce todavía el fundamento molecular de la menor proporción de APE-FL observado en pacientes con carcinoma de próstata.4 Diversos autores han sugerido su utilidad para detectar en forma preoperatoria a los pacientes con signos patológicos adversos (extensión extracapsular, márgenes positivos, invasión perineural, invasión a vesículas seminales y ganglios linfáticos regionales) en la prostatectomía radical.10, 11, 13-15
La finalidad de nuestro estudio fue evaluar la asociación entre APE-FL preoperatorio y el resultado histopatológico de la prostatectomía radical, con miras a utilizar al APE-FL como una herramienta que permita seleccionar mejor a pacientes con tumores clínicamente organoconfinados para prostatectomía radical. Esto permitirá reservar la cirugía para los que tengan bajo riesgo de encontrarse en estadio localmente avanzado.
En nuestra serie no se encontró diferencia de edad significativa entre los pacientes con enfermedad organoconfinada o localmente avanzada (66.3 y. 67.5, respectivamente), lo cual concuerda con lo informado en la bibliografía mundial y lo observado previamente en nuestra institución.22
El estadio clínico más frecuente fue T1c (55.8%), lo que refleja una detección más tempana del cáncer de próstata en los años recientes, desde la introducción del APE-FL para su detección, en 1999.
En cuanto al porcentaje de APE-FL promedio, utilizamos el punto de corte de 15%, con base en estudios previos que demuestran mayor nivel de sensibilidad para pronosticar enfermedad localmente avanzada. En el estudio de Pannek y cols., con 263 pacientes, se observó un valor pronóstico positivo de 76% al usar un punto de corte del APEFL en 15 por ciento.10
Observamos una diferencia en el valor promedio del APE-FL entre el grupo con tumor organoconfinado (16%) y el de neoplasia no organoconfinada (12%); esto resultó aún más marcado al encontrar que en 83% del grupo de pacientes con cáncer localmente avanzado el APE-FL era menor o igual a 15%; mientras que 83% de los pacientes con esta fracción por arriba de 15% tenía tumores organoconfinados. Al comparar nuestros resultados con los informes previos encontramos la misma tendencia hacia un mayor estadio patológico y calificación de Gleason mayor en los pacientes con APE FL menor a 15%. En un estudio multicéntrico y prospectivo, Southwick y cols. Demostraron que el porcentaje de APEFL puede ayudar a la estadificación del cáncer de próstata clínicamente localizado. Esos investigadores notaron que 75% de los pacientes con APE-FL mayor a 15% tenían cáncer organoconfinado, calificación de Gleason menor a 7 y tumores pequeños (10% o menos de afección a la próstata), a diferencia del 34% en os pacientes con 15% o menor nivel de APE-FL.10,11 Estos resultados son compatibles con los obtenidos por Elgamal y cols.,13 Pannek y cols., 14 y Morote y cols.15 En éste último estudio, de 220 casos, se observó asociación entre APE-FL > 11% y signos patológicos favorables, en pacientes con APE-T de 4.0 a 10 y EDR normal. Por el contrario, en sus estudios Bangma y cols.17 y Lemer y cols.18 no pudieron demostrar correlación significativa entre la APE-FL y los resultados patológicos. Del mismo modo, en el estudio de Jung y cols.19 se observó que no hubo diferencia en cuanto a positividad de ganglios linfáticos respecto de la APE-FL.
En nuestra serie, 83.3% de los pacientes con APE-FL mayor a 15% tuvo cáncer organoconfinado, mientras que 54.5% de los pacientes con APE-FL menor o igual a 15% sufría enfermedad localmente avanzada. En el único paciente que se encontraron ganglios linfáticos con invasión neoplásica el APE-T inicial fue de 8.1 y el APE-FL 10%, con estadio clínico T1c. En él, se decidió realizar linfadenectomía pélvica exploradora, a pesar de contar con APE-T menor a 10, debido a que durante la disección se encontraron ganglios macroscópicamente sospechosos. En dos de los tres casos con invasión a vesículas seminales el APE FL era ? 15%. En cuanto a la invasión perineural no encontramos ninguna asociación significativa entre ésta y el porcentaje de APE-FL.
Conclusión
En el presente estudio se observó una estrecha relación entre el porcentaje de APE-FL y signos patológicos adversos, aunque en nuestro análisis no alcanzó significación estadística, dado lo reducido de la muestra; lo que indica la necesidad de realizar estudios con poblaciones mayores, reuniendo la experiencia de otros centros hospitalarios. Nuestros resultados sugieren utilizar el APE-FL en la evaluación preoperatoria de pacientes que serán sometidos a prostatectomía radical en conjunto con los factores de riesgo preoperatorios que han demostrado correlación con un estadio patológico avanzado y recurrencia temprana, como APE-T preoperatorio, examen digital rectal y signos histológicos en las biopsias (calificación de Gleason, porcentaje de tumor, etc.).
Agradecimientos
Agradecemos el apoyo brindado por el Dr. Eduardo Montalvo Jave y el Dr. Alberto Salazar Valadez, del Departamento de Investigación de nuestro hospital, para el manejo estadístico y metodología del estudio.
Referencias Bibliográficas
1. Ung J, Richie J, Chen M, Renshaw A. Evolution of the presentation and pathologic and biochemical outcomes after radical prostatectomy for patients with clinically localized prostate cancer diagnosed during the PSA era. Urology. 2002; 60:458-463.
2. Compendio de Cáncer 2000 / Registro Histopatológico de Neoplasias Malignas de México. Secretaría de Salud. 2002. [En línea:/www.epi.org.mx]
3. Anderson J. Does PSA testing influence the natural history of prostate cancer? Eur Urol. (Suppl) 2002;1:3-10.
4. Takatsugu O, Moriaku K, Kikuo N, Eiji H. Prognostic value of three molecular forms of prostate-specific antigen ratios in patients with prostate adenocarcinoma. Urology. 2001;57:936-942.
5. Raaijmakers R, Blijenberg BG, Finlay JA, et al. Prostate cancer detection in the prostatic specific antigen range of 2.0 to 3.9 ng/ml: value of precent free prostate specific antigen on tumor aggressiveness. J Urol. 2004;171:2245-2249.
6. See W. PSA changes in early prostate cancer: implications for patient management. Eur Urol. (Suppl) 2002;1:17-23.
7. Amling C, Blute M, Bergstralh E, Seay T, Slezak J, Zincke H. Long-term hazard of progression after radical prostatectomy for clinically localized prostate cancer: continued risk of biochemical failure after 5 years. J Urol. 2000;164:101-5.
8. Quinn D, Henshall S, Brenner P, Kooner R, Golovsky D, O’Neill G, et al. Prognostic significance of preoperative factors in localized prostate carcinoma treated with radical prostatectomy. Cancer. 2003;97:1884-93.
9. Schellhammer P. An evaluation of biclutamide in the treatment of prostate cancer. Expert Opin Pharmacother. 2002;3:1313-1328.
10. Southwick P, Catalona W, Partin A, Slawin K, Brawer M, Flanigan R, et al. Prediction of post-prostatectomy pathological outcome for stage T1c prostate cancer with percent free prostate specific antigen: A prospective multicenter clinical trial. J Urol. 1999;162:1346-351.
11. Sankar K, Blute M, Sebo T, Leibovich B, Bergstralh E, Slezak J. Prognostic significance of positive surgical margins in patients with extraprostatic carcinoma after radical prostatectomy. Cancer. 2002;95:1215-9.
12. Richie J. Management of patients with positive surgical margins following radical prostatectomy. Urol Clin North Am. 1994;21:717-722.
13. Elgamal A, Comillie F, Van Poppel H, et al. Free-tototal prostate specific antigen ratio as a signal test for detection of significant stageT1c prostate cancer. J Urol. 1996;156:1042-1047.
14. Pannek J, Rittenhouse H, Chan D, et al. The use of percent free prostate specific antigen for staging clinically localized prostate cancer. J Urol. 1998;159: 1238-1242.
15. Morote J, Encabo G, De Torres 1, et al. Use of precent free prostate- specific antigen as a predictor of the pathological features of clinically localized prostate cancer. Eur Urol. 2000;38:225-9.
16. Pannek J, Subong E, Jones K, et al. The role of free/total prostate specific antigen ration in the predicition of final pathologic stage for men with clinically localized prostate cancer. Urology. 1996;48(suppl):51-54.
17. Bangma C, Kranse R, Blijenberg B, et al. The free-tototal serum prostate specific antigen ratio for staging prostate carcinoma. J Urol. 1997;157:544-547. 1
18. Lemer S, Jacobsen S, Lilja H, et al. Free, complexed and total prostate specific antigen concentrations and their proportions in predicting stage, grade, and deoxyribonucleic acid ploidy in patients with adenocarcinoma of the prostate. Urology. 1996;48:240-248.
19. Jung K, Elgeti U, Lein M, et al. Ratio of free or complexed prostate specific antigen (PSA) to total PSA: Which ratio improves differentiation between benign prostatic hyperplasia and prostate cancer? Clin Chem. 2000;46:55-62.
20. Weiss R, George N, O’Reilly P. Comprehensive Urology. Ed. Mosby International. Reino Unido 2001; pp. 395-428.
21. Krumho1tz J, Carvalhal G, Ramos C, Smith D, Phatarapom T, et al. Prostate- specific antigen cutoff of 2.6 ng/mL for prostate cancer screening is associated with favorable pathologic tumor features. Urology. 2002;60:469-74.
22. Solares ME, Soel J, Calderón F, et al. Análisis de supervivencia en pacientes sometidos a prostatectomía radical, en población mexicana. Seguimiento a cinco años. Rev Mex Urol. 2004;64:54-66.





