Hemofilia A neonatal: reporte de un caso en Sincelejo (Colombia). Caso clínico
Jorge Mendoza-Herrera (1), Edward Carvajalino Santiago (2), Nelson Muñoz Álvarez (3), Carlos Moneriz Pretell (4)
(1) Residente de pediatría. Hospital Infantil Napoleón Franco Pareja, Facultad de Medicina, Universidad de Cartagena (Colombia). drjormenh21@hotmail.com
(2) Semillero de Medicina. Laboratorio de Bioquímica, Facultad de Medicina, Universidad de Cartagena (Colombia). carsancon@hotmail.com
(3) Médico Pediatra. Hospital Infantil Napoleón Franco Pareja. Cartagena (Colombia). crisca53@gmail.es
(4) Docente investigador de Bioquímica, Ph.D. Laboratorio de Bioquímica, Facultad de Medicina, Universidad de Cartagena (Colombia).cmonerizpretel@yahoo.com
Correspondencia: Carlos Moneriz Pretell. Campus de Zaragocilla, Laboratorio de Bioquímica, Facultad de Medicina, Universidad de Cartagena (Colombia).Teléfono: (055) 6698176 ext. 130; fax: (055) 6698177. cmonerizpretel@yahoo.com.
Salud Uninorte. Barranquilla (Col.) 2013; 29 (1): 139-144
Resumen
La hemofilia es una enfermedad hemorrágica hereditaria caracterizada por la deficiencia funcional o cuantitativa del factor VIII (hemofilia A) o del factor IX (hemofilia B) de la coagulación. El diagnóstico de la hemofilia es eminentemente clínico; situación clave que ofrece una ventana de oportunidad para que el médico de primer nivel de atención establezca un diagnóstico oportuno y eficiente. Los datos clínicos de los dos tipos de hemofilia son sustancialmente idénticos y varían solo en relación con el grado de la deficiencia.
En este trabajo se describe un caso de un recién nacido que presentó un hematoma como consecuencia de una venopunción. El paciente presentó prolongación en el tiempo parcial de tromboplastina y una disminución del Factor VIII de la coagulación, confirmándose el diagnóstico de hemofilia A. Se inició tratamiento con factor VIII recombinante y el paciente presentó una gran mejoría de cuadro clínico.
Este trabajo tiene como objetivo alertar al cuerpo médico sobre la importancia de considerar esta enfermedad dentro del diagnóstico diferencial en los síndromes hemorrágicos del recién nacido, incluso sin la existencia de antecedentes familiares.
El tratamiento apropiado generará un impacto positivo en la salud de los pacientes y su familia, reduciendo con ello las complicaciones, costos por hospitalización y muerte.
Palabras clave: Coagulación sanguínea, factor VIII, hemofilia A, neonatos, hemorragia, hematoma.
Introducción
Las hemofilias son enfermedades genéticas que alteran la coagulación de la sangre y constituyen un desorden recesivo ligado al cromosoma X (1). Las hemofilias más conocidas son las que se expresan por defecto en los factores de la coagulación VIII (hemofilia A) o IX (hemofilia B) y presentan una incidencia de 1:5000 niños nacidos vivos (2).
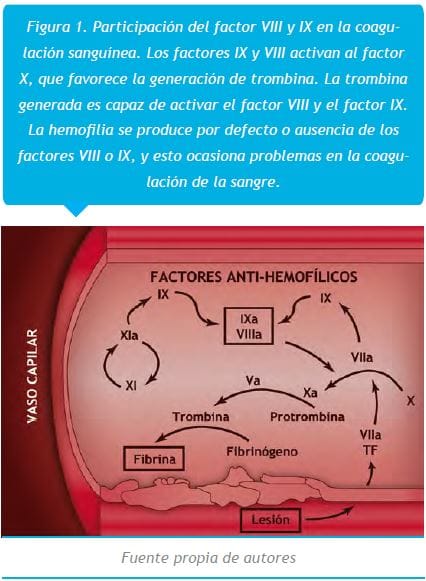
La hemofilia A es clínicamente similar a la hemofilia B, debido a que los dos factores participan en el mismo paso de formación del filamento de fibrina (2, 3). Los factores VIII y IX tienen un rol fundamental en la coagulación de la sangre participando en la generación adecuada de la trombina (figura 1). En ausencia del factor VIII o factor IX se produciría sangrado, debido a que la sola actividad del factor Xa es insuficiente para mantener la hemostasia (2, 4).
El cuadro clínico de la hemofilia A se caracteriza por sangrados recurrentes, especialmente en las articulaciones (hemartrosis) y músculos (hematomas), y en casos más graves, hemorragias internas y afecciones del sistema nervioso central (5). La frecuencia y la gravedad del sangrado en la hemofilia generalmente se correlaciona con el nivel o la actividad del factor de coagulación (VIII o IX) en el plasma y es clasificada como: severa (<0,01 UI/mL o
Este artículo describe un caso de hemofilia A neonatal, y enfatizamos en la importancia de considerar esta enfermedad dentro del diagnóstico diferencial en los síndromes hemorrágicos del recién nacido; incluso sin la existencia de antecedentes familiares de primer grado.
Presentación del caso
Se trata de un paciente de 25 días de nacido, sexo masculino, producto del séptimo embarazo con nacimiento a término, procedente de Sincelejo (Colombia), que consultó por un cuadro clínico de 7 días de evolución, consistente en eritema umbilical, edema y secreciones purulentas malolientes.
Se hospitalizó con diagnóstico de onfalitis y se inició tratamiento antibiótico con oxacilina intravenosa. Como consecuencia de la venopunción, el paciente desarrolló un hematoma persistente. Los exámenes de laboratorio de la química sanguínea se encontraron normales, a excepción del tiempo de tromboplastina tisular (TPT), que resultó ser >120 segundos.
De acuerdo con estos resultados de laboratorio, el paciente es remitido e ingresado al servicio de Urgencias del Hospital Infantil Napoleón Franco Pareja de la ciudad de Cartagena (Colombia).
En el examen físico se encontró un paciente en aceptables condiciones generales. Como hallazgo relevante se encontró un hematoma de 2 cm de diámetro en el tercio distal del antebrazo izquierdo (figura 2) y con escasa secreción purulenta en el ombligo.

El paciente fue hospitalizado y se manejó con cefotaxima y vancomicina. El análisis de los resultados de laboratorio en este periodo revelaron: una anemia de tipo normocítica, prolongación en el TPT: 69,2 (rango normal 30-40 seg) y solo una disminución del factor VIII de la coagulación: 1% (rango normal 50-150%), confirmándose, de esta forma, el diagnóstico de hemofilia A. Se suspendió la antibióticoterapia, se inició tratamiento con factor VIII recombinante y se trasfundió con glóbulos rojos empacados para mejorar los niveles de hemoglobina.
El paciente presentó una significativa mejoría de cuadro clínico con resolución del hematoma. Se le ordenó el alta médica y seguimiento por el servicio de hemato- oncología-pediátrica.
Discusión
Las hemofilias son trastornos hemorrágicos hereditarios y se diagnostican frecuentemente a partir de los tres años de edad y muy pocas veces se manifiestan en el periodo neonatal (6). La hemofilia en el período neonatal supone un reto clínico de gran relevancia; el trauma del proceso de parto, la circuncisión, las inyecciones y las punciones en el talón someten al paciente a un estrés adicional (7). En este reporte de caso la hemofilia se manifestó como consecuencia de la realización de la venopunción realizada como tratamiento antibiótico de una onfalitis.
Teniendo en cuenta lo anterior, en nuestro paciente se sospecha de hemofilia por el sangrado persistente, referido por los familiares, y la formación del hematoma en la extremidad respectiva.
Estudios de cohorte recientes sugieren que el 15 a 33% de los casos pueden presentar manifestaciones hemorrágicas durante el primer mes de vida (8).
Es importante investigar la hemofilia y otros trastornos hemorrágicos hereditarios en neonatos y lactantes que presenten un sangrado anormal. Desafortunadamente, la literatura reporta que los retrasos en el diagnóstico son comunes en estas condiciones (9).
Aproximadamente el 30% de todos los casos de hemofilia se produce en ausencia de una historia familiar positiva, y por lo tanto puede pasar desapercibida al nacer. En esta situación, se necesita de una alta sospecha clínica con el fin de facilitar la investigación y el tratamiento adecuado en este grupo de edad (6). Muchos de estos casos surgen como consecuencia de una nueva mutación, y puede no haber antecedentes personales de problemas de sangrado.
En ausencia de antecedentes familiares, como sucedió en nuestro paciente, el diagnóstico de la deficiencia del factor VIII se hace generalmente después de un episodio de sangrado, 18-54% de los que se producen durante el primer mes de vida (10). Por ello es importante que los recién nacidos que presentan signos de sangrado anormal sean debidamente investigados para confirmar la presencia de trastornos hemorrágicos hereditarios como la hemofilia y que estas investigaciones incluya no solo las pruebas de detección de referencia de la coagulación (TP, TPT), sino también los ensayos adecuados de medición de niveles de factores de coagulación (11).
Los factores de coagulación en el recién nacido no atraviesan la placenta y se sintetizan en el feto desde las primeras etapas de desarrollo (12). A pesar de esto, el sistema hemostático neonatal es fisiológicamente inmaduro al nacer, lo cual afecta los niveles de proteínas procoagulantes y puede reflejarse en la prolongación de los parámetros de referencia de la coagulación. Por lo general se recomienda que los laboratorios de procesamiento de un gran número de muestras de recién nacidos obtengan sus propios rangos de referencia locales. En la práctica, esto puede no ser factible, y puede ser necesario el uso de los rangos normales publicados; sin embargo, estos deben ser interpretados con cuidado (13).
Reportes de casos publicados, tanto en el pasado y más recientemente, sugieren que a menudo existe una falta de reconocimiento de los sangrados anormales y que las investigaciones adecuadas a menudo se retrasan o se malinterpretan; lo que inevitablemente da lugar a una incapacidad para manejar estos casos apropiadamente (9). Lo anterior podría explicarse también debido a que el patrón de sangrado observado en los recién nacidos con hemofilia es muy diferente al que normalmente se presenta en los niños mayores, en los que predominan las hemorragias en músculos y articulaciones (6).
El diagnóstico rápido y oportuno es importante porque en las hemofilias graves neonatales existe un riesgo elevado de sangrado intracraneal y extracraneal que puede comprometer la vida del paciente (14). Las hemorragias intracraneales (HIC) durante el período neonatal afectan a un 3,5-4,0% de todos los niños con hemofilia en países con un buen nivel de atención de la salud (15).
En el paciente reportado, el diagnóstico y tratamiento oportuno lograron evitar hasta el momento la severidad de la enfermedad.
El tratamiento actual indicado para la prevención o el manejo de hemofilia A y B en recién nacidos consiste en el uso de factor VIII y factor IX recombinantes, respectivamente (16-18). Esto se fundamenta sobre la probabilidad de que estos productos se asocian con menor riesgo de transmitir infecciones virales. Los factores recombinantes no están ampliamente disponibles en algunos centros hospitalarios. Esto pone de relieve nuevamente la importancia de una buena comunicación entre los grupos de especialistas en la gestión para asegurar el suministro del producto, en el caso de que una madre embarazada se encuentre en un sitio distante al centro de atención del paciente hemofílico.
Es importante resaltar que en un bebé de sexo masculino, con un historial familiar de hemofilia, es recomendable obtener una muestra de sangre del cordón umbilical para la detección de los niveles de los factores de coagulación (16). Por otro lado, la administración profiláctica de vitamina K por vía intramuscular en recién nacidos se debe retrasar hasta que el diagnóstico de la hemofilia se descarte en pacientes con antecedentes familiares positivos (6). El diagnóstico también se puede hacer en forma prenatal entre la 9ª y la 11ª semana del embarazo mediante una muestra del velo coriónico o de una muestra de sangre fetal en una etapa posterior (18 semanas o más de embarazo) (6).
Finalmente, la hemofilia debe considerarse dentro del diagnóstico diferencial en las alteraciones hemorrágicas del recién nacido, incluso sin la existencia de antecedentes familiares.
Los pacientes con hemofilia deben ser tratados en centros de hemofilia y/o hospitales de segundo y tercer nivel que cuenten con profesionales expertos integrados en un equipo multidisciplinario. El apoyo de las asociaciones nacionales e internacionales de hemofílicos, sumado al trabajo conjunto del personal de salud y familiares, son suficientes para superar esta enfermedad en etapas tempranas, incluso en el ambiente de desamparo de muchas familias colombianas.
Agradecimientos: A la Facultad de Medicina de la Universidad de Cartagena y al director, personal médico y para médico del Hospital Infantil Napoleón Franco Pareja, que facilitaron el acceso a la información.
Consideraciones éticas: Este estudio de caso clínico se consideró de riesgo mínimo y cumplió con las normas éticas para la investigación en humanos contempladas en la Resolución 008430 de 1993 del Ministerio de Salud de Colombia.
Conflicto de interés: Los autores manifiestan que no presentan conflicto de interés con respecto a esta investigación.
Financiación: Vicerrectoría de Investigaciones de la Universidad de Cartagena en el plan de fortalecimiento y sostenibilidad de grupos categorizados por Colciencias.
Referencias Bibliográficas
(1) Oldenburg J, Ananyeva NM, Saenko EL. Molecular basis of haemophilia A. Haemophilia 2004;10 (Supl 4):133-9.
(2) Bolton-Maggs PH, Pasi KJ. Haemophilias A and B. Lancet 2003;3 61(9371):1801-9.
(3) Spronk HM, Govers-Riemslag JW, ten Cate H. The blood coagulation system as a molecular machine. Bioessays 2003;25(12):1220-8.
(4) Bowen DJ. Haemophilia A and haemophilia B: molecular insights. Mol Pathol 2002; 55(1):1-18.
(5) White GC, 2nd, Rosendaal F, Aledort LM, Lusher JM, Rothschild C, Ingerslev J. Definitions in hemophilia. Recommendation of the scientific subcommittee on factor VIII and factor IX of the scientific and standardization committee of the International Society on Thrombosis and Haemostasis. Thromb Haemost 2001; 85(3): 560.
(6) Chalmers EA. Haemophilia and the newborn. Blood Rev 2004;18(2):85-92.
(7) Kenet G, Chan AK, Soucie JM, Kulkarni R. Bleeding disorders in neonates. Haemophilia 2010; 16 (Supl 5):168 – 75.
(8) Chambost H, Gaboulaud V, Coatmelec B, Rafowicz A, Schneider P, Calvez T. What factors influence the age at diagnosis of hemophilia? Results of the French hemophilia cohort. J Pediatr 2002; 141(4): 548 – 52.
(9) Myles LM, Massicotte P, Drake J. Intracranial hemorrhage in neonates with unrecognized hemophilia A: a persisting problem. Pediatr Neurosurg 2001; 34(2):94 – 7.
(10) Hart AR, Wong CM, Gibson AT. Unusual presentation of neonatal haemophilia A. Arch Dis Child Fetal Neonatal Ed 2007; 92 (4): F324.
(11) Barrowcliffe TW. Monitoring haemophilia severity and treatment: new or old laboratory tests? Haemophilia 2004;10 (Supl 4):109 -14.
(12) Reverdiau-Moalic P, Delahousse B, Body G, Bardos P, Leroy J, Gruel Y. Evolution of blood coagulation activators and inhibitors in the healthy human fetus. Blood 1996; 88 (3):900- 6.
(13) Andrew M, Paes B, Milner R, Johnston M, Mitchell L, Tollefsen DM et al. Development of the human coagulation system in the healthy premature infant. Blood 1988; 72 (5):1651-7.
(14) Kulkarni R, Lusher J. Perinatal management of newborns with haemophilia. Br J Haematol 2001; 112 (2): 264 – 74.
(15) Ljung R, Chambost H, Stain AM, DiMichele D. Haemophilia in the first years of life. Haemophilia 2008; 14 (Supl3):188 – 95.
(16) Chalmers E, Williams M, Brennand J, Liesner R, Collins P, Richards M. Guideline on the management of haemophilia in the fetus and neonate. Br J Haematol 2011; 154 (2): 208-15.
(17) Keeling D, Tait C, Makris M. Guideline on the selection and use of therapeutic products to treat haemophilia and other hereditary bleeding disorders. A United Kingdom Haemophilia Center Doctors’ Organisation (UKHCDO) guideline approved by the British Committee for Standards in Haematology. Haemophilia 2008; 14(4): 671-84.
(18) Williams MD, Chalmers EA, Gibson BE. The investigation and management of neonatal haemostasis and thrombosis. Br J Haematol 2002;119 (2): 295 – 309.






